弓形虫蛋白质翻译后修饰研究进展
尹德琦,魏子巍,张义伟,桑晓宇,杨 娜,冯 颖,陈 冉,姜 宁
(沈阳农业大学动物科学与医学学院,沈阳 110866)
弓形虫是一种专一性的顶复门胞内寄生虫,被认为是世界上分布最广泛的人畜共患病之一[1-2]。刚地弓形虫的生命周期很复杂,主要以两种感染形式存在:包括快速复制的速殖子和缓慢分裂的缓殖子。尽管弓形虫通常会导致成年人和免疫力正常的人产生轻度症状,但对母体中发育的胎儿和免疫功能低下的人造成严重的危害,甚至可能危及生命[3-4]。此外,弓形虫病能够引起家畜流产,严重影响养殖业的经济效益。在日常生活中,人和温血动物通常会因受到包囊或卵囊污染的食物或水而感染。目前,治疗弓形虫的有效药物仅限于少数代谢抑制剂,包括乙胺嘧啶、磺胺类药物、螺旋霉素和克林霉素等[5]。这些药物具有一定的局限性和细胞毒性,因此寻找新的且有效的药物靶标迫在眉睫。
PTMs通过将共价修饰连接到多肽链上,扩展了20种蛋白质氨基酸的化学组成和信息含量,增加了蛋白质的功能性。大多数的PTMs会在多肽链合成(翻译)后进行连接,因此通常称为“翻译后修饰”(PTMs)[6]。PTMs是将一些化学基团共价偶联到蛋白质特定氨基酸上的过程,包括磷酸化、糖基化、泛素化、琥珀酰化、甲基化、乙酰化、巴豆酰化和二羟基异丁酰化修饰等[7-9]。PTMs(例如甲基化、乙酰化、SUMO酰化和琥珀酰化等)及它们之间的相互作用能够参与宿主先天免疫和炎症的调节过程,为传染性和免疫性疾病的发病机制以及潜在治疗途径提供理论基础[10]。迄今为止,大约有461 种不同类型的PTMs 已被Uniprot数据库所收录(http://www.uniprot.org/docs/ptmlist),且在微生物、人、动物和植物等方面均发挥着重要功能[11]。PTMs可以在蛋白质的生命周期中的任何时间发生,并且可以通过改变目标蛋白质活性、定位、蛋白质-蛋白质相互作用以及其他功能等。即使同一种蛋白质仅发生一种类型的修饰,也可能具有多种功能;如果同一蛋白质上的相同PTM发生在不同的氨基酸上,则其功能也将不同;如果相同的蛋白质发生不同的修饰类型,那么其功能和涉及的生物学过程更加复杂。因此,PTMs极大地增加了蛋白质组的多样性和复杂性。弓形虫在不同的发育阶段表达不同的数量的蛋白质,但仅仅是数量的变化无法满足其复杂生命过程的需要,需要PTMs的参与。PTMs能够使蛋白质的功能呈现指数增长,从而在弓形虫的生命活动中发挥着重要作用。棕榈酰化、泛素化、磷酸化和甲基化等PTMs会调控弓形虫运动和入侵宿主细胞的过程,特别是磷酸化修饰通过调控蛋白激酶(protein kinase G,PKG)对其入侵和逸出宿主细胞起到信号枢纽的作用[7, 12]。当弓形虫在细胞外环境中寻找宿主细胞入侵时,它会暴露于缺乏营养和氧化应激的环境中,而PTMs会在这种恶劣的环境中维持寄生虫的生存能力[7, 13]。此外,弓形虫可通过乙酰化、磷酸化、糖基化、甲基化、小泛素化和泛素化等修饰对其组蛋白和转录因子进行调控,从而调节其转录及翻译的过程[7, 14]。弓形虫通过PTMs下调免疫反应和重组亚细胞结构来操纵所入侵的宿主细胞,为虫体生存、复制和入侵创造一个有利的条件[15]。总之,弓形虫体内普遍存在着乙酰化、磷酸化、巴豆酰化、琥珀酰化、二羟基异丁基酰化、泛素化、糖基化、丙二酰化等 PTMs 类型,这些PTMs 参与了蛋白质加工与合成、表观遗传调控、毒力、转录调控、信号转导、入侵、运动以及应激响应等各种生物学过程。因此,PTMs可能是弓形虫的发育过渡、生物学和发病机制的关键调节剂。本综述对弓形虫的PTMs进行简要总结,旨在进一步全面解析弓形虫的生物学特性和发病机制,为寻找新的抗弓形虫药物靶标奠定基础。
1 蛋白质翻译后修饰的研究进展
1.1 泛素化修饰(ubiquitination)
泛素是一种由76个氨基酸组成的多肽,与蛋白质的赖氨酸残基结合来调控细胞生物学过程。De Monerri等[13]在弓形虫中共鉴定到超过500多种蛋白质上的1 000个泛素化修饰位点,且大部分的泛素化蛋白与细胞周期调节相关。泛素化修饰需要 E1 泛素激活酶、E2 泛素结合酶和 E3 泛素连接酶的共同调控[16-17]。泛素化修饰在弓形虫细胞骨架、内膜复合物以及滑动体(gliding-associated protein, GAP)等相关蛋白质上也被检测到,可能对于细胞骨架的重排具有重要的作用[13]。在弓形虫染色质修饰酶上检测到泛素化修饰,包括乙酰基转移酶GCN5b(转录的主调节剂)以及与GCN5b相互作用的蛋白质[18]。此外,在弓形虫组蛋白以及AP2转录调节因子中也发现多个泛素化位点,可能对弓形虫的转录具有重要的调控作用[13]。弓形虫35%的泛素化蛋白是与细胞周期调控相关的,且与磷酸化修饰之间有着重要的相互作用。
1.2 小泛素化修饰(SUMOylation)
小泛素化修饰是小泛素相关修饰物与赖氨酸残基的共价连接过程。弓形虫的蛋白质组中约有1%蛋白质发生SUMO修饰,并参与转录、DNA复制和修复、染色体分离和信号转导等细胞功能[19]。该修饰由3种酶进行调控: E1-SAE1/SAE2异二聚体(活化酶)、E2/Ubc9(结合酶)和E3酶(连接酶)[19]。虽然大多数SUMO修饰调控酶都在细胞核中,但SUMO修饰的发生并不局限于细胞核。研究表明,SUMO修饰在细胞质、质膜、线粒体和内质网中均发挥重要的作用[19-20]。与靶向蛋白质降解的泛素化修饰不同,SUMO修饰可以保护蛋白质不被降解,也可将蛋白质引导到细胞中的特定位置,尤其是细胞核[20-21]。HSP70和HSP90等热休克蛋白质均被检测到发生SUMO修饰,有助于弓形虫的抗应激反应,同时SUMO修饰在弓形虫入侵宿主细胞、包囊发育/维持和发病机制中起着关键作用[19]。尽管泛素化和SUMO修饰非常相似,但它们具有不可替代的生物学功能。
1.3 棕榈酰化修饰(palmitoylation)
S-棕榈酰化是棕榈酸酯(一种饱和16碳脂肪酸)通过硫酯键与半胱氨酸残基共价连接发生[22-23]。在弓形虫中共鉴定到282种棕榈酰化蛋白质,主要位于细胞质和细胞膜上。棕榈酰化通常参与调节蛋白质膜定位、改变蛋白质稳定性、蛋白质/蛋白质相互作用和蛋白质转运等[24]。与其他脂质类修饰不同,棕榈酰化具有可逆性和动态性。棕榈酰化修饰由棕榈酰基转移酶(palmitoyl acyl transferases, PATs)催化,弓形虫基因组编码18个潜在PATs,其中16个在速殖子中表达[24-25]。因此,棕榈酰化可能在弓形虫速殖子阶段发挥重要作用。Foe等[26]证实了肌球蛋白轻链(myosin light chain, MLC1)、肌球蛋白质MyoA以及GAP45、GAP40、GAP50和GAP70等滑动体相关蛋白质均发生棕榈酰化修饰,这些发现揭示滑动体是速殖子的一种被高度棕榈酰化的复合物。进一步的研究表明,阻断顶端膜抗原(apical membrane antigen 1, AMA1)棕榈酰化可增加AMA1及微线体相关蛋白质(microneme proteins,MICs)从顶端复合体的释放,表明棕榈酰化修饰在弓形虫速殖子的入侵阶段扮演着关键的角色。
1.4 磷酸化修饰(phosphorylation)
1.5 O-糖基化修饰(O-GlcNAcylation)、C-甘露糖基化修饰(C-Mannosylation)和O-岩藻糖基化(O-fucosylation)
糖基化修饰主要分为N-糖基化和O-糖基化,对弓形虫的研究主要集中在后者。O-糖基化修饰(O-GlcNAcylation)是由ON和OFF酶(O-GlcNAc转移酶和O-GlcNAcase)调节的高度动态的PTM,可以与磷酸化竞争,但其功能尚不清楚[29]。O-糖基化的功能是多种多样的,包括调控信号传导过程,并影响蛋白质表达、降解和运输等[29-30]。此外,黏蛋白样糖蛋白的黏蛋白结构域上糖基化的缺失会导致弓形虫囊壁结构刚性的缺失,这说明糖基化修饰可能参与调节弓形虫细胞壁的相关结构[31]。
C-甘露糖基化是后生动物中存在的血小板反应蛋白1型重复序列的常见修饰类型,最近在顶复门寄生虫中也被发现[32-34]。这种糖基化是由DPY19家族的酶介导,该酶将α-甘露糖转移至序列WX2WX2C中色氨酸残基[34]。C-甘露糖基转移酶活性与寄生虫对宿主细胞的黏附力、运动能力、入侵和逸出宿主细胞等有关[32, 34]。虽然C-甘露糖基化转移酶DPY19不是弓形虫存活所必需的,但对黏附、运动和毒力却很重要[35]。由于糖基化修饰的调控机制尚不十分清楚,因此仍然需要彻底研究其对弓形虫生命周期和致病潜力的影响。
弓形虫O-糖基化转移酶(OGT)可修饰数千种细胞内蛋白质,调控O-岩藻糖基化修饰参与转录,mRNA加工和信号转导等过程[36]。近期的研究发现,O-糖基化转移酶是介导O-岩藻糖基化所必需的,且O-岩藻糖基转移酶“Spindly”会影响弓形虫的蛋白表达和毒力[36]。尽管O-岩藻糖基化修饰的许多内源蛋白质对于速殖子的抗应激能力很重要,但O-岩藻糖基化修饰酶“Spindly”蛋白质的敲除试验证明,它并不是介导弓形虫O-岩藻糖基化所必需的。因此,O-岩藻糖基化很可能为弓形虫提供了一种预防机制,可以生成和储备一些关键蛋白质,以加强虫体对外界环境的适应力。
1.6 乙酰化修饰(acetylation)
组蛋白乙酰化是涉及弓形虫生长和发育的关键PTM类型,使用液相-串联质谱(LC-MS/MS)成功地在弓形虫中鉴定到400多个新的乙酰化位点,包括与新陈代谢、翻译、折叠和细胞骨架等相关蛋白质[37]。活跃增殖的速殖子中富含丰富的赖氨酸乙酰化,这可能与急性弓形虫病的发病机制相关。AP2转录因子可能通过乙酰化修饰来调节弓形虫的基因转录[38]。赖氨酸乙酰转移酶(如MYST-A、MYST-B、GCN5-A和GCN5-B等)以及赖氨酸去乙酰修饰酶HDACs家族蛋白质等,对乙酰化修饰具有重要的调控作用[39-41]。此外,基于赖氨酸脱乙酰基酶(HDACs)抑制剂(如FR235222)的抗寄生虫作用,乙酰化修饰调控酶可作为潜在的有效药物靶标[42]。蛋白质乙酰化修饰水平与寄生虫基因型特异性毒力之间具有重要的关系。在弓形虫RH株中发生赖氨酸乙酰化蛋白质(458个)最多,其次是PYS株(188个),而在PRU株中仅检测到115个乙酰化蛋白[43]。总之,赖氨酸乙酰化在弓形虫的多种生物学过程中均发挥重要的功能,对其存活和发育至关重要。
1.7 精氨酸甲基化修饰(methylation)
精氨酸甲基化涉及多种生物学过程,主要发生在细胞质和核蛋白上,与表观遗传和转录调节、RNA剪接和DNA损伤反应等过程相关[44]。精氨酸单甲基化(monomethyl arginine, MMA)修饰大约占弓形虫蛋白质组的5%,主要包括DNA和RNA结合蛋白质等[12]。刚地弓形虫的精氨酸单甲基化修饰包含大量的RNA结合蛋白和ApiAP2转录因子,这表明精氨酸甲基化修饰可能在虫体的RNA生物学和转录调控中发挥作用。在之前的磷酸蛋白质组学研究中,精氨酸单甲基化的蛋白质中有90%被检测也发生磷酸化修饰,这增加了弓形虫中MMA与磷酸化之间相互作用的可能性[12]。精氨酸甲基化由甲基转移酶和去甲基转移酶共同调控,弓形虫基因组含有五种假定的精氨酸甲基转移酶(protein arginine methyltransferases, PRMTs),其中PRMT1对细胞分裂和生长起着关键作用[12, 45]。总之,MMA是细胞核活性的重要调节剂,且PRMT1是弓形虫中MMA的主要调节剂。
1.8 琥珀酰化修饰(succinylation)
与赖氨酸甲基化和乙酰化相比,赖氨酸琥珀酰化被认为能促进蛋白质化学性质发生更实质性的转化,因为琥珀酰化可以转运更大的结构部分[46]。在生理pH条件下,赖氨酸残基上发生的琥珀酰化可诱导电荷的改变,从而有利于调节底物蛋白质的结构和功能[47]。由于赖氨酸琥珀酰化引起的结构变化更为明显,可能会促进蛋白质功能发生更为显著的变化。研究发现弓形虫中147个蛋白质上含有425个独特的赖氨酸琥珀酰化位点,且参与代谢、表观遗传、基因调控等生物学功能[46]。此外,研究发现多个琥珀酰化修饰蛋白质[如丙酮酸脱氢酶复合物亚基(PDH-E3II)、柠檬酸合酶I(CS1)、乌头酸水合酶(ACN)、异柠檬酸脱氢酶(IDH、二氢脂酰胺S-琥珀酰基转移酶(DLST)、琥珀酰CoA连接酶亚基β(SUCL2)、琥珀酸脱氢酶(SDHA)、富马酸水合酶(FH)和苹果酸脱氢酶(MDH)]定位于弓形虫线粒体或顶质体,这对三羧酸循环、脂肪酸和类异戊二烯合成等均具有重要作用[48]。弓形虫赖氨酸琥珀酰化涉及多种细胞功能,特别是与能量代谢过程有关。
1.9 N-肉豆蔻酰化修饰(N-myristoylation)
在弓形虫中有157种蛋白质会发生N-肉豆蔻酰化修饰,且对其生命周期的调控至关重要[49]。N-肉豆蔻酰基转移酶(N-myristoyltransferase,NMT)是寄生虫中必不可少的肉豆蔻酰基化酶。弓形虫蛋白质TGME49_209160(myristoyl CoA: protein N-myristoyltransferase)是一种N-肉豆蔻酰基转移酶,这可能是新的潜在的抗寄生虫药物靶标[49]。此外,多个肉豆蔻酰化修饰蛋白质对弓形虫运动、入侵和逸出细胞等过程具有重要的调控作用,如滑动体相关蛋白质GAP45/70,钙依赖性激酶CDPK1和CDPK3等[49]。尽管N-肉豆蔻酰化修饰的通量较低,但是仍然扮演着不可或缺的角色。
1.10 巴豆酰化修饰(crotonylation)
巴豆酰化修饰在细胞、微生物、植物等中均被报道过具有重要的功能[50-51]。通过非标定量技术(label free)和液相-质谱联用的研究策略,在弓形虫RH株中共鉴定到有1 061个巴豆酰化修饰蛋白质(3 735个位点)以及在ME49株中共鉴定到有984个巴豆酰化修饰蛋白质(3 396个位点)[8, 52]。生物信息学分析表明巴豆酰化修饰蛋白质参与调控核糖体、糖酵解/糖异生、三羧酸循环、碳代谢、RNA转运、氧化磷酸化、氨酰tRNA生物合成和蛋白酶体等多种代谢通路,对弓形虫的生长发育具有不可或缺的作用。其中弓形虫RH株与ME49株在多个重要的代谢调控酶,如磷酸甘油酸激酶、醛脱氢酶、磷酸甘油酸激酶、柠檬酸合酶I、乌头水合酶等均存在巴豆酰化修饰水平差异,对弓形虫不同毒力株的能量代谢过程可能具有重要的差异性调控作用。
1.11 二羟基异丁酰化修饰(2-hydroxyisobutylation)
赖氨酸2-羟基异丁酰化是一种新发现的蛋白质翻译后修饰类型[53]。通过Label free技术在弓形虫RH株中共鉴定到有1 950个二羟基异丁基酰化修饰蛋白质(9 502个位点),并在ME49株中共鉴定到1 720个二羟基异丁基酰化修饰蛋白质(8 092个位点)[8, 52]。KEGG富集分析表明二羟基异丁酰化修饰参与调控核糖体、糖酵解/糖异生、三羧酸循环、碳代谢、氨酰tRNA生物合成、蛋白酶体、剪切体和氨基酸的生物合成等多种生物学过程[8,54]。二羟基异丁酰化修饰对弓形虫肌动蛋白、肌球蛋白、微线体蛋白质、棒状体蛋白质以及致密颗粒等均有重要的调控作用。与弓形虫ME49株相比,二羟基异丁酰化修饰可能对弓形虫RH株的修饰程度更高,特别是对其运动、毒力以及入侵宿主细胞的过程有着更重要的调控作用[8]。此外,相对于其他修饰,二羟基异丁酰化修饰的通量较高(仅低于磷酸化修饰),对弓形虫的生长发育具有重要的调控作用。
1.12 丙二酰化修饰(malonylation)
赖氨酸丙二酰化首次是在哺乳动物细胞和细菌细胞中被发现的,它与脂肪酸合成、氧化和糖酵解过程有关[55-56]。在弓形虫中共鉴定到300多个丙二酰化修饰蛋白质位于不同的亚细胞区室,并在糖酵解/糖异生、氨酰基-tRNA生物合成、磷酸戊糖途径和脂肪酸生物合成等代谢过程中均发挥重要的作用[57]。其中糖酵解过程重要的调控酶乳酸脱氢酶(LDH1)和3-磷酸甘油醛脱氢酶(GAPDH)均发生丙二酰化修饰,可能对弓形虫能量代谢具有重要的调节作用。
2 蛋白质翻译后修饰之间的相互作用
蛋白质翻译后修饰相互作用发生在多种PTMs之间,其目的是共同调节弓形虫多种生物学过程。弓形虫具有一种称为滑动体的独特机制,主要由在质膜下的肌动球蛋白组成[58]。虫体可以依赖于该机制进行滑动运动,以及进入宿主细胞和从感染细胞中逸出等。弓形虫滑动体作为多个PTMs的主要靶标,受多种修饰共同调节其滑动运动。如在弓形虫中TgGAP45是一种滑动体的核心成分,它能够发生泛素化、肉豆蔻酰化、棕榈酰化、二羟基异丁酰化和磷酸化修饰,在滑行运动、入侵和逸出过程中发挥作用[8, 13,59-60]。因此,PTMs的之间的相互作用对弓形虫滑动体有重要的调节作用。研究表明21%泛素化蛋白质也被乙酰化,同时泛素化和乙酰化之间的相互作用可以抑制泛素化修饰从而调节蛋白质的稳定性[61]。此外,磷酸化通常是泛素介导的降解的前提条件,且与甲基化修饰之间也存在相互作用[19, 62]。因此,不同PTMs之间可能具有相互协同或相互拮抗的作用,从而有序的调控弓形虫的生物学过程。
基因表达是一个受多种因素调控的复杂过程。组蛋白是染色体中核小体基本结构的重要组成部分,作者绘制了到目前为止已在弓形虫组蛋白上鉴定出的所有PTMs修饰图谱(图1),包括磷酸化、乙酰化、甲基化、磷酸化、巴豆酰化、二羟基异丁酰化、琥珀酰化、泛素化、糖基化等[8, 13-14, 19, 28, 38, 45]。与组蛋白H2Ba、H2Ax、H2Bb和H3相比,弓形虫组蛋白H4、H3、H2Ba、H2Bv、H2Az具有更显著的PTMs丰富度。此外,大部分组蛋白修饰位点均有多种修饰调控,其中H4K32、H4K68、H3K24、H3K28、H3K57、H2BaK71、H2BaK100、H2BaK112、H2AzK10和H2AzK18具有4种以上的PTMs,这可能是表观遗传调控的重要修饰位点。因此,弓形虫组蛋白核心上的PTMs可能是寄生虫生长和分化的关键元件,其生物功能调节不是由单一类型的修饰完成的,而是由多种修饰的共同调节。目前,关于弓形虫不同类型的PTMs之间的相互作用机制,人们仍然知之甚少,需要进一步研究。
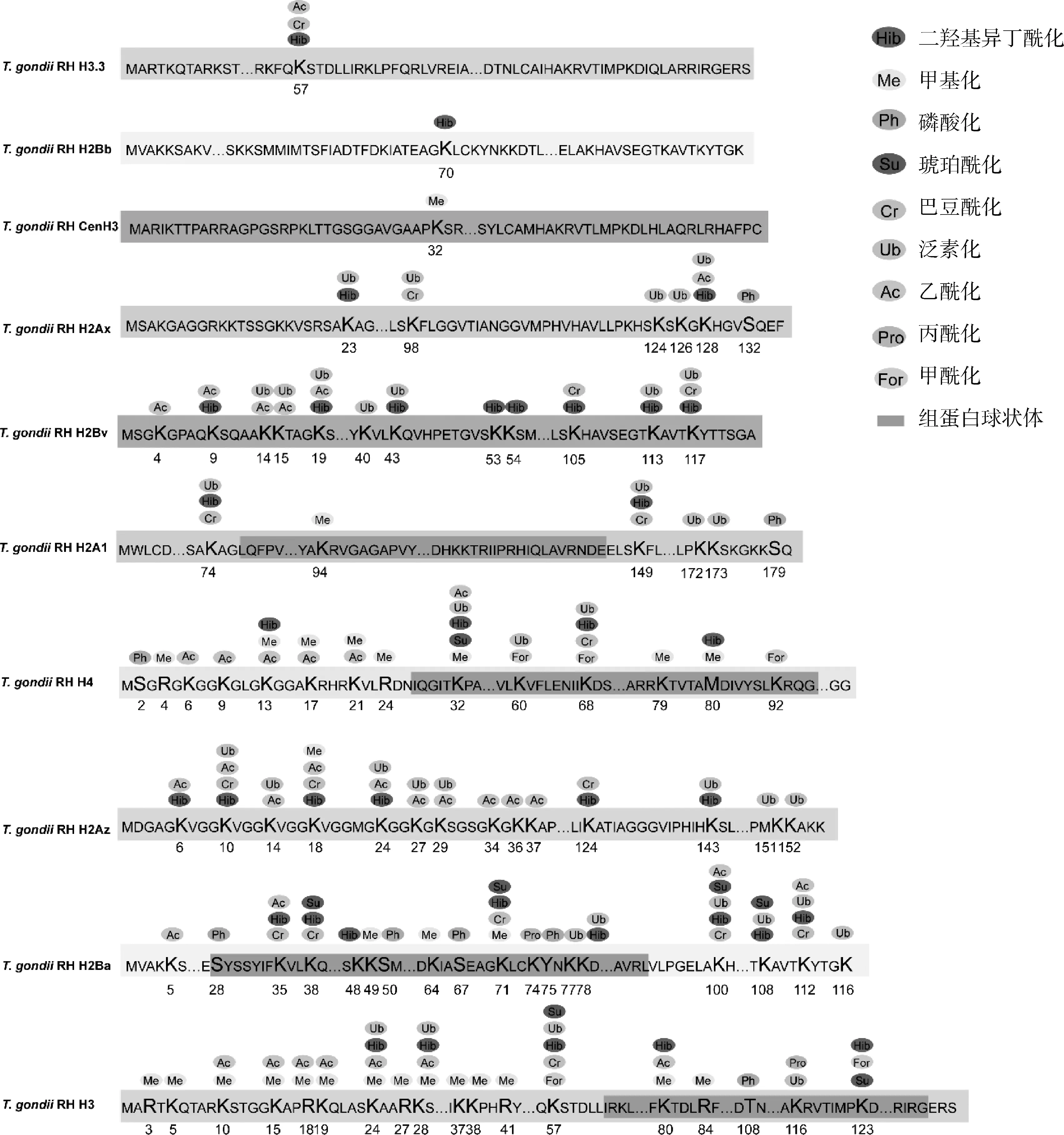
图1 弓形虫组蛋白PTMs修饰位点汇总(彩图见OSID资料)
3 讨论与展望
PTMs是指蛋白质翻译后的动态可逆的化学修饰,在蛋白质加工和成熟过程中起着重要作用,能够改变其理化性质,影响蛋白质的空间构象和稳定性[63-65]。PTMs在弓形虫生物学的多方面都发挥重要作用(表1),包括分化、运动、入侵、逸出、能量代谢、信号、传导、应激反应、基因转录和表达、细胞周期调节、蛋白质相互作用和定位等[8,12-13,15,19,26,28,34,38,46,59,66-67]。

表1 弓形虫蛋白质翻译后修饰汇总
随着高通量蛋白质组学技术的进步,PTMs已经在许多不同生物中逐渐被解析[68-70]。在但鉴定生物样品中的PTMs时仍然面临许多挑战,如鉴定到的数据仍然存在较高错误发现率(false discovery rate, FDR)、样品数据污染以及技术方法等问题[71-72]。此外,传统的质谱技术在PTMs的研究中还存在灵敏度不够等局限性;大多数的PTMs在样本中通量低(包含低丰度蛋白质)且具有时空动态等复杂性;一些同分异构肽段通过质谱无法进行准确有效分离等一系列问题都会影响组学数据分析的准确性。因此在评估数据时,必须尽可能考虑所有影响结果准确性的因素,如数据库的选择、抗体质量、蛋白质提取效率、样品纯度、用于搜索数据库的算法、PTM富集方法等。近期的研究表明,4D蛋白质组学即在保留时间(retention time)、质荷比(m/z)、离子强度(intensity)的基础之上增加了第四个维度——离子淌度(mobility)[73],使鉴定到的蛋白质覆盖度、检测周期、数据准确性等方面得到全面提升。未来随着更多新技术的出现,人们期待能够发现更多的PTMs类型,从而能勾画一个全面且动态的宿主细胞与弓形虫的修饰网络谱图,为更好地解析虫体与宿主相互作用奠定基础。同时希望能够对弓形虫不同发育阶段(缓殖子、速殖子和卵囊)之间以及弓形虫不同表型之间的PTMs进行动态且完整的图谱分析,这将有助于阐明弓形虫表型转化和毒力变化的潜在机制。
PTMs是目前研究最为重要的前沿领域之一,在弓形虫的生命活动中发挥着重要的作用。PTMs需要一系列调控酶来实现正负可逆调节,如PATs、MYST-A、MYST-B、PRMTs、GCN5-A、GCN5-B、HDACs等都可能是研制抗弓形虫药物的重要靶标[41, 74]。目前大多数弓形虫PTMs研究主要还集中在生物信息学分析层面,未来的研究应进一步解析PTMs的生物学功能和利用CRISPR-Cas9基因编辑技术等对重要修饰蛋白质进行功能验证,以揭示PTMs在刚地弓形虫中的确切作用。此外,现阶段对于弓形虫的组学研究相对比较单一,下一步应该运用多组学的联合分析的方法(如蛋白质组学、修饰组学、代谢组学和转录组学等)对弓形虫及其与宿主细胞相互作用开展重要研究,从而更全面的揭示其生物学特征,以期为研制新型抗虫药物奠定基础。

