18F-FDG PET/CT贝叶斯正则化似然重建算法对肿瘤定量参数的影响
王 旭,许莎莎,王 卓,杜晓光,韩星敏
(郑州大学第一附属医院核医学科 河南省分子影像医学重点实验室,河南 郑州 450052)
18F-FDG PET/CT显像对于诊断肿瘤及制定治疗决策具有越来越重要的作用。PET/CT图像重建技术不断发展,其中的迭代重建算法中飞行时间(time of flight,TOF)及点扩散函数(point spread function,PSF)可明显提高PET诊断效能[1-2]。贝叶斯正则化似然(Bayesian penalized likelihood,BPL)重建算法是目前最新的用于数字化PET/CT的重建技术,现已逐渐用于相关肿瘤研究[3-4]。相比传统PET,数字化PET可明显改善图像质量,显著提高肿瘤标准摄取值(standard uptake value,SUV)和信噪比(signal noise ratio,SNR)[5]。本研究观察BPL重建算法对恶性肿瘤病灶18F-FDG PET/CT定量参数的影响。
1 资料与方法
1.1 研究对象 回顾性分析2020年4月—6月80例于郑州大学第一附属医院接受PET/CT检查的原发恶性肿瘤患者,男33例,女47例,年龄10~89岁,平均(61.2±11.5)岁;均经病理学证实诊断,包括53例肺癌、9例淋巴瘤及18例其他肿瘤,共206个病灶。检查前患者或家属均签署知情同意书。
1.2 仪器与方法 嘱患者检查前空腹6 h以上,控制其空腹血糖<11 mmol/L。经肘静脉注射18F-FDG(本院制备,放射化学纯度≥95%)4.44 MBq/kg体质量后,嘱患者平静休息60 min。采用GE Discovery MI PET/CT扫描仪,嘱患者仰卧,行PET/CT显像,管电压120 kV,自动毫安电流(100~160 mA),噪声系数13,层厚3.75 mm,扫描范围自颅底至大腿上部,每个床位1.5 min,头部单独扫描一个床位2.5 min。分别采用TOF+PSF(非BPL组,3次迭代,16个子集,5 mm标准滤波器)及TOF+PSF+BPL(BPL组,惩罚因子β为450,TOF+PSF参数同上)2种算法重建图像。
1.3 图像分析 采用AW4.6工作站,系统以42% SUVmax为分割阈值自动勾画肿瘤病灶ROI,根据病灶直径将其分为<10 mm组(n=84)及≥10 mm组(n=122);测量代谢参数,包括最大标准摄取值(maximum standard uptake value,SUVmax)及平均标准摄取值(mean standard uptake value,SUVmean)及体积参数,即肿瘤代谢体积(metabolic tumor volume,MTV);于肝脏右叶测量直径3 cm球形ROI的SUVmean,计算信号/本底比值(signal background ratio,SBR),SBR=病灶SUVmax/肝脏SUVmean。分别计算不同重建算法下定量参数的差值,如SUVmax差值=BPL组SUVmax-非BPL组SUVmax。
1.4 统计学分析 采用SPSS 22.0统计分析软件。以频数表示计数资料,行χ2检验;以±s表示符合正态分布的计量资料,行配对t检验;以中位数(上下四分位数)表示不符合正态分布的计量资料,行Mann-WhitneyU检验。P<0.05为差异有统计学意义。
2 结果
BPL组病灶SUVmax、SUVmean及SBR均明显高于非BPL组(P均<0.05);BPL组病灶MTV明显低于非BPL组(P<0.05),见表1。BPL组PET图像质量优于非BPL组(图1~3)。
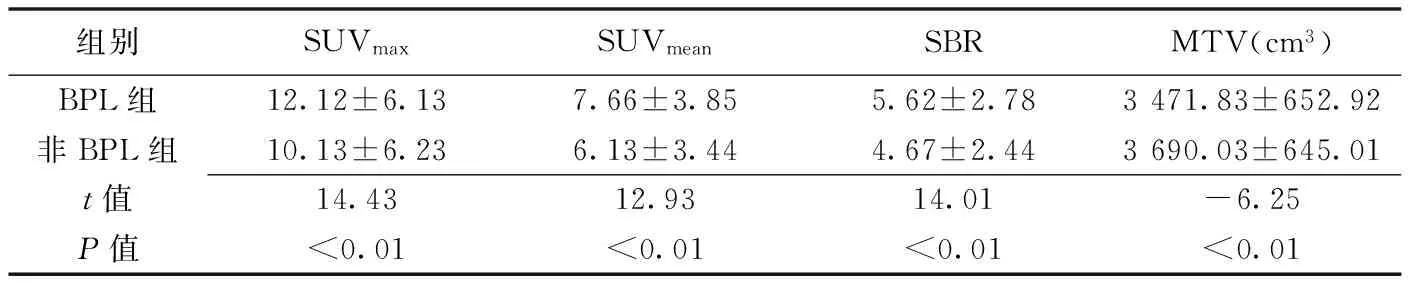
表1 不同重建算法下恶性肿瘤18F-FDG定量参数比较(n=206)
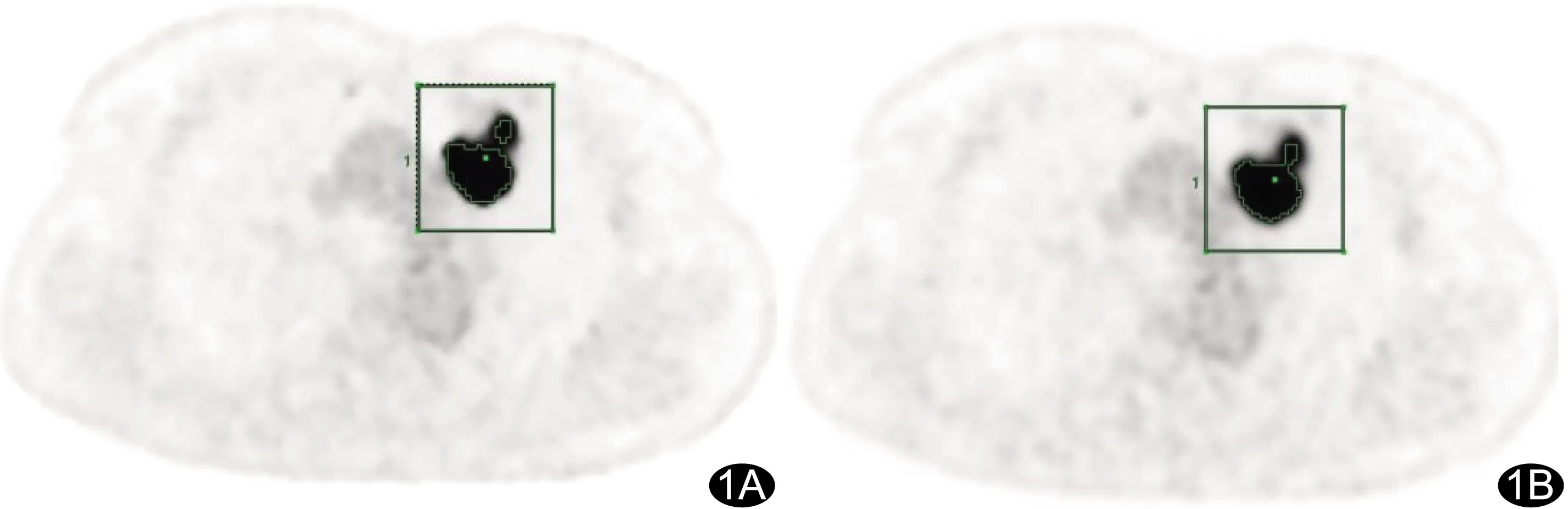
图1 患者女,60岁,左肺上叶腺癌 A.基于TOF+PSF+BPL算法于18F-FDG PET图像勾画病灶ROI,直径43.2 mm,SUVmax及SUVmean分别为24.98及15.39;B.基于TOF+PSF算法,病灶直径43.2 mm,SUVmax及SUVmean分别为23.79及14.66
直径<10 mm组与≥10 mm组患者性别及年龄差异均无统计学意义(P均>0.05);<10 mm组SUVmax、SUVmean及SBR差值均明显大于≥10 mm组(P均<0.05);组间MTV差值差异无统计学意义(P>0.05),见表2。
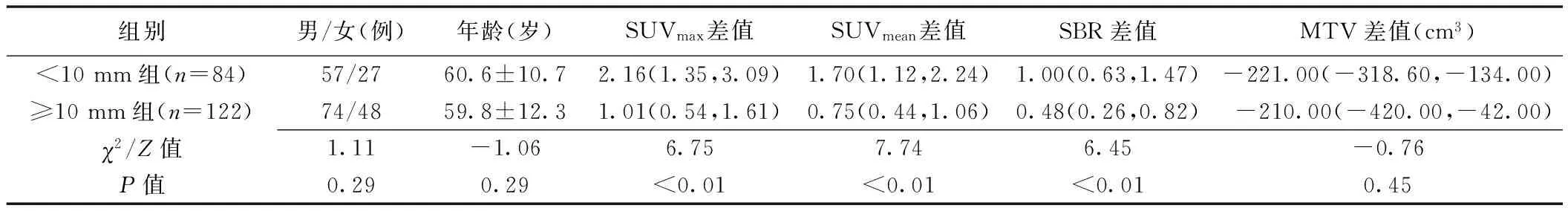
表2 不同大小恶性肿瘤18F-FDG定量参数比较
3 讨论
目前有序子集最大期望值(ordered subsets expectation maximization,OSEM)算法广泛用于重建PET图像,但背景噪声会随着迭代次数增加而增加;为防止因噪声过高而无法增加迭代次数,TOF和PSF重建技术在OSEM算法基础上部分提高了PET图像质量及分辨率[6-7],但迭代次数仍停留于2~5次,导致PET图像未达到完全收敛,降低了图像质量和定量准确性。BPL重建技术在增加迭代次数的同时加入了独有的基于相邻体素的方差实现的噪声抑制函数[8],所获定量参数更为准确,图像分辨率更高。
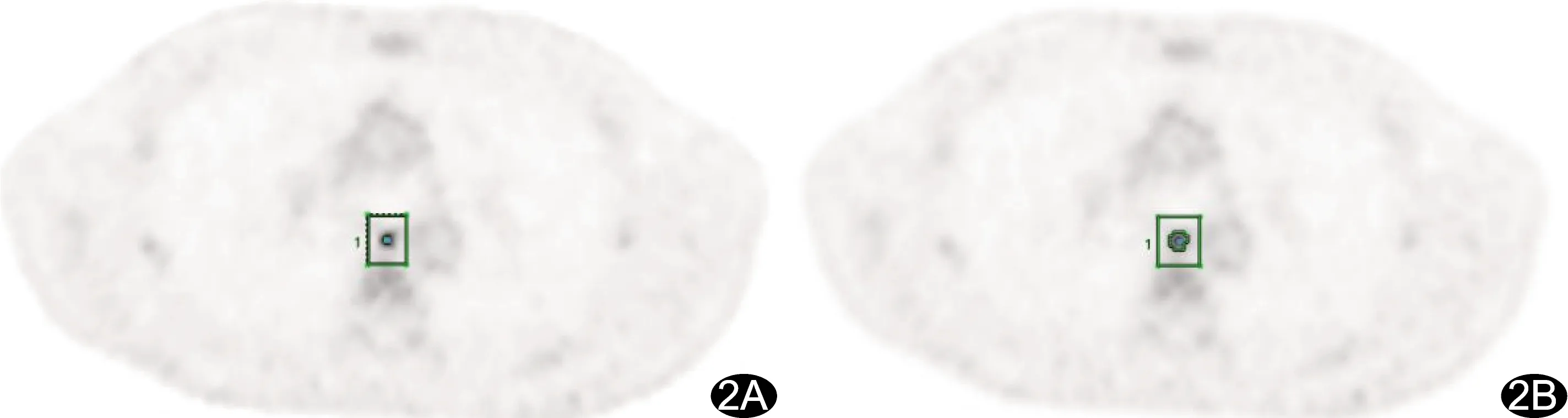
图2 患者男,34岁,霍奇金淋巴瘤 A.基于TOF+PSF+BPL算法于18F-FDG PET图像勾画病灶ROI,直径5.2 mm,MTV为0.04 cm3;B.基于TOF+PSF算法,病灶直径5.2 mm,MTV为0.43 cm3
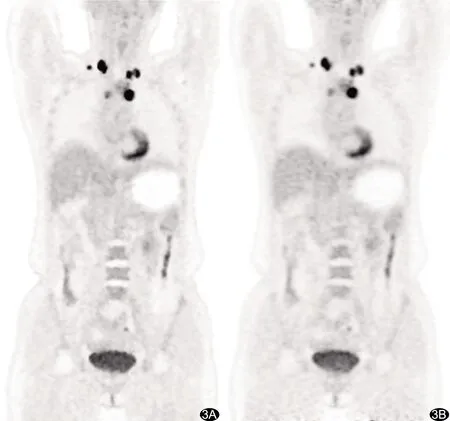
图3 患者女,44岁,霍奇金淋巴瘤 A.基于TOF+PSF+BPL算法重建的冠状位PET图像;B.基于TOF+PSF算法重建的冠状位PET图像
TEOH等[9-11]发现,采用BPL算法可明显提高恶性孤立肺结节、非小细胞肺癌纵隔转移淋巴结及结直肠癌肝脏转移灶的SNR及SBR。REYNÉS-LLOMPART等[12]的结果也证实BPL重建算法能提供更准确的定量参数;且认为临床肺小结节的SUVmax及SUVmean明显提高而代谢体积变化不明显,可能与病灶较小有关。TEOH等[9]报道,BPL算法在提高18F-FDG高代谢病灶SUV的同时并不改变本底组织的代谢参数,使得肿瘤SBR明显提高,可真正提高图像质量,最终提高病灶检出率。但既往研究[9-10]显示BPL算法并未明显提高鉴别良、恶性病灶的效能,恶性病灶可能呈18F-FDG低摄取,而良性病灶可能呈18F-FDG高摄取,二者表现存在重叠,提示18F-FDG PET/CT诊断肿瘤性质的特异性不足;而BPL算法的价值在于可为临床提供更佳的病灶可视化效果及更准确的定量参数。
另一方面,BPL算法在提高肿瘤病灶SBR的同时也给临床实践造成一定困扰。BARRINGTON等[13]通过视觉比较淋巴瘤病变与纵隔、肝脏本底摄取情况,以评估临床治疗效果,由于BPL显著提高病灶SUVmax而对肝脏本底无明显影响,可能导致高估总体肿瘤负荷,这意味着以往的评价标准可能不再适用于以包含BPL的重建算法获得的图像。本研究观察80例确诊肿瘤患者206个恶性病灶的18F-FDG PET/CT显像,结果显示联合BPL重建算法较TOF+PSF算法可明显提高包括SUVmax、SUVmean和SBR在内的肿瘤摄取参数,提示采用BPL重建时,应适当上调SUV鉴别良、恶性肿瘤的诊断阈值[14]。
PARVIZI等[15]评价42个肝转移癌,直径范围6~86 mm,平均25 mm,基于BPL算法MTV为16.3 ml(0.7~110.4 ml),明显低于基于OSEM算法的21.5 ml(1.5~143.4 ml)。VALLOT等[4]针对多种肿瘤的临床研究显示,BPL组61.8%肿瘤病灶的MTV低于OSEM组,本研究结果与之相符。采用OSEM算法重建图像往往导致高估MTV,尤其是小病灶和低SUVmax病灶,边缘可见模糊效应[16]。BPL重建算法实现了对肿瘤病灶的全收敛[17],通过惩罚因子β增加相邻像素间的相对差异,在保持病灶边缘清晰的同时使图像呈现最优对比度和重建分辨率;且勾画病灶ROI时以42% SUVmax为阈值,在很大程度上取决于SUVmax的准确度。
本研究中直径<10 mm组病灶的SUVmax、SUVmean及SBR差值均明显大于≥10 mm组,原因可能在于PET显像中,小病灶受部分容积效应的影响更为明显,其SUV易被低估,BPL算法可提高SUV测值[18];<10 mm组MTV差值大于≥10 mm组,但差异无统计学意义,可能因BPL对不同大小病灶的收敛作用不同,对直径<10 mm病灶收敛作用较为明显[9],避免了来自PSF建模的小病灶边缘的吉布斯伪影[8],有待进一步证实。既往基于BPL的肺结节研究[19-20]曾采用不同水平的惩罚因子值β=150/350,结果均证实BPL可提高肿瘤病灶的SUV。REYNÉS-LLOMPART等[12]提出以18F-FDG行全身扫描的最佳β值为300~400,采集大脑图像的最佳β值为150~250;随β值增加,代表量化信号能力的对比度恢复系数及SNR均明显提高,直至达到平稳状态(β>500)。SCOOT等[20]的结果表明,以90Y进行图像采集的最佳β值为4 000;而CHAUVIE等[21]发现,对于68Ga-PSMA,最佳β值为400~550。为获得最佳图像质量及更准确的定量参数,行BPL重建时,需针对所用放射性药物及检查部位设置最佳β值。但本研究仅分析了β值为450时BPL算法重建对定量参数的影响,且由于病例数有限,未能按病理类型进一步分组分析,有待完善。
综上,BPL可提高肿瘤SUV,尤其对于直径<10 mm病灶;基于BPL算法重建图像鉴别诊断良、恶性肿瘤时,应上调SUV阈值。

