腹腔镜脾切除联合选择性贲门周围血管断流术对门静脉高压症患者肝脏体积及肝储备功能的影响
陈韵壕 马 靖 刘清波 王卫东
(南方医科大学顺德医院 佛山市顺德区第一人民医院肝胆胰脾外科,佛山 528300)
门静脉高压症及肝功能不全是肝硬化失代偿期常见的表现,其中食管胃底曲张静脉破裂出血以及脾功能亢进是其中2个主要常见的并发症。严重的门静脉高压症治疗困难,病死率高。近年来,采用腹腔镜脾切除联合选择性贲门周围血管断流术,治疗和预防食管胃底静脉曲张破裂出血及脾功能亢进的可行性和安全性得到证实[1,2]。然而,关于手术对肝脏储备功能影响的研究少见。肝脏体积是肝功能储备的主要评估方法之一[3],临床上使用多层螺旋CT测肝脏体积(liver volume,LV),吲哚氰绿15 min滞留率(indocyanine green retention rate at 15 min,ICGR15)能够较准确地反映肝脏储备功能,其作用优于Child-Turcotte-Pugh(CTP)分级[4]。2015年1月~2019年8月我科对31例肝硬化合并门静脉高压症、脾大脾功能亢行腹腔镜脾切除联合选择性贲门周围血管断流术,腹部增强CT测量手术前后LV,结合ICGR15结果,探讨手术对肝脏储备功能的影响。
1 临床资料与方法
1.1 一般资料
本研究31例,男23例,女8例。年龄23~72岁,平均48岁。均有上消化道出血史,均有乏力、厌食,8例轻度腹水,31例脾脏明显肿大(体格检查第Ⅰ线测量5~12 cm,其中9例第Ⅰ线超过脐水平加测第Ⅱ、Ⅲ线,第Ⅱ线测量8~15 cm,同时超过前正中线2例,第Ⅲ线测量1~2 cm)。血白细胞(1.7~6.8)×109/L,平均3.14×109/L;红细胞(2.64~4.68)×109/L,平均3.49×109/L;血红蛋白80.6~140.5 g/L,平均90.8 g/L;血小板(23~176)×109/L,平均65.07×109/L。肝功能:丙氨酸转氨酶(alanine transminase,ALT) 13~235 U/L,中位数80 U/L;总胆红素(total bilirubin,TBIL) 6.80~54.45 μmol/L,中位数16.94 μmol/L;白蛋白(albumin,ALB)(33.44±11.01)g/L。凝血酶原时间(prothrombin time,PT)(16.02±1.91)s。胃镜检查提示食管静脉曲张中度14例,重度17例;胃底静脉曲张中度18例,重度13例。腹部增强CT测量肝脏体积(844.47±80.25)cm3,提示肝脏缩小伴脾肿大。肝动脉血流量(hepatic artery flow,HAF)、门静脉血流量(portal vein flow,PVF)分别为(186.76±21.59)、(1870.80±244.21)ml/min。ICGR15(24.12±7.37)%,吲哚菁绿最大清除率(indocyanine green maximum removal rate,ICGRmax)为(1.48±0.18)mg·kg-1·min-1。31例均为乙型肝炎后肝硬化,术前肝功能Child-Pugh分级A级21例,B级10例。临床诊断均为肝硬化门脉高压症合并食管胃底静脉曲张及脾功能亢进。13例曾行食管静脉套扎,18例内科保守治疗。
病例选择标准:①年龄18~75岁;②临床上和(或)病理学上诊断为肝硬化失代偿合并门静脉高压症及脾肝肿大;③有食管胃底静脉曲张破裂出血史(临床表现为黑便、呕血等),既往未接受手术其他二级预防措施;④ECOG评分≤2分且KPS评分≥60分;⑤Child-Pugh分级A或B级;⑥签署知情同意书并同意为临床研究提供临床数据。
1.2 方法
1.2.1 手术方法 气管插管全麻后,常规建立气腹,气腹压力维持在14 mm Hg。分别在脐下、剑突下与脐的中点、左侧锁骨中线及左侧腋前线建立操作孔。随后调整体位:左侧腰背部垫高10°~30°、头高脚低10°~30°右侧斜卧位,根据术中需要再随时调节。先探查腹腔,了解腹部情况后首先行脾脏切除。解剖出脾动脉并予以悬吊后小心分离脾门及脾周韧带,游离完成后使用腔镜下切割缝合器(Endo-GIA)将脾蒂切断,完成脾脏切除术。使用LigaSure、Hem-o-lok血管夹采用“经胃前、后入路法”沿胃小弯处逐步分离结扎胃支、食管支、高位食管支、胃后静脉、左膈下静脉等食管胃底穿支血管,直至游离食管6~10 cm,完成选择性贲门周围血管离断术。具体手术操作可见参考文献[2]。
1.2.2 LV测量 术前、术后第3、6个月分别测量患者LV。由我院影像归档和通信系统(Picture Archiving and Communication Systems,PACS)图像处理工作站,选取腹部多层螺旋CT平扫获得的肝脏CT图像,扫描层厚3 mm。将CT图像存为DICOM格式的图像文件夹拷至电脑,使用OsiriX成像软件基于CT进行处理分析。LV测定:门脉期图像用于LV计算,以层厚为3 mm重新分层,利用半自动细分工具为感兴趣区域(region of interest,ROI)选择和边框激活划界,根据不包括胆囊、下腔静脉和肝内门脉的密度差异确定ROI,将各层得到的面积乘以扫描层厚即可得到LV。
1.2.3 肝脏血流动力学指标的测量 术前、术后第3、6个月分别行腹部多普勒彩超检查,测量患者HAF和PVF。
1.2.4 ICGR15、ICGRmax检测 ICGR15与Child-Pugh肝功能分级呈正相关[4],术前和术后第3、6个月分别使用DDG分析仪及相关分析软件检测ICGR15,代入米氏方程计算ICGRmax,评估肝脏储备功能的变化。
1.3 统计学处理

2 结果
31例均顺利在腹腔镜下完成脾切除联合选择性贲门周围血管断流术,术中无中转开放手术。手术时间(304.5±90.0)min,出血量(98.7±55.2)ml。术后1~2 d肛门排气,术后第2天可下床活动并开始进食流质食物,术后3~5 d拔引流管。31例围术期内均未出现呕血、肝功能衰竭、腹腔出血、脾窝感染、肠漏、胰漏、肺部感染等并发症。术后住院(15.9±4.5)d。
术后第3、6个月LV均明显大于术前(均P=0.000),术后第6个月LV明显大于术后第3个月(P=0.016)。术前后ALT差异有统计学意义(F=28.894,P=0.000),且术后第3、6个月ALT均明显低于术前(均P=0.000)。术前、术后第3、6个月TBIL、PT、ALB差异无显著性(P>0.05),见表1。
术后第3、6个月HAF明显高于术前(均P=0.000);术后第3、6个月PVF明显低于术前(均P=0.000)。术后第3、6个月ICGR15明显低于术前(均P=0.000);术后第3、6个月ICGRmax比术前显著升高(均P=0.000),见表2。
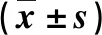
表1 手术前后LV和肝功能比较
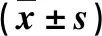
表2 手术前后肝脏血流动力学、ICGR15、ICGRmax比较
3 讨论
门静脉高压症是肝硬化失代偿期最显著的表现,治疗的方法各种各样,手术治疗可大致分为分流术、断流术、肝移植等[5],但是手术难度大、供肝短缺以及高额的治疗费用等限制分流术及肝移植的在大部分医院的开展[6]。目前,我国主要采用腹腔镜脾切除联合选择性贲门周围血管断流术防治食管胃底静脉曲张及破裂出血,改善患者的生活质量[7]。肝硬化失代偿期的患者肝脏功能较差,对于这类患者不仅需要防治上消化道出血,同时也需要改善其肝脏储存功能,延长生存期。
本组31例均顺利完成腹腔镜脾切除联合选择性贲门周围血管断流术,术后无发生并发症并顺利出院。腹腔镜脾切除联合选择性贲门周围血管断流术是一个成熟的手术,因能阻断异常的侧支循环血管又同时保留正常的自体分流而广受基层医院医生青睐。操作时仍需要仔细认真,切除脾蒂需要注意避免损伤胰体尾,阻断侧支循环血管时保持术野的清晰,防止结扎不完全造成术后大出血。术后需要严密观察患者体征,出现并发症做到早期发现早期处理。
肝功能体现所有肝脏细胞功能的总和。血清ALT水平能直接反映肝细胞损伤程度,灵敏度最高[8]。肝硬化患者随着肝功能损伤程度的增加肝脏体积呈现缩小的状态,这种变化与肝硬化的严重程度相关[9]。本研究结果显示术后第3、6个月LV与比术前相比明显增加,术后ALT、ICGR15比术前明显下降,术后ICGRmax较术前显著升高,提示肝功能呈现好转。我们认为术后肝功能的改善可能可以从以下2个方面解释。
其一,手术可能可以通过改善肝脏的血液供应来改善肝脏功能。肝功能受肝脏的血流动力学的变化影响较大[10]。由于肝硬化假小叶的出现,门静脉压力升高,侧支循环出现,使由门静脉进入肝脏的富含肠道营养物质的血流持续减少。除门静脉,肝脏动脉也是肝脏的重要供给血管。HAF的改变可以影响到肝功能的改变[11]。脾动脉盗血综合征(splenic artery steal syndrome,SASS)学说[12]认为在肝硬化的病人中,肿大的脾脏通过脾动脉与肝总动脉争夺来自腹腔干的血流,使肝总动脉的血流减少,导致肝总动脉低灌注和肝组织缺血缺氧,在肝硬化的基础上进一步损伤肝功能。不少肝硬化病人确实存在SASS[13]。肝硬化时脾脏血流分布异常增多,脾静脉血流量在门静脉血流中占优势状态,静脉回流增大使动脉血供也需相应增大,如此恶性循环使分流向脾脏的血供不断增加,肝脏动脉血供减少,长期以往,肝功能逐步恶化。不仅如此,脾静脉回流进入门静脉血流量增加也可进一步使肝动脉血供减少[14],影响肝脏供血,肝脏细胞缺血缺氧。本组术后HAF、PVF得到改善趋于正常范围,入肝血流量也较术前减少,因此,本术式对于门静脉来说,一方面切除巨大的脾脏以及阻断门静脉异常的侧支循环、保留的正常的分流,使得门静脉灌注减少,降低门静脉压力;对于肝动脉来说,阻断脾静脉后门静脉血流量减少,肝动脉通过自身的缓冲效应调节其自身的血流量,改善肝脏的血液供应,进而改善肝功能。
其二,手术可能通过解除脾脏对肝脏再生的抑制作用来改善肝脏功能。病变的脾脏可以通过产生大量转化生长因子-β1(transforming growth factor-β1, TGF-β1)从而抑制肝脏再生[15]。TGF-β1使肝星状细胞增加合成细胞外基质并且抑制其分泌肝细胞生长因子(hepatocyte growth factor, HGF)的能力,抑制肝细胞再生过程。肿大的脾脏通过争夺肝脏的血液供应及分泌相关因子抑制肝脏的生长进而从腹腔干获取更多的营养来维持自身生长。手术切除病脾从源头上祛除TGF-β1的产生,解除病脾对肝脏再生的抑制作用。脾脏切除后血小板增多也在改善肝功能的过程中发挥重要作用[16],原因可能是血小板在肝脏的聚集以及血小板衍生的5-羟色胺通过上调HGF及其受体c-Met减少肝脏纤维化并促进肝脏再生[17],改善肝功能。
PT、TBIL、ALB也是评估肝脏合成储备功能的指标。本组结果提示术后这3个指标与术前相比无明显差异(P>0.05),我们认为原因可能为:①PT、TBIL多用于急性肝炎严重程度的评估,本组病例均是慢性肝炎患者且肝功能分级大多在Child-Pugh A级;②ALB虽然三者之间无显著差异,但是可以看出术后患者的ALB呈现一个上升的趋势,说明手术可能可以改善肝脏合成功能。本研究缺乏对照,样本量较少,有待大样本随机对照研究。
总的来说,腹腔镜脾切除联合选择性贲门周围血管断流术安全可行,手术能改善肝脏供血,促进肝脏再生,改善患者肝脏功能,延缓肝硬化进程,是一种值得推广的治疗门静脉高压症的手术方式。

