枳实薤白桂枝汤对心肌缺血模型兔血管内皮源性舒张因子的影响*
赵 楠,贾洪涛,刘一畅,翟春梅,戴 缙
(1.黑龙江中医药大学实验实训中心,黑龙江 哈尔滨 150040;2.黑龙江中医药大学药学院,黑龙江 哈尔滨 150040;3.黑龙江中医药大学附属第二医院,黑龙江 哈尔滨 150001)
冠心病作为致死率较高的一种疾病严重地危害着人类的健康,冠状动脉痉挛作为冠心病的类型之一,主要是由于多种原因所引起的冠状动脉一过性收缩,导致血管狭窄或闭塞,引起心肌缺血后所产生一系列临床相应的症状[1]。血管内皮细胞功能失调是导致冠状动脉痉挛的主要因素之一。血管内皮源性舒张因子NO与内皮源性内皮素前体(BigET-1)在血管中相互调节维持其内环境平衡状态[2]。相关研究发现,枳实薤白桂枝汤作为经方在临床应用中对心血管疾病具有较好的疗效[3-5]。前期研究证实枳实薤白桂枝汤在心肌缺血时对心脏具有一定的保护作用[6]。本实验在前期实验的基础上,进一步探讨枳实薤白桂枝汤在冠状动脉痉挛情况下对血管舒张因子的调控作用及相关水平的影响,为探究枳实薤白桂枝汤对心肌缺血的作用机制奠定基础。
1 材料与方法
1.1 实验动物选取SPF级成年健康家兔50只,雌雄各半,体质量2 500~3 000 g,由黑龙江中医药大学实验动物中心提供,生产许可证号:SCXK(黑)2018-003,使用许可证号:SYXK(黑)2018-007。家兔实验前7 d正常饲养喂食,待适应环境后,本实验通过BL-420F生物信号机能采集系统记录肢体Ⅱ导联心电图,剔除不合格者。本实验通过本校医学伦理委员会批准,无浪费动物及虐杀动物情况。
1.2 药物与试剂枳实薤白桂枝汤提取液由黑龙江中医药大学基础医学院针灸生理实验室自制;氨基甲酸乙酯(上海山浦化工有限公司,批号:20180110);肝素钠注射液(江苏万邦生物医药股份有限公司,批号:1802102);一氧化氮(NO,天津凯通化学试剂有限公司,批号:20170401);BigET-1ELISA检测试剂盒(天津凯通化学试剂有限公司,批号:20170331)。
1.3 主要仪器BL-420F生物信号机能采集系统(成都泰盟科技有限公司);LDZ4-1.2台式离心机(北京医用离心机厂);超低温冷冻储存冰箱(中科美菱低温科技有限公司);恒温水浴锅(上海跃进医疗器械厂);SP-Max2300A2型光吸收型全波长酶标仪(上海闪谱生物科技有限公司)。
1.4 造模与分组将家兔饲养1周后,通过BL-420F生物信号机能采集系统筛选心电图(ECG)指标合格家兔进行随机分组,50只家兔随机分为模型组、枳实薤白桂枝汤低剂量组、枳实薤白桂枝汤中剂量组、枳实薤白桂枝汤高剂量组、地尔硫卓组,每组10只。通过外源性注射人内皮素-1(ET-1)诱导的方法建立家兔冠状动脉痉挛的模型。首先将预处理过的家兔称重后固定,按照体质量注射20%氨基甲酸乙酯5 mL/kg。家兔麻醉后进行备皮、消毒后,迅速剪开皮肤充分暴露右侧颈动脉,进行插管结扎后备用,以便实验采血。将调配好的生物采集系统电极分别连于家兔四肢,记录家兔Ⅱ导联心电图的变化,约0.5 h稳定后经耳缘静脉注入ET-1(1.4 nmol/kg),建立冠状动脉痉挛所导致的心肌缺血模型。模型成功标准:调试BL-420F生物信号机能采集系统,进行参数设定,可见造模后家兔心电图ST段显著抬高,T波高尖。
1.5 实验给药枳实薤白桂枝汤提取液的制备根据《金匮要略》记载,用量换算枳实12 g,厚朴12 g,桂枝6 g,薤白9 g,瓜蒌12 g[7]。药材进行浸泡,煎煮,滤渣,水提醇沉法后过滤,恒温水浴浓缩后离心取上清液,根据文献[8]参考古代1升相当于现代200 mL,所以根据换算人体服药100 mL/次,含生药17 g。参照实验动物药量计算方法[9],家兔与人体配比的等效剂量为0.79 g/kg,可确定枳实薤白桂枝汤低、中、高剂量组家兔给药剂量分别为0.395、0.790、1.580 g/kg。
5组家兔在造模前期给予灌胃处理,枳实薤白桂枝汤低、中、高剂量组分别给予0.395、0.790、1.580 g/kg的枳实薤白桂枝汤;地尔硫卓组家兔给予5 mg/kg的地尔硫卓悬浊液进行适应性预处理;模型组家兔给予等剂量生理盐水,1次/d,连续给药5 d。
1.6 观察指标
1.6.1 T波及ST段的测量 将预处理造模后家兔四肢分别与BL-420F生物采集系统电极片相连接,调试生物采集系统,待系统曲线稳定后记录Ⅱ导联心电图的变化,分别记录注射药物后5、10、15、30 min的T波与S-T段的变化。T波以QRS为基线标准,测量其最高点与基线之间的垂直距离的变化。S-T段则为相邻的两个QRS波群起点的连线作为基线,以确定有无ST段移位。(见图1)
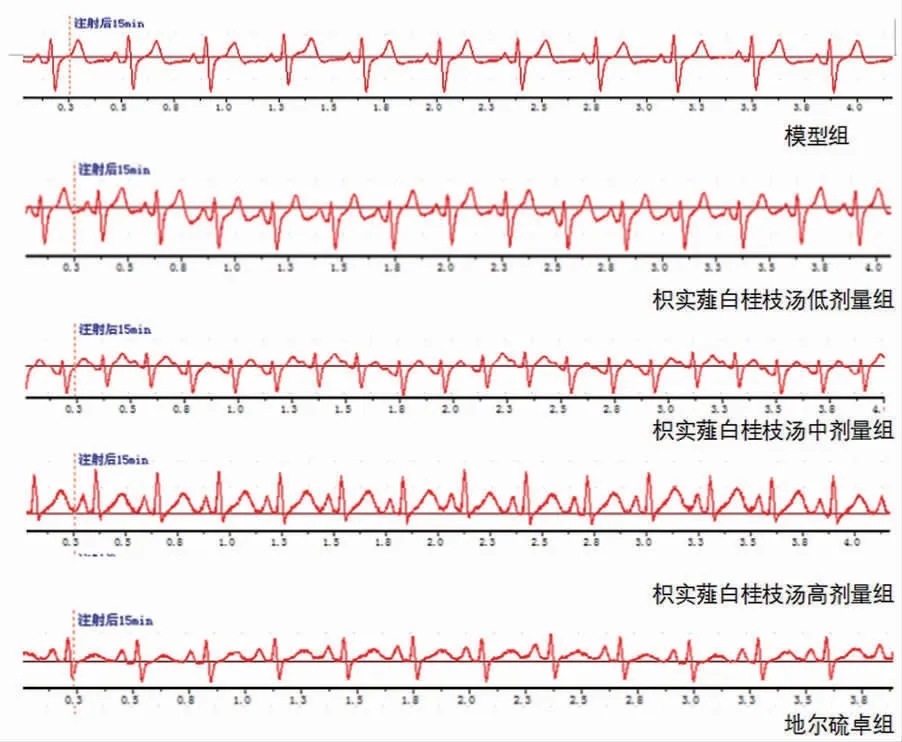
图1 各组在15 min时心电图
1.6.2 血管内皮源性舒张因子NO及BigET-1 5组家兔在造模前5 min及造模后30、120、360 min分别采血5 mL,静置后,低温离心后取上清液于Eppen-dorf管内,放于超低温储存冰箱中备用。采用ELISA法分别检测NO及BigET-1的水平,严格按照试剂盒的步骤进行操作。
1.7 统计学方法应用SPSS 20.0软件进行实验数据统计分析,计量资料以“均数±标准差”(±s)表示,采用重复测量方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 各组家兔T波的变化模型组家兔T波在5、10、15、30 min高尖;与模型组比较,枳实薤白桂枝汤低、中、高剂量组和地尔硫卓组家兔在各时间点心电图T波下降(P<0.05);与地尔硫卓组比较,枳实薤白桂枝汤低、高剂量组家兔心电图T波抬高(P<0.05);枳实薤白桂枝汤中剂量组与地尔硫卓组各时间点比较,差异无统计学意义(P>0.05);其中枳实薤白桂枝汤中、高剂量组和地尔硫卓组家兔在5、10、15、30 min时间点T波逐渐下降;结果表明枳实薤白桂枝汤能使家兔心电图T波下降,改善心肌缺血,其中枳实薤白桂枝汤中剂量组与地尔硫卓组药效最为接近。(见表1、图2)
表1 各组家兔T波变化的比较(±s,mV)

表1 各组家兔T波变化的比较(±s,mV)
注:F时间主效应=7.040,P时间主效应=0.000;F分组主效应=34.546,P分组主效应=0.000;F交互效应=8.372,P交互效应=0.000;与模型组比较,aP<0.05;与地尔硫卓组比较,bP<0.05;与5 min比较,cP<0.05;与10 min,dP<0.05
组别 动物数(只)给药剂量(g/kg) 5 min 10 min 15 min 30 min F P模型组 10 - 0.346±0.018 0.358±0.015 0.359±0.022 0.365±0.030 1.620 0.269枳实薤白桂枝汤低剂量组 10 0.395 0.300±0.018a b 0.318±0.016a b 0.320±0.013a b 0.314±0.014a b 3.685 0.024枳实薤白桂枝汤中剂量组 10 0.790 0.304±0.034a b 0.291±0.029a 0.274±0.036a c d 0.272±0.031a c d 16.671 0.000枳实薤白桂枝汤高剂量组 10 1.580 0.315±0.021a b 0.302±0.025a b 0.294±0.025a b c d 0.291±0.025a b c d 11.820 0.004地尔硫卓组 10 0.005 0.265±0.018a 0.257±0.017a c 0.252±0.015a c 0.240±0.019a c d 13.049 0.003 F 16.655 30.894 31.123 36.298 P 0.000 0.000 0.000 0.000

图2 各组家兔用药后T波各时间点变化趋势图
2.2 各组家兔S-T段的变化模型组S-T段在5、10、15、30 min明显抬高,与模型组比较,枳实薤白桂枝汤低、中、高剂量组与地尔硫卓组各时间点均有改善(P<0.05);与地尔硫卓组比较,枳实薤白桂枝汤低剂量组各时间点与枳实薤白桂枝汤高剂量组5、15、30 min时间点S-T段有所抬高(P<0.05);枳实薤白桂枝汤中剂量组与地尔硫卓组比较,差异无统计学意义(P>0.05)。其中枳实薤白桂枝汤低剂量组30 min时S-T段显著降低,枳实薤白桂枝汤中剂量组和地尔硫卓组各时间点与5 min比较,S-T段均有下降,但10 min时较为明显,枳实薤白桂枝汤高剂量组各时间点与5 min比较,10 min时S-T段显著下降(P<0.05)。结果表明枳实薤白桂枝汤可以使ST段下降,有效改善心肌缺血,其中枳实薤白桂枝汤中剂量组与地尔硫卓组药效最为接近。(见表2、图3)
表2 各组家兔S-T段变化的比较(±s,mV)

表2 各组家兔S-T段变化的比较(±s,mV)
注:F时间主效应=3.199,P时间主效应=0.033;F分组主效应=26.631,P分组主效应=0.000;F交互效应=7.007,P交互效应=0.000;与模型组比较,aP<0.05;与地尔硫卓组比较,bP<0.05;与5 min比较,cP<0.05;与10 min,dP<0.05;与15 min比较,eP<0.05
组别 动物数(只) 给药剂量(g/kg) 5 min 10 min 15 min 30 min F P模型组 10 - 0.083±0.002 0.085±0.002c 0.087±0.002c d 0.089±0.003c d e 39.111 0.000枳实薤白桂枝汤低剂量组 10 0.395 0.079±0.002a b 0.080±0.002a b 0.083±0.001a b c d 0.081±0.002a b e 9.666 0.000枳实薤白桂枝汤中剂量组 10 0.790 0.075±0.002a 0.073±0.002a c 0.073±0.002a c 0.072±0.001a c d e 15.061 0.000枳实薤白桂枝汤高剂量组 10 1.580 0.081±0.003a b 0.074±0.023a c 0.081±0.004a b 0.081±0.004a b 0.389 0.765地尔硫卓组 10 0.005 0.074±0.002a 0.072±0.002a c 0.072±0.002a 0.071±0.002a c 10.041 0.006 F 37.270 2.698 66.989 78.378 P 0.000 0.042 0.000 0.000

图3 各组家兔用药后ST段各时间点变化趋势图
2.3 各组家兔血管内皮源性舒张因子NO水平变化与模型组比较,枳实薤白桂枝汤中、高剂量组和地尔硫卓组注射ET-1后各时间点血清NO水平升高(P<0.05);枳实薤白桂枝汤低剂量组注射ET-1后6 h时血清NO水平低于地尔硫卓组(P<0.05);枳实薤白桂枝汤中剂量组血清NO水平与地尔硫卓组比较,差异无统计学意义(P>0.05);与地尔硫卓组比较,枳实薤白桂枝汤高剂量组家兔注射前后各时间点血清NO水平均升高(P<0.05)。各组家兔注射ET-1后的0.5 h其水平以抛物线形式逐渐升高后回落,6 h时降低到原始水平。结果表明枳实薤白桂枝汤可有效地升高家兔血清NO水平,其中枳实薤白桂枝汤中剂量组与地尔硫卓组药效最为接近。(见表3、图4)
表3 各组家兔血管内皮源性舒张因子NO水平变化的比较(±s)

表3 各组家兔血管内皮源性舒张因子NO水平变化的比较(±s)
注:F时间主效应=1 107.772,P时间主效应=0.000,F分组主效应=14.829,P分组主效应=0.000;F交互效应=13.004,P交互效应=0.000;与模型组比较,aP<0.05;与地尔硫卓组比较,bP<0.05;与注射前比较,cP<0.05;与注射后0.5 h比较,dP<0.05;与注射后2 h比较,eP<0.05
组别 动物数(只) 给药剂量(g/kg) 注射前 注射后0.5 h 注射后2 h 注射后6 h F P模型组 10 - 25.19±6.49 52.01±10.21c 36.16±8.94c d 26.09±7.14d e 108.456 0.000枳实薤白桂枝汤低剂量组10 0.395 30.1±5.27 53.42±5.6c 31.56±4.51d 22.63±3.2b c d e 285.419 0.000枳实薤白桂枝汤中剂量组10 0.790 24.48±5.63 63.39±9.12a c 40.04±11.15a c d 38.81±7.47a c d 1 344.033 0.000枳实薤白桂枝汤高剂量组10 1.580 43.03±5.37b 84.79±8.19a b 52.27±10.35a b c d 44.36±10.26a b d e 276.036 0.000地尔硫卓组 10 0.005 25.11±9.54 69.99±11.51a c 38.32±9.4c d 31.24±5.64c d e 85.114 0.000 F 12.660 23.645 7.107 15.768 P 0.000 0.000 0.000 0.000

图4 各组家兔用药前后NO各时间点变化趋势图
2.4 各组家兔BigET-1水平的变化与模型组比较,枳实薤白桂枝汤低剂量组家兔在注射ET-1后2、6 h时BigET-1水平明显下降,枳实薤白桂枝汤中、高剂量组和地尔硫卓组家兔在各时间点BigET-1水平均下降(P<0.05),其中枳实薤白桂枝汤中、高剂量组和地尔硫卓组家兔在注射0.5 h后BigET-1水平明显下降且枳实薤白桂枝汤高剂量组最为明显;枳实薤白桂枝汤低剂量组与地尔硫卓组比较,注射0.5 h时BigET-1水平有显著变化;枳实薤白桂枝汤中剂量组与地尔硫卓相比较,差异无统计学意义(P>0.05);注射后0.5 h与注射后6 h,枳实薤白桂枝汤高剂量与地尔硫卓组比较,差异均有统计学意义(P<0.05)。各组在注射ET-1后BigET-1水平有显著变化,且0.5 h达到峰值,2 h回落到基线水平。结果表明枳实薤白桂枝汤可有效地降低家兔BigET-1水平,其中枳实薤白桂枝汤中剂量组与地尔硫卓组药效最为接近。(见表4、图5)
表4 各组家兔BigET-1水平变化的比较(±s)
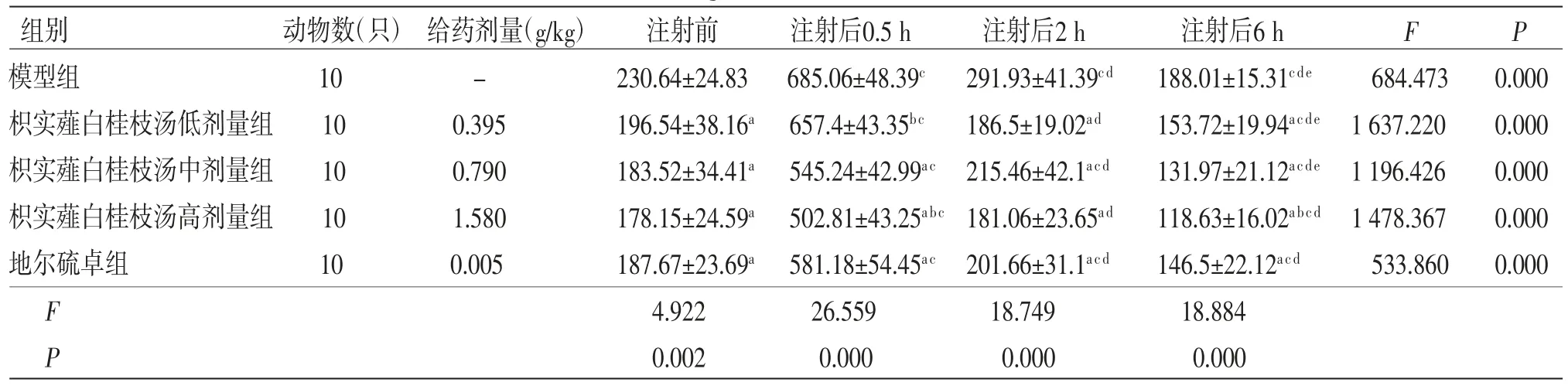
表4 各组家兔BigET-1水平变化的比较(±s)
注:F时间主效应=3315.399,P时间主效应=0.000,F分组主效应=17.187,P分组主效应=0.000;F交互效应=11.958,P交互效应=0.000;与模型组比较,aP<0.05;与地尔硫卓组比较,bP<0.05;与注射前比较,cP<0.05;与注射后0.5 h比较,dP<0.05;与注射后2 h比较,eP<0.05
组别 动物数(只) 给药剂量(g/kg) 注射前 注射后0.5 h 注射后2 h 注射后6 h F P模型组 10 - 230.64±24.83 685.06±48.39c 291.93±41.39cd 188.01±15.31cde 684.473 0.000枳实薤白桂枝汤低剂量组 10 0.395 196.54±38.16a 657.4±43.35bc 186.5±19.02ad 153.72±19.94acde 1 637.220 0.000枳实薤白桂枝汤中剂量组 10 0.790 183.52±34.41a 545.24±42.99ac 215.46±42.1acd 131.97±21.12acde 1 196.426 0.000枳实薤白桂枝汤高剂量组 10 1.580 178.15±24.59a 502.81±43.25abc 181.06±23.65ad 118.63±16.02abcd 1 478.367 0.000地尔硫卓组 10 0.005 187.67±23.69a 581.18±54.45ac 201.66±31.1acd 146.5±22.12acd 533.860 0.000 F 4.922 26.559 18.749 18.884 P 0.002 0.000 0.000 0.000

图5 各组家兔用药前后BigET-1各时间点变化趋势图
3 讨 论
冠心病的实质是冠状动脉发生狭窄变化导致血流灌注下降引发的心肌缺血[10],每年全球因心血管疾病死亡的人数高达一千余万人[11]。美国心脏学会指出,如果能控制心脏疾病事故的发生,人类的平均寿命将延长约7年[12]。随着人们生活水平和社会科技水平的不断发展和进步,中医药在治疗心血管疾病的广泛应用得到了高度重视,其具有较稳定的药效,疗效可靠。
枳实薤白桂枝汤主要功效为通阳散结、祛痰下气,对心胸满痛,痛彻胸背,喘息咳唾,气短气逆,上攻于心胸等症有较好的疗效。相关研究报道,枳实薤白桂枝汤能有效地降低血液黏度,减少血小板的聚集,改善血管的舒张功能[13]。谈晓东等[3]发现冠心病患者连续服用枳实薤白桂枝汤4周,其SAQ评分、SF-36评分及血瘀证积分相对4周前均有改善。枳实薤白桂枝汤在治疗心血管疾病方面优势很大,对心肌缺血具有保护作用值得科研者探索。
冠状动脉痉挛是导致心肌缺血的主要原因,冠状动脉痉挛在体模型主要是通过活体动物进行局部的血管损伤诱导建立相关模型。目前冠状动脉痉挛的相关动物模型主要有药物刺激法、外膜缠绕法、内皮损伤法等。由于ET-1为血管中重要的舒缩因子,据报道在冠状动脉痉挛的同时其可与血管内NO成动态平衡[14],因此采用药物刺激法外源注射ET-1诱发家兔冠状动脉痉挛来探讨相关药物的作用机制。
心肌缺血的发生在ECG中主要是体现在T波、S-T段及QRS波群的改变,在急性冠脉综合征早期,S-T段的改变是心肌损伤的重要表现,当心肌受到损伤时,细胞膜的极化能力发生改变,导致电位差发生变化,因此T波、S-T段发生相应的改变,给冠心病提供了相应的诊断依据。本实验通过注射外源性药物诱导的方法使家兔发生冠状动脉痉挛,诱发心肌缺血,心电图Ⅱ导联T波出现高尖,S-T段持续抬高。各组家兔在注射ET-1 5 min后T波升高,S-T段不断抬高,10 min时达到峰值后逐渐下降。枳实薤白桂枝汤各剂量组与地尔硫卓组均可降低T波升高与S-T段抬高,与模型组比较,用药后各时间点枳实薤白桂枝汤中剂量组有显著差异,且与地尔硫卓组无显著差异。枳实薤白桂枝汤对冠状动脉痉挛诱发的心肌缺血具有一定的保护作用。
1978年,Furchgott在实验中发现在Ach的刺激下,血管内皮细胞可释放一种物质,此物质可以导致血管舒张,他将此物质命名为内皮细胞舒张因子NO[15]。研究表明内皮细胞舒张因子NO极易透过细胞膜,与肌球蛋白、血红蛋白等具有较强的亲和性[16]。BigET-1由血管内皮细胞合成,有较强的血管收缩能力,对血管可以起到调节作用。研究证明,在血管内BigET-1与NO可以相互调节,在维持血管内环境的平衡方面具有一定的作用[17]。二者失调时,则可诱发血管痉挛。本实验通过观察各组家兔血管内皮舒张因子NO及BigET-1表达,发现在药物诱导冠状动脉痉挛前后的各时间点枳实薤白桂枝汤各剂量组与地尔硫卓组对NO和BigET-1的水平均有不同程度的改善,与模型组比较均有显著的变化,其中枳实薤白桂枝汤中剂量组改善效果更明显,提示枳实薤白桂枝汤对冠状动脉痉挛所引起的心肌缺血血管的内皮细胞的内环境可能有改善作用。
综上所述,枳实薤白桂枝汤可以作用于心肌细胞使NO水平升高,同时可降低BigET-1,其机制是通过血管内皮源性舒张因子调节内环境平衡,减少自由基的产生,改善血流变化,从而改善心肌功能。本实验为初步探讨,其进一步机制还需进一步探究。

