通痹颗粒对胶原性关节炎大鼠RANKL/RANK/OPG系统及MMP-3、TIMP-1表达的影响*
柳玉佳,欧慧萍,吴伊莹,王莘智,范伏元
(1.湖南中医药大学第一附属医院,湖南 长沙 410007;2.湖南中医药高等专科学校,湖南 株洲 412012)
类风湿关节炎(rheumatoid arthritis,RA)是一种以对称性、慢性破坏性关节炎为主要临床特征的自身免疫疾病[1]。其主要病理生理学特征为滑膜的慢性炎症,并可出现关节软骨和骨质的破坏[2]。如果不积极治疗,可能会导致关节损伤和不可逆转的残疾。随着对RA发病机制的深入研究及早期诊断、早期治疗重要性认识的加强,其治疗策略也发生了重大改变[3]。
RA骨免疫稳态依赖于破骨细胞和成骨细胞之间的平衡。在RA滑膜微环境中,各种促炎因子的分泌与释放,促进了破骨细胞的分化能力,并经由骨免疫微环境募集破骨前体转化为成熟的破骨细胞,参与骨破坏进程[4]。核因子κB受体活化因子配体(receptor activator of nuclear factor κB Ligand,RANKL)/核因子κB受体(receptor activator of nuclear factor κB,RANK)/骨保护素(osteoprotegerin,OPG)系统和基质金属蛋白酶(matrix metalloproteinase,MMPs)作为骨稳态维持的重要信号,与RA的进程密切相关。前期研究[5-7]发现,通痹颗粒能够发挥多靶点调控作用,可有效缓解RA关节炎症及骨质破坏,然其具体机制尚未完全明确。本实验通过研究通痹颗粒对胶原性关节炎(collagen-induced arthritis,CIA)大鼠RANKL/RANK/OPG系统及MMP-3、基质金属蛋白酶抑制剂(tissue inhibitors of metalloproteinase,TIMP)-1表达的影响,进而揭示通痹颗粒对RA骨破坏的干预作用及分子机制,以更好地指导临床。
1 材料与方法
1.1 实验动物SPF级健康雌性SD大鼠60只,体质量200~250 g,由湖南中医药大学动物实验中心提供,动物生产许可证号:SCXK(湘)2019-0004。大鼠饲养于通风良好的环境,室温恒定在20~25℃,相对湿度40%~60%,标准光照。本实验已通过湖南中医药大学第一附属医院伦理委员会审查,批准号:20201010-35,并严格按照伦理要求进行研究。
1.2 药物与试剂 通痹颗粒,方药组成:当归,黄芪,白芥子,血竭,僵蚕,甘草等,由湖南中医药大学第一附属医院制剂科提供,并由煎药室制备浓缩为含生药1 g/mL。雷公藤多苷片(湖南千金协力药业有限公司,国药准字Z43020138,规格:10mg/片);牛Ⅱ型胶原(德国Biofroxx公司,批号:2275);完全弗氏佐剂(美国Sigma公司,批号:SA-F5881);兔抗鼠RANKL试剂盒(美国proteintech公司,货号:23408-1-AP);兔抗鼠RANK试剂盒(美国proteintech公司,货号:111860);兔抗鼠OPG试剂盒(美国proteintech公司,货号:ab73400);蛋白分子量标准Marker(美国Sigma公司,货号:V900372);RIPA裂解液(武汉菁禾生物科技有限公司,货号:P0013B);BCA蛋白定量试剂盒(武汉菁禾生物科技有限公司,货号:P1260);RNA提取试剂盒(美国Thermo公司,货号:15596026);逆转录试剂盒(北京康为世纪公司,货号:CW2569);MMP-3 ELISA试剂盒(武汉菁禾生物科技有限公司,货号:10374-1-AP);TIMP-1 ELISA试剂盒(武汉菁禾生物科技有限公司,货号:12899-1-AP)。
1.3 主要仪器PIKOREAL96型荧光定量RCP仪(美国Thermo公司);1658033型电泳仪(美国Biorad公司);DYCZ-40D型转膜仪(北京六一生物科技有限公司);BioPrep-24型生物样品均质仪(杭州奥盛仪器有限公司)。
1.4 造模与分组 将60只SD大鼠随机分为空白组、模型组、雷公藤多苷组、通痹颗粒低剂量组、通痹颗粒高剂量组,每组12只。除空白组外,其余4组大鼠行CIA造模,具体如下:牛Ⅱ型胶原蛋白冰浴后溶解在冰醋酸中,并用完全弗氏佐剂乳化,制备成牛Ⅱ型胶原。取制备好的牛Ⅱ型胶原0.2 mg于大鼠尾根部多点皮下注射进行初始免疫,2周后同前法以0.1 mg进行增强免疫,4周后进行CIA模型评判。保证注射免疫后大鼠关节炎指数评分≥6分,则为造模成功。
1.5 实验给药 造模成功后,药物均按照人-大鼠体表面积换算为等效剂量,通痹颗粒低剂量组为换算后等效人临床剂量,通痹颗粒高剂量组为等效人临床剂量的2倍。换算后雷公藤多苷组大鼠灌胃雷公藤多苷溶液,给药剂量为0.024 g/(kg·d);通痹颗粒低、高剂量组大鼠灌胃给予通痹颗粒溶液,给药剂量分别为9.600、19.200 g/(kg·d);空白组、模型组大鼠予等体积生理盐水灌胃,1次/d,连续2周。
1.6 观察指标 关节炎指数评分和关节肿胀度测量分别于治疗第0、7、14天进行。治疗第14天后所有大鼠脱颈处死,腹主动脉采血,3 000 r/min离心20 min,取上层血清-80℃条件封存,用于血清MMP-3、TIMP-1水平检测;左膝关节滑膜组织剥离,福尔马林液固定,用于滑膜组织病理形态学观察;右膝关节滑膜组织剥离,放入液氮中速冻,-80℃条件下封存,用于滑膜RANKL、RANK、OPG的mRNA和蛋白检测。
1.6.1 关节炎指数评分 根据大鼠关节受累情况进行评分,具体如下:关节无任何红肿为0分,红肿仅累及足趾关节为1分,红肿累及足底及足趾为2分,红肿累及踝关节以下为3分,红肿蔓延至全部足踝关节为4分。4个关节的评分累加即为大鼠的关节炎指数,最大值为16分。
1.6.2 关节肿胀度测量 各组大鼠双后踝关节同一位置做浸水线标记,采用足跖肿胀度测量仪测量大鼠的足跖容积,以其变化情况来估测关节肿胀度。
1.6.3 滑膜组织病理学观察 取固定好的大鼠左膝滑膜组织,EDTA溶液脱钙,梯度酒精脱水,石蜡包埋,切片厚度约5 μm,并行组织HE染色,中性树脂封片,光学显微镜下(×200)观察其组织病理学形态。
1.6.4 滑膜组织RANKL mRNA、RANK mRNA、OPG mRNA表达检测 取右膝滑膜组织,使用Trizol法提取总RNA,行RNA浓度及纯度测定,并以组织总的mRNA为模板用逆转录试剂盒获取互补的cDNA,后使用RT-PCR技术进行基因扩增和检测。反应条件:95℃预变性10 min,95℃15 s→60℃30 s,扩增40个循环。收集荧光得到的曲线图,以β-actin为内参,用实时荧光定量PCR程序分析,采用2-△△ct法计算目的RNA的相对表达量。引物序列见表1。

表1 引物序列
1.6.5 滑膜组织RANKL、RANK、OPG蛋白表达检测 将低温保存的滑膜组织粉碎,采用Western blotting法,加入RIPA冰上裂解后匀浆离心取上清,严格按照BCA法测定各样品蛋白浓度,并行SDS-PAGE电泳,恒流转印于NC膜后封闭过夜,加入一抗室温孵育90 min,PBST洗膜3次;二抗室温孵育90 min,PBST洗膜3次,ECL显色曝光。曝光后底片扫满,以β-actin为内参,用Quantity one专业灰度分析软件分析条带分子量及灰度值。
1.6.6 血清中MMP-3、TIMP-1水平检测 离心好的血清室温静置,使用ELISA法测定血清中MMP-3、TIMP-1水平,具体操作按照说明书进行。
1.7 统计学方法 采用SPSS 25.0软件进行数据分析,计量资料以(±s)表示,并行正态分布和单因素方差分析。若方差齐则以LSD检验进行比较;方差不齐则采用Tamhane’T2法。不同时间点的比较采用重复测量方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠关节炎指数评分比较 治疗前,模型组、雷公藤多苷组、通痹颗粒低剂量组、通痹颗粒高剂量组大鼠关节炎指数评分比较,差异无统计学意义(P>0.05)。大鼠关节炎指数评分不同时间比较,差异有统计学意义(F=7.512,P=0.000),即存在时间效应,雷公藤多苷组、通痹颗粒低剂量组、通痹颗粒高剂量组均如此;各组大鼠关节炎指数评分整体比较,差异有统计学意义(F=33.709,P=0.000),即存在分组效应;与空白组比较,模型组、雷公藤多苷组、通痹颗粒低剂量组、通痹颗粒高剂量组大鼠治疗第0、7、14天关节炎指数评分均升高(P<0.05);与模型组比较,雷公藤多苷组、通痹颗粒低剂量组、通痹颗粒高剂量组大鼠治疗第7、14天关节炎指数评分均降低(P<0.05);通痹颗粒低剂量组大鼠治疗第14天关节炎指数评分与雷公藤多苷组比较,差异无统计学意义(P>0.05),通痹颗粒高剂量组大鼠关节炎指数评分低于雷公藤多苷组(P<0.05)。时间因素与分组因素存在交互效应(F=9.214,P=0.000)。(见表2、图1)
表2 各组大鼠关节炎指数评分比较s,分)
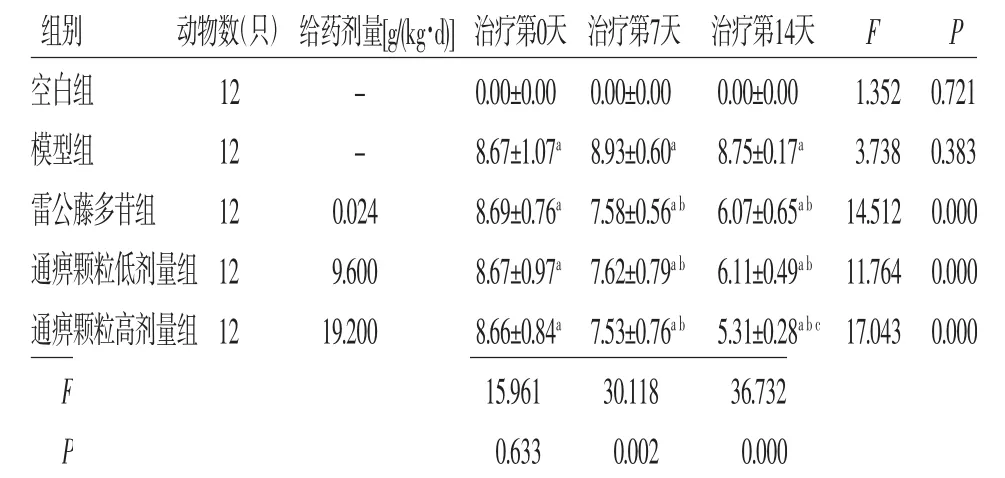
表2 各组大鼠关节炎指数评分比较s,分)
注:F时间主效应=7.512,P时间主效应=0.000;F分组主效应=33.709,P分组主效应=0.000;F交互效应=9.214,P交互效应=0.000;与空白组比较,aP<0.05;与模型组比较,bP<0.05;与雷公藤多苷组比较,cP<0.05
组别 动物数(只)给药剂量[g/(kg·d)]治疗第0天 治疗第7天 治疗第14天 F P空白组 12 - 0.00±0.00 0.00±0.00 0.00±0.00 1.352 0.721模型组 12 - 8.67±1.07a 8.93±0.60a 8.75±0.17a 3.738 0.383雷公藤多苷组 12 0.024 8.69±0.76a 7.58±0.56a b 6.07±0.65a b 14.512 0.000通痹颗粒低剂量组12 9.600 8.67±0.97a 7.62±0.79a b 6.11±0.49a b 11.764 0.000通痹颗粒高剂量组12 19.200 8.66±0.84a 7.53±0.76a b 5.31±0.28a b c 17.043 0.000 F 15.961 30.118 36.732 P 0.633 0.002 0.000
2.2 各组大鼠关节肿胀度比较 大鼠关节肿胀度不同时间比较,差异有统计学意义(F=4.373,P=0.000),即存在时间效应,雷公藤多苷组、通痹颗粒低剂量组、通痹颗粒高剂量组均如此;各组大鼠关节肿胀度整体比较,差异有统计学意义(F=26.728,P=0.000),即存在分组效应;与空白组比较,模型组、雷公藤多苷组、通痹颗粒低剂量组、通痹颗粒高剂量组大鼠治疗第0、7、14天关节肿胀均升高(P<0.05);与模型组比较,雷公藤多苷组、通痹颗粒低剂量组、通痹颗粒高剂量组大鼠治疗第7、14天关节肿胀度均降低(P<0.05);通痹颗粒低剂量组大鼠治疗第14天关节肿胀度与雷公藤多苷组比较,差异无统计学意义(P>0.05),通痹颗粒高剂量组大鼠关节肿胀度低于雷公藤多苷组(P<0.05)。时间因素与分组因素存在交互效应(F=7.921,P=0.000)。(见表3、图2)
表3 各组大鼠关节肿胀度比较±s,mL)

表3 各组大鼠关节肿胀度比较±s,mL)
注:F时间主效应=4.373,P时间主效应=0.000;F分组主效应=26.728,P分组主效应=0.000;F交互效应=7.921,P交互效应=0.000;与空白组比较,aP<0.05;与模型组比较,bP<0.05;与雷公藤多苷组比较,cP<0.05
组别 动物数(只)给药剂量[g/(kg·d)]治疗第0天 治疗第7天 治疗第14天F P空白组 12 - 3.21±0.15 3.19±0.32 3.22±0.55 1.142 0.564模型组 12 - 4.27±0.28a 4.35±0.13a 4.13±0.57a 5.871 0.293雷公藤多苷组 12 0.024 4.25±0.17a 3.91±0.51ab 3.68±0.36ab 12.057 0.000通痹颗粒低剂量组12 9.600 4.28±0.18a 3.96±0.29ab 3.71±0.49ab 9.549 0.000通痹颗粒高剂量组12 19.200 4.26±0.23a 3.83±0.37ab 3.49±0.12abc 16.374 0.000 F 35.682 63.947 78.673 P 0.761 0.002 0.000
2.3 各组大鼠滑膜组织病理学改变情况 空白组大鼠滑膜形态正常,细胞排列整齐,未见滑膜增厚及血管新生;模型组大鼠滑膜重度增生,可见缺损及血管翳形成;雷公藤多苷组大鼠滑膜稍厚,可见轻度血管新生及少量炎症细胞浸润;通痹颗粒低剂量组大鼠滑膜中度增厚,可见轻度血管新生及少量炎症细胞浸润;通痹颗粒高剂量组大鼠滑膜轻度增厚,血管新生不明显,但可见少量炎症细胞浸润。提示经过治疗后,CIA大鼠滑膜病变有所改善,雷公藤多苷组和通痹颗粒高剂量组优于通痹颗粒低剂量组。(见图3)
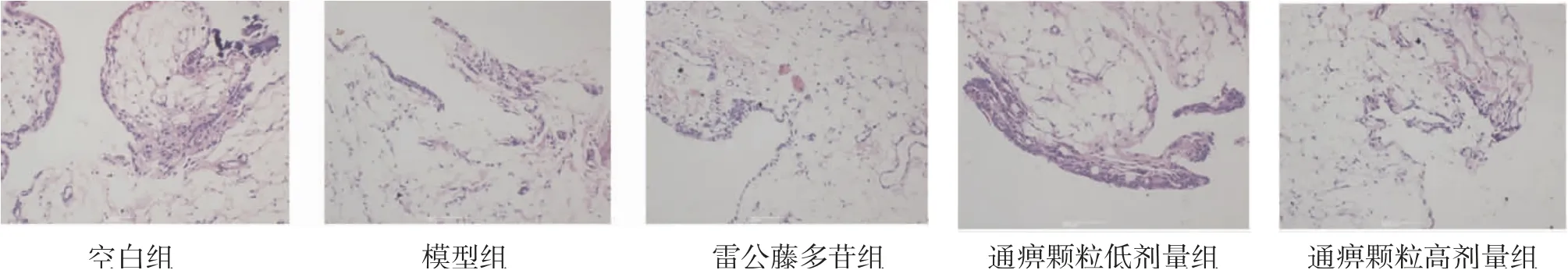
图3 各组大鼠滑膜组织病理学比较(HE,×200)
2.4 各组大鼠滑膜组织RANKL mRNA、RANK mRNA、OPG mRNA相对表达量比较 与空白组比较,模型组、雷公藤多苷组、通痹颗粒低剂量组、通痹颗粒高剂量组大鼠滑膜组织RANKL mRNA、RANK mRNA相对表达量明显升高(P<0.05),OPG mRNA相对表达量明显降低(P<0.05);与模型组比较,雷公藤多苷组、通痹颗粒低剂量组、通痹颗粒高剂量组大鼠滑膜组织RANKL mRNA、RANK mRNA相对表达量明显降低(P<0.05),OPG mRNA相对表达量明显升高(P<0.05);且通痹颗粒高剂量组大鼠滑膜组织RANKL mRNA、RANK mRNA相对表达量明显低于雷公藤多苷组(P<0.05),OPG mRNA相对表达量明显高于雷公藤多苷组(P<0.05)。(见表4)
表4 各组大鼠滑膜组织RANKL mRNA、RANK mRNA、OPG mRNA相对表达量比较

表4 各组大鼠滑膜组织RANKL mRNA、RANK mRNA、OPG mRNA相对表达量比较
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与雷公藤多苷组比较,cP<0.05
组别 动物数(只)给药剂量[g/(kg·d)]RANKL mRNA RANK mRNA OPG mRNA空白组 12 - 1.12±0.05 1.05±0.14 2.72±0.05模型组 12 - 2.78±0.12a 3.28±0.21a 1.31±0.17a雷公藤多苷组 12 0.024 1.79±0.16ab 1.67±0.17ab 1.85±0.07ab通痹颗粒低剂量组12 9.600 2.18±0.09ab 2.17±0.19ab 1.67±0.15ab通痹颗粒高剂量组12 19.200 1.46±0.07abc 1.31±0.08abc 2.18±0.12abc
2.5 各组大鼠滑膜组织RANKL、RANK、OPG蛋白相对表达量比较 与空白组比较,模型组、雷公藤多苷组、通痹颗粒低剂量组、通痹颗粒高剂量组大鼠滑膜组织RANKL、RANK蛋白相对表达量明显升高(P<0.05),OPG蛋白相对表达量明显降低(P<0.05);与模型组比较,雷公藤多苷组、通痹颗粒低剂量组、通痹颗粒高剂量组大鼠滑膜组织RANKL、RANK蛋白相对表达量明显降低(P<0.05),OPG蛋白相对表达量明显升高(P<0.05);且通痹颗粒高剂量组大鼠滑膜组织RANKL、RANK蛋白相对表达量明显低于雷公藤多苷组(P<0.05),OPG蛋白相对表达量明显高于雷公藤多苷组(P<0.05)。(见图4、表5)

图4 各组大鼠滑膜组织蛋白Western blotting条带
表5 各组大鼠滑膜组织RANKL、RANK、OPG蛋白相对表达量比较)
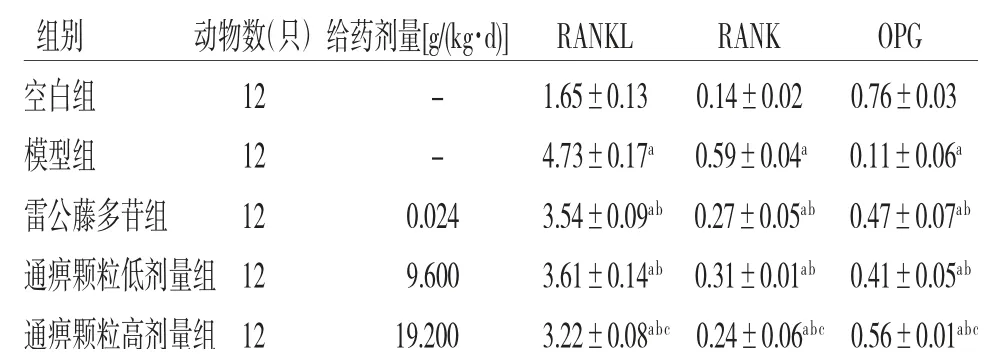
表5 各组大鼠滑膜组织RANKL、RANK、OPG蛋白相对表达量比较)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与雷公藤多苷组比较,cP<0.05
组别 动物数(只)给药剂量[g/(kg·d)] RANKL RANK OPG空白组 12 - 1.65±0.13 0.14±0.02 0.76±0.03模型组 12 - 4.73±0.17a 0.59±0.04a 0.11±0.06a雷公藤多苷组 12 0.024 3.54±0.09ab 0.27±0.05ab 0.47±0.07ab通痹颗粒低剂量组12 9.600 3.61±0.14ab 0.31±0.01ab 0.41±0.05ab通痹颗粒高剂量组12 19.200 3.22±0.08abc 0.24±0.06abc 0.56±0.01abc
2.6 各组大鼠血清中MMP-3、TIMP-1水平比较 与空白组比较,模型组、雷公藤多苷组、通痹颗粒低剂量组、通痹颗粒高剂量组大鼠血清中MMP-3、TIMP-1水平明显升高(P<0.05);与模型组比较,雷公藤多苷组、通痹颗粒低剂量组、通痹颗粒高剂量组大鼠血清中MMP-3、TIMP-1水平明显降低(P<0.05);且通痹颗粒高剂量组大鼠血清中MMP-3、TIMP-1水平低于雷公藤多苷组(P<0.05)。(见表6)
表6 各组大鼠血清中MMP-3、TIMP-1水平比较(s,pg/mL)
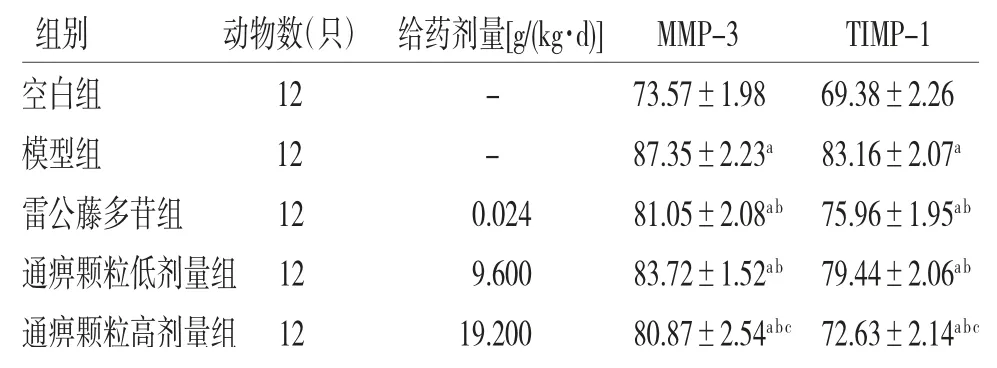
表6 各组大鼠血清中MMP-3、TIMP-1水平比较(s,pg/mL)
注:与空白组比较,aP<0.05;与模型组比较,bP<0.05;与雷公藤多苷组比较,cP<0.05
组别 动物数(只) 给药剂量[g/(kg·d)] MMP-3 TIMP-1空白组 12 - 73.57±1.98 69.38±2.26模型组 12 - 87.35±2.23a 83.16±2.07a雷公藤多苷组 12 0.024 81.05±2.08ab 75.96±1.95ab通痹颗粒低剂量组12 9.600 83.72±1.52ab 79.44±2.06ab通痹颗粒高剂量组12 19.200 80.87±2.54abc 72.63±2.14abc
3 讨 论
类风湿关节炎(RA)的病理特征为滑膜组织中过量促炎因子的产生,包括TNF-α、IL-1β和IL-6等。这些促炎因子不仅可以诱发MMPs的产生引起关节破坏,还可以经由RANK/RANKL/OPG系统激活成骨细胞或基质细胞生成RANKL,进而出现炎症性骨侵蚀[8]。
RA骨免疫重塑异常会导致吸收增加,从而引起骨质流失和骨化减少,并进一步抑制骨修复而出现骨破坏[9]。破骨细胞是RA患者骨重塑失衡的主要细胞群,而作为其产生及活化的重要调控途径,RANK/RANKL/OPG系统发挥了重要作用。RANK的表达主要发生在破骨细胞中,而其活化因子配体RANKL则以跨膜蛋白形式广泛表达于不同的骨细胞(成骨细胞和破骨细胞)及免疫系统的不同细胞亚群中,主要来源于RA的滑膜组织[10]。一旦RANKL与其受体RANK结合,破骨细胞的生成就会增加,从而发生骨免疫重塑异常导致骨质流失,进一步引起RA骨侵蚀。OPG是一种由基质细胞和破骨细胞分泌的RANKL可溶性受体,它可以抑制RANKL与RANK的结合,从而妨碍破骨细胞生成和骨吸收[11]。因此,RANK/RANKL/OPG系统是调节RA骨免疫代谢的重要途径,抑制RANKL可能是预防RA骨侵蚀的潜在治疗靶点[12]。MMPs是由成纤维样滑膜细胞分泌的一组内肽酶,可以降解细胞外基质蛋白,并对RA具有直接降解软骨和骨质的作用[13]。其中,MMP-3作为MMPs的重要组成成分,除了积极广泛参与RA的关节破坏外[14],还能够准确预测RA早期阶段的关节损伤情况,并能监测疾病的活动[15]。另外,MMP-3还可与其特异性产物TIMP-1结合,继而通过MMP-3的活化发挥对血管侵袭和滑膜炎症细胞浸润的调控作用,两者的一致性对于RA临床预后有着显著影响[16]。
RA属中医学“历节病”“鹤膝风”等范畴,现多以“尫痹”命名。《黄帝内经》云:“邪之所凑,其气必虚”,《济生方》亦载:“皆因体虚,腠理空疏,受风寒湿气而成痹也”。正虚是尫痹发病的内在原因,正气不足,腠理疏松,则易感邪而为痹[17]。《医级·杂病》曰:“痹非三气,患在痰瘀”,外邪痹阻经脉关节,气血运行失畅,久则化为痰浊、瘀血,以致筋骨肌肉失于濡养,甚则僵硬强直、屈伸不利,最终形成疑难顽疾。本课题组结合前期研究[18],提出了从“虚、瘀、痰”论治RA。据此研制出益气养血、化痰逐瘀的协定方剂通痹颗粒,由当归、黄芪、血竭、白芥子、僵蚕、甘草等组成。方中重用当归为君,温筋止痛,养血活血。黄芪甘温为臣,大补肺脾元气;与当归相伍,共资气血生化之源。僵蚕治风化痰,散结通经;血竭散瘀定痛,散滞和血;白芥子利气豁痰,暖中散肿;三者皆为佐药。以甘草为使,益气健脾,调和诸药。本实验研究发现,时间与组别的交互效应对CIA大鼠关节炎指数评分和关节肿胀度均有影响,经过治疗后,雷公藤多苷组、通痹颗粒低剂量组、通痹颗粒高剂量组大鼠关节炎指数评分和关节肿胀度均降低,治疗第14天通痹颗粒高剂量组优于雷公藤多苷组;经治疗后雷公藤多苷组、通痹颗粒低剂量组、通痹颗粒高剂量组大鼠滑膜病变均有改善,雷公藤多苷组和通痹颗粒高剂量组优于通痹颗粒低剂量组。另外,本实验对CIA大鼠骨代谢的进一步研究发现,与模型组比较,雷公藤多苷组、通痹颗粒低剂量组、通痹颗粒高剂量组大鼠滑膜组织RANK、RANKL的mRNA和蛋白相对表达量明显降低,OPG mRNA和蛋白相对表达量明显升高,且通痹颗粒高剂量组优于雷公藤多苷组,提示通痹颗粒可以通过下调RANK、RANKL,上调OPG的表达来发挥对RANKL/RANK/OPG系统的调节作用。同时,与模型组比较,雷公藤多苷组、通痹颗粒低剂量组、通痹颗粒高剂量组大鼠血清中MMP-3、TIMP-1水平明显降低,且通痹颗粒高剂量组优于雷公藤多苷组,提示通痹颗粒能有效平衡CIA大鼠血清中MMP-3和TIMP-1的异常表达。
综上所述,通痹颗粒能够减轻CIA大鼠的关节炎症,并对关节破坏具有一定的缓解作用,其机制可能与经由RANKL/RANK/OPG系统和MMPs调控骨代谢的作用有关。另外,本研究还发现通痹颗粒对于CIA大鼠的治疗呈现一定的剂量依赖性,即通痹颗粒高剂量组优于通痹颗粒低剂量组,但其临床应用中是否也存在一定的剂量相关性,将是我们接下来重点研究的内容。下一步我们将进一步结合临床,并从细胞分子水平探讨通痹颗粒对RA的治疗作用及其相关机制。

