从TLR2/TLR4介导的炎症因子表达水平探讨麻杏石甘汤抗流感病毒的免疫机理*
张香港,何谷良,赵 澄,陈纯静,肖 荣,胡 珏,魏 科,李 玲,宁 毅,卢芳国
(1.湖南中医药大学,湖南 长沙 410208;2.常德职业技术学院,湖南 常德 415000)
流行性感冒是由流感病毒感染引起的季节性急性呼吸道传染病,在中医学中属外感热病之瘟病、疫病范畴[1],它的发生发展是流感病毒的致病作用与抗病毒免疫应答作用相互影响和制约的结果。流感病毒进入不同机体后,病毒的增殖不仅可直接破坏宿主细胞的结构和代谢,导致组织炎症和病理改变,还会因机体免疫反应过度而引起广泛的免疫病理损伤。免疫病理损伤是流感病毒的重要致病机制[2]。有研究证实,流感病毒经呼吸道进入机体后,能促进肺巨噬细胞炎症因子(如IL-1、IL-6、TNF-α等)和趋化因子(如CCL2、CCL3、CXCL10等)大量分泌,过度分泌的细胞因子进一步造成严重的肺损伤[3-4]。肺泡灌洗液中CXCL10的含量水平与H1N1流感病毒导致肺组织的病理损伤程度呈正相关[5-6]。中医药在流行性感冒治疗中应用广泛并有着独特优势[7]。麻杏石甘汤源于《伤寒论》,具有辛凉宣肺、清热平喘的功效,该方具有镇咳、抗炎、抗病毒、调节免疫功能等多种药理作用,对咳嗽、支气管炎、肺炎、哮喘等多种疾病具有良好的治疗效果,并广泛用于流行性感冒热毒袭肺证和热毒壅肺证的治疗[8]。本课题组前期研究表明麻杏石甘汤能够通过调节趋化因子CCL5和CXCL10等的表达水平而发挥抗流感病毒作用[9]。笔者在前期研究基础上,以小鼠肺巨噬细胞为研究对象,从TLR2/TLR4介导的炎症因子表达水平进一步研究其抗流感病毒的分子机制。
1 材 料
1.1 病毒株A型流感病毒(A/PR/8/34)小鼠肺适应株由湖南师范大学病毒研究室提供,-80℃保存于湖南中医药大学病原微生物实验室。病毒原液经稀释108倍后接种于10 d龄鸡胚尿囊腔培养传代,血凝效价1∶640用于本实验。
1.2 细胞株 小鼠单核巨噬细胞RAW264.7购自中南大学湘雅细胞中心,本实验室传代后使用。
1.3 实验动物8周龄SPF级SD大鼠40只,体质量(200±20)g,雌雄各半,购自湖南斯莱克景达实验动物有限公司,动物生产许可证号:SCXK(湘)2016-000,常规饲养于湖南中医药大学SPF级屏障环境,12 h光照/黑夜循环,温度25℃,湿度60%,自由摄食饮水。实验单位使用许可证编号:SYXK(湘)2015-003。本实验过程中涉及的大鼠处理措施均已通过湖南中医药大学医学实验动物管理委员会批准。
1.4 药物与试剂 麻杏石甘汤方药组成:麻黄9 g,杏仁9 g,生石膏18 g,炙甘草6 g。麻黄(安徽普仁中药饮片有限公司,批号:1712052)、杏仁(亳州市沪谯药业有限公司,批号:1712170062)、生石膏(亳州市沪谯药业有限公司,批号:1706110212)、炙甘草(安徽亳药千草国药股份有限公司,批号:1707025)均购于湖南中医药大第一附属医院门诊部,经湖南中医药大学第一附属医院药学部戴冰教授鉴定均为2015年版《中华人民共和国药典》收录正品。磷酸奥司他韦胶囊(上海罗氏,批号:M1036);抗病毒口服液(广州香雪制药股份有限公司,批号:201705007);胎牛血清(美国Gibco公司,批号:2232246);0.25%胰酶(美国Gibco公司,批号:2120734);Lipopolysaccharides(美国Sigma公司,货号:L2630);Sparstolonin B(美国Sigma公司,货号:SML1767);Pam3csk4(美国InvivoGen公司,货号:tlrl-pms);IL-1 ELISA试剂盒(上海晶天生物科技有限公司,货号:TE20171110012);IL-8 ELISA试剂盒(上海晶天生物科技有限公司,货号:TE20171110121);TNF-α ELISA试剂盒(上海晶天生物科技有限公司,货号:TA20171108003);TLR2抗体(美国Abcam公司,批号:GR3188234-5);TLR4抗体(美国Abcam公司,批号:GR310706-5)。
1.5 主要仪器3111CO2细胞培养箱、1300生物安全柜(美国Thermo Scientific);ELx800酶标仪(美国伯腾仪器有限公司);光学扫描显微镜(Axioscope 5)+Axiocam 503 color显微镜摄像头(蔡司科技有限公司)。
2 方 法
2.1 麻杏石甘汤水煎液的制备 参考《伤寒论》[10]及前期研究结果[11],按其组成比例分别称量7剂的药材量。先称取63 g麻黄,加入药材总量10倍体积的蒸馏水,武火煎煮,待沸腾后,调整为文火煎煮25 min,去沫,再加入石膏126 g、杏仁63 g、甘草42 g,继续文火煎煮30 min,煎煮完毕后滤过;二煎加入7倍体积蒸馏水武火煮沸后再文火煎煮20 min,煎煮完毕后滤过,混匀2次药液浓缩至含生药4.26 g/mL,避光保存于4℃备用。
2.2 含药血清的制备 大鼠适应性喂养3 d后,按随机数字表法分为正常对照组、奥司他韦组、抗病毒口服液组、麻杏石甘汤组,每组10只。按动物体表面积与剂量换算法[12],以60 kg人体每日服用药物剂量与200 g大鼠体表面积换算得到各药物组临床等效剂量。按5倍临床等效剂量灌胃给药,计算出各药物组的给药剂量为:奥司他韦38.08 mg/(kg·d)、抗病毒口服液15.23 mL/(kg·d)、麻杏石甘汤21.32 g/(kg·d)。各药物组大鼠分别灌胃给予相应药物1 mL,正常对照组予以相同体积生理盐水灌胃,1次/d,持续灌胃7 d。末次灌胃后禁食2 h,以10%水合氯醛麻醉大鼠后行腹主动脉采血,静置后以3 000 r/min离心10 min,吸取上清液,再次离心上清液后用0.22 μm的除菌器滤过后分装成2 mL/支,-20℃保存备用。
2.3 含药血清对肺巨噬细胞活性影响的检测 小鼠肺巨噬细胞用胰蛋白酶消化后,行细胞计数,调节细胞浓度为(5.0~10.0)×104/mL,移至96孔细胞培养板(每孔接种100 μL)培养12 h后分组。实验设正常培养组(加10%胎牛血清)、空白血清组(分别加40%、20%、10%、5%大鼠空白血清)、奥司他韦含药血清组(分别加40%、20%、10%、5%奥司他韦大鼠含药血清)、抗病毒口服液含药血清组(分别加40%、20%、10%、5%抗病毒口服液大鼠含药血清)、麻杏石甘汤含药血清组(分别加40%、20%、10%、5%麻杏石甘汤大鼠含药血清),每组平行设置3个复孔。继续培养24、48 h后弃培养液,用MTT法检测细胞活性。
2.4 含药血清对A型流感病毒感染肺巨噬细胞TLR2/TLR4介导的IL-1、IL-8、TNF-α分泌水平影响的检测 小鼠肺巨噬细胞用胰蛋白酶消化后,行细胞计数,调节细胞浓度为(5.0~10.0)×104/mL。将细胞悬液接种于96孔细胞培养板(每孔接种100 μL),实验设正常对照组、TLR2激活剂(Pam3csk4)组、TLR4激活剂(LPS)组、TLR2/4抑制剂(SsnB)组、病毒对照组、奥司他韦组、抗病毒口服液组、麻杏石甘汤组。每组平行设置4个复孔。37℃,5%CO2条件下培养至孔板的60%时,病毒对照组和各药物组加入稀释倍数为100倍的病毒,各组均更换相应干预因素的10%胎牛血清培养液或10%相应含药血清DMEM高糖200 μL进行培养,各干预因素作用24、48 h后收集细胞上清液。用ELISA试剂盒检测IL-1、IL-8、TNF-α的分泌水平。
2.5 含药血清对A型流感病毒感染肺巨噬细胞TLR2、TLR4蛋白表达水平影响的检测 小鼠肺巨噬细胞用胰蛋白酶消化后,行细胞计数,调节细胞浓度为(5.0~10.0)×104/mL。将细胞悬液接种于已经加无菌圆形盖玻片的24孔板(每孔接种200μL),实验设正常对照组、TLR2激活剂(Pam3csk4)组、TLR4激活剂(LPS)组、TLR2/4抑制剂(SsnB)组、病毒对照组、奥司他韦组、抗病毒口服液组、麻杏石甘汤组。每组平行设置3个复孔。37℃,5%CO2条件下培养至孔板的60%时,病毒对照组和各药物组加入稀释倍数为100倍的病毒,各组均更换相应干预因素的10%胎牛血清培养液或10%相应含药血清DMEM高糖200 μL进行培养,各干预因素作用24 h后弃上清液,用PBS清洗3次后用4%多聚甲醛固定,将固定好的细胞用PBS清洗后,经阻断内源性过氧化物酶,滴加适量TLR2、TLR4一抗孵育、二抗孵育,DAB显色,复染,梯度脱水,透明,封片后,镜下观察结果。细胞呈现棕褐色或棕黄色为阳性表达。每张样本切片在高倍镜下(×400),随机选取5个视野,用Image-Pro Plus 5.0软件计算视野的平均光密度值,作为该样本的相对表达量。
2.6 统计学方法 实验数据使用SPSS 25.0处理分析。计量资料以“均数±标准差”(±s)表示,多组比较,对样本先进行正态及方差齐性检验,若数据符合正态分布且满足方差齐性,使用单因素方差分析,并用LSD法进行组间的多重比较,数据不符合正态分布时,用非参数Kruskal-Wallis秩和检验。
3 结 果
3.1 含药血清对肺巨噬细胞活性的影响 在含药血清干预24 h后,浓度为40%、20%、10%、5%的各含药血清组(奥司他韦含药血清组、抗病毒口服液含药血清组、麻杏石甘汤含药血清组)肺巨噬细胞活性与正常培养组比较,差异均无统计学意义(P>0.05)。说明各含药血清对肺巨噬细胞活性无显著性影响。在含药血清干预48 h后,10%的奥司他韦含药血清组肺巨噬细胞活性与正常培养组比较,差异无统计学意义(P>0.05),其余各含药血清组肺巨噬细胞活性明显高于正常培养组(P<0.01)。说明各浓度含药血清组对肺巨噬细胞均无毒性。本实验选择10%浓度的含药血清进行后续实验。(见表1)
表1 各组肺巨噬细胞活性比较±s,n=3)

表1 各组肺巨噬细胞活性比较±s,n=3)
24 h 48 h OD值 细胞活力(%)OD值 细胞活力(%)正常培养组 10% 1.55±0.21 100.00 0.59±0.07 100.00空白血清组 40% 1.51±0.13 97.41 0.87±0.09a 147.75 20% 1.70±0.08 109.67 0.86±0.07a 145.76 10% 1.55±0.21 100.00 0.84±0.01a 142.37 5% 1.55±0.73 100.00 0.87±0.01a 147.75奥司他韦含药血清组 40% 1.45±0.19 93.54 0.86±0.03a 145.76 20% 1.43±0.26 92.25 0.80±0.07a 135.59 10% 1.57±0.26 101.29 0.58±0.07 98.30 5% 1.68±0.11 108.38 0.76±0.03a 128.81抗病毒口服液含药血清组 40% 1.54±0.58 99.35 0.91±0.02a 154.23 20% 1.67±0.03 107.74 0.84±0.10a 142.37 10% 1.44±0.12 92.90 0.92±0.07a 155.93 5% 1.35±0.10 87.09 0.97±0.03a 164.40组别 血清浓度

续表1:
3.2 含药血清对A型流感病毒感染肺巨噬细胞TLR2/4介导的IL-1、IL-8、TNF-α分泌水平的影响
3.2.1 各组肺巨噬细胞IL-1的分泌水平比较 在含药血清干预24 h后,与正常对照组比较,TLR2激活剂组、TLR4激活剂组、病毒对照组肺巨噬细胞IL-1含量明显升高(P<0.01),TLR2/4抑制剂组肺巨噬细胞IL-1含量与正常对照组比较,差异无统计学意义(P>0.05);与病毒对照组比较,奥司他韦组、抗病毒口服液组、麻杏石甘汤组肺巨噬细胞IL-1含量明显降低(P<0.01);奥司他韦组、抗病毒口服液组、麻杏石甘汤组之间肺巨噬细胞IL-1含量比较,差异无统计学意义(P>0.05)。在含药血清干预48 h后,各组间肺巨噬细胞IL-1含量比较,差异无统计学意义(P>0.05)。(见图1)

图1 各组肺巨噬细胞IL-1含量比较s,n=4)
3.2.2 各组肺巨噬细胞IL-8的分泌水平比较 在含药血清干预24 h后,与正常对照组比较,TLR2激活剂组、TLR4激活剂组、TLR2/4抑制剂组、病毒对照组肺巨噬细胞IL-8含量明显升高(P<0.01);与病毒对照组比较,奥司他韦组、抗病毒口服液组、麻杏石甘汤组肺巨噬细胞IL-8含量明显降低(P<0.01);奥司他韦组、抗病毒口服液组、麻杏石甘汤组之间肺巨噬细胞IL-8含量比较,差异无统计学意义(P>0.05)。在含药血清干预48 h后,各组间肺巨噬细胞IL-8含量比较,差异无统计学意义(P>0.05)。(见图2)

图2 各组肺巨噬细胞IL-8含量比较s,n=4)
3.2.3 各组肺巨噬细胞TNF-α的分泌水平比较 在含药血清干预24 h后,与正常对照组比较,TLR2激活剂组、TLR4激活剂组、病毒对照组肺巨噬细胞TNF-α含量明显升高(P<0.01),TLR2/4抑制剂组肺巨噬细胞TNF-α含量与正常对照组比较,差异无统计学意义(P>0.05);与病毒对照组比较,奥司他韦组、抗病毒口服液组、麻杏石甘汤组肺巨噬细胞TNF-α含量明显降低(P<0.05);奥司他韦组、抗病毒口服液组、麻杏石甘汤组之间肺巨噬细胞TNF-α含量比较,差异无统计学意义(P>0.05)。在给药48 h后,各组间肺巨噬细胞TNF-α含量比较,差异无统计学意义(P>0.05)。(见图3)

图3 各组肺巨噬细胞TNF-α含量比较s,n=4)
3.3 含药血清对A型流感病毒感染肺巨噬细胞TLR2、TLR4蛋白表达水平的影响 在含药血清干预24 h后,与正常对照组比较,TLR2激活剂组、TLR4激活剂组、病毒对照组肺巨噬细胞TLR2、TLR4蛋白表达平均光密度值明显升高(P<0.05或P<0.01),TLR2/4抑制剂组肺巨噬细胞TLR2、TLR4蛋白表达平均光密度值与正常对照组比较,差异无统计学意义(P>0.05);与病毒对照组比较,奥司他韦组、麻杏石甘汤组肺巨噬细胞TLR2蛋白表达平均光密度值明显降低(P<0.05或P<0.01),麻杏石甘汤组肺巨噬细胞TLR4蛋白表达平均光密度值明显降低(P<0.05)。(见表2、图4~5)
表2 各组肺巨噬细胞TLR2、TLR4蛋白表达平均光密度值±s,n=3)

表2 各组肺巨噬细胞TLR2、TLR4蛋白表达平均光密度值±s,n=3)
注:与正常对照组比较,aP<0.05,bP<0.01;与病毒对照组比较,cP<0.05,dP<0.01
组别 TLR2 TLR4正常对照组 0.24±0.16 0.12±0.04 TLR2激活剂组 0.32±0.25a 0.29±0.02b TLR4激活剂组 0.32±0.44a 0.29±0.08b TLR2/4抑制剂组 0.24±0.14 0.12±0.01病毒对照组 0.34±0.06b 0.24±0.01b奥司他韦组 0.23±0.03d 0.18±0.03抗病毒口服液组 0.30±0.01 0.18±0.04麻杏石甘汤组 0.26±0.04c 0.14±0.03c F 4.241 8.278 P 0.008 0.000
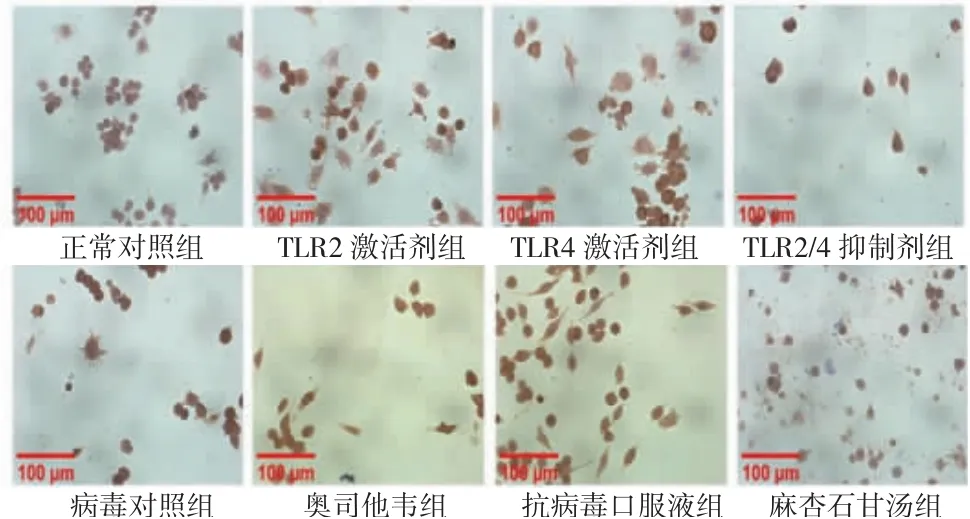
图4 含药血清干预24 h各组小鼠肺巨噬细胞TLR2蛋白表达水平(免疫组化,×400)
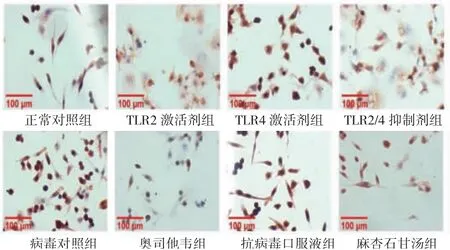
图5 含药血清干预24 h各组小鼠肺巨噬细胞TLR4蛋白表达水平(免疫组化,×400)
4 讨 论
流感病毒感染机体后,机体启动免疫应答分泌细胞因子发挥抗病毒作用,主要表现为急性呼吸道感染症状,部分患者尤其是免疫功能低下或免疫功能紊乱的儿童及老人可表现为急性肺损伤(acute lung injury,ALI),甚至出现严重的急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS),导致呼吸衰竭和多器官损伤。尽管目前流感病毒导致ARDS的机制尚未完全阐明,但病毒感染所致的“细胞因子风暴”与肺损伤的相关性已被普遍认同。“细胞因子风暴”是指机体免疫系统被过度激活而引起趋化因子和促炎性细胞因子的过度释放。过度释放的细胞因子在清除病原体的同时,会诱导炎症反应,引起组织器官功能紊乱、衰竭乃至机体死亡。
单核吞噬细胞系统中巨噬细胞是重要的先天免疫细胞,其对增强机体防御、促进组织发育和维持机体稳态起着关键的作用,并且是机体防御病原体入侵的第一道防线。巨噬细胞通过其表面受体识别病原体,经吞噬、消化及抗原提呈作用后,促进机体细胞因子的表达来抵抗病原体入侵。Toll样受体家族(Toll-like receptors,TLRs)是介导天然免疫的重要膜分子,其能识别病原微生物中的进化保守分子结构。目前已发现至少存在13个TLRs家族成员,其中TLR2、TLR4高表达于巨噬细胞、B细胞、树突状细胞表面。TLR2/TLR4能监视与识别疾病相关分子模式而启动信号通路的信号转导[13]。流感病毒感染机体后,表达于巨噬细胞表面的TLR2、TLR4分子识别并结合病毒蛋白而启动免疫应答,诱导细胞因子表达[14]。细胞因子对抑制病毒复制和调节适应性免疫具有重要的作用,但过度的细胞因子表达与分泌则会导致免疫病理损伤。因此,调节Toll样受体表达与活化水平及其下游细胞因子的分泌是药物抗流感病毒的效应机制之一。本研究发现,与正常对照组比较,A型流感病毒感染肺巨噬细胞24 h后细胞上清液IL-1、IL-8、TNF-α含量明显升高,同时细胞免疫组化结果显示TLR2、TLR4蛋白表达水平明显升高,说明A型流感病毒可通过激活TLR2/TLR4信号通路促进炎症因子IL-1、IL-8、TNF-α的分泌导致肺组织免疫病理损伤。
麻杏石甘汤源于《伤寒论》,是治疗外感热病的常用方。方中麻黄辛苦温,宣肺解表而平喘;石膏辛甘大寒,清泻肺胃之热以生津,两药相辅,共为君药。石膏倍于麻黄制麻黄温热之性,使整方不失为辛凉之剂,麻黄得石膏则宣肺平喘而不助热。臣药杏仁降利肺气而平喘,与麻黄宣降相因。佐药甘草调和诸药。四药共奏辛凉宣肺、清热平喘之效。该方在国家卫生健康委员会发布的《流行性感冒诊疗方案(2019年版)》及《流行性感冒诊疗方案(2020年版)》中被推荐为治疗流感热毒袭肺证、热毒壅肺证的基础处方[15-16]。研究表明该方对TLR4、TLR7/8介导的TNF-α、IL-1、IL-6、IFN-α/β蛋白表达水平有调节作用,并能够下调趋化因子CCL3、CCL25的蛋白表达水平而缓解流感病毒感染小鼠后引起的肺部免疫病理损伤[17-19]。本研究发现,麻杏石甘汤含药血清干预24 h可明显降低A型流感病毒刺激的肺巨噬细胞上清液中IL-1、IL-8、TNF-α含量,并明显降低肺巨噬细胞TLR2、TLR4蛋白表达水平,说明该方可通过调节A型流感病毒感染肺巨噬细胞TLR2、TLR4表达水平进而影响炎症因子的分泌水平,这可能是其抗病毒作用的效应机制之一。本研究可为该方治疗流感的临床应用提供一定的科学依据,然而,麻杏石甘汤的有效成分复杂,除TLR2/TLR4信号通路外,该方可否通过其他途径调节流感病毒感染导致的炎症因子的分泌水平有待进一步研究,其抗流感病毒作用的其他靶点仍需进一步挖掘。

