下调环状RNA circ-BTG2对肾癌细胞增殖和迁移的影响及其机制
赵云飞 徐祖伟 黄耿 桂定文 姜卫东 付金伦 彭伟 万京桦鄂东医疗集团黄石市中心医院(湖北理工学院附属医院)泌尿外科 45000;肾脏疾病发生与干预湖北省重点实验室,黄石 45000;武汉科技大学职业危害识别与控制湖北省重点实验室 40065
肾癌是世界范围内最常见的泌尿系统肿瘤之一,发病率及病死率呈逐年升高[1]。基因治疗是肾癌研究的新方向。环状RNA(circRNA)是一类保守的小分子序列,呈闭环结构,能够有效调控基因的表达,导致细胞生物学行为发生变化[2]。肾癌与circRNA的异常表达直接相关,circRNA在肾癌的发生和发展中产生重要影响[3]。目前仅有少部分circRNA在肾癌中的作用得到了证实,使得以circRNA为靶点的靶向治疗成为了肾癌研究者共同关注的重点[4]。circ-BTG2是一种新发现的circRNA,circ-BTG2在肾癌中的作用及机制并不清楚。本研究通过实验研究下调circ-BTG2对肾癌细胞生物学性状的影响及具体机制。
1 材料与方法
1.1 细胞与主要试剂 肾癌786-O细胞株购于上海中科院细胞库;实时荧光定量聚合酶链反应(qRT-PCR)相关试剂盒购于日本TaKaRa公司;circ-BTG2抑制剂(GATAACAGGGTAACGCTGTCT)和无义对照序列由广州市锐博生物科技有限公司合成;转染试剂Lipofectamine RNAiMAX购于美国Invitrogen公司;Transwell小室购自美国Corning公司;一抗购于美国BD公司;四甲基偶氮唑蓝(MTT)试剂盒和二甲基亚砜购自武汉博士德生物技术有限公司。
1.2 细胞培养和分组 786-O细胞培养在含10%胎牛血清(FBS)的RPMI 1640培养基,培养条件为5%CO2、37℃。将对数生长期786-O细胞接种至24孔板,依据Lipofectamine RNAiMAX的说明将无义对照序列和circ-BTG2抑制剂转染,命名为对照组和实验组。
1.3 qRT-PCR检测circ-BTG2和Grb2协同结合蛋白2(Grb2-associated binding protein-2,GAB2)信 使RNA(mRNA)的表达 选择Trizol试剂提取786-O细胞总RNA,进一步合成cDNA,依据qRT-PCR相关试剂盒的说明进行扩增。使用2-ΔΔCt方法计算相对表达量,以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,引物序列见表1。

表1 qRT-PCR引物序列
1.4 MTT法检测细胞活性 取对数生长期的转染后786-O细胞,分别以5×103个/孔接种96孔板,连续5 d MTT检测。每孔分别加入MTT溶液,培养箱孵育3.5 h。采用移液器吸去溶液,每孔分别加入二甲基亚砜,在振荡器上快速震荡30 min。在490 nm波长处,利用酶标仪检测细胞的吸光度(A)值。
1.5 Transwell迁移实验检测786-O细胞迁移能力 取对数生长期的转染后786-O细胞,采用不含FBS的RPMI 1640培养基重悬786-O细胞,以1×104个/孔接种于Transwell上室,在下室加含血清的RPMI 1640培养基。培养24 h。利用甲醇固定、结晶紫染色,利用棉签擦去未穿过微孔膜的786-O细胞,在光学显微镜(×100)下拍照、计数。
1.6 Western blotting检测GAB2蛋白和AKT/mTOR信号通路蛋白表达 取对数生长期的转染后786-O细胞,依据蛋白提取试剂盒说明书分别提取各组786-O细胞总蛋白,设定电泳参数,在十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)胶中电泳以分离蛋白,采用电转法将分离后的蛋白转至聚偏二氯乙烯膜。利用10%的脱脂牛奶进行封闭。采用适量封闭液制备一抗,在4℃孵育12 h。洗膜后,加入辣根过氧化物酶(HRP)标记的二抗羊抗兔,室温下孵育1.5 h,滴加发光液,利用凝胶成像系统曝光、显影。
1.7 统计学方法 利用SPSS 17.0统计学软件对所有数据进行统计分析,计量资料符合正态分布,以(±s)表示,两组间比较均采用独立样本t检验,P<0.05认为差异有统计学意义。
2 结 果
2.1 qRT-PCR检测转染后786-O细胞中circ-BTG2的表达 在786-O细胞株中,对照组与实验组中circ-BTG2表达 量 分 别 为(1.70±0.20)和(0.44±0.09),实 验 组circ-BTG2表达被明显抑制(t=5.69,P<0.01),见图1。
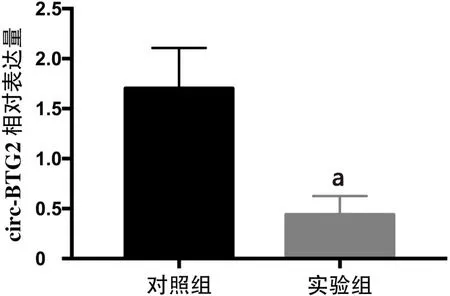
图1 转染阴性对照无义序列(对照组)及circ-BTG2抑制剂(实验组)后786-O细胞中circ-BTG2的表达
2.2 MTT法检测转染后786-O细胞增殖情况 MTT分析结果显示,与对照组786-O细胞相比,实验组786-O细胞转染circ-BTG2后第2天开始,786-O细胞的增殖水平下降(t=3.86,P<0.05),见图2。
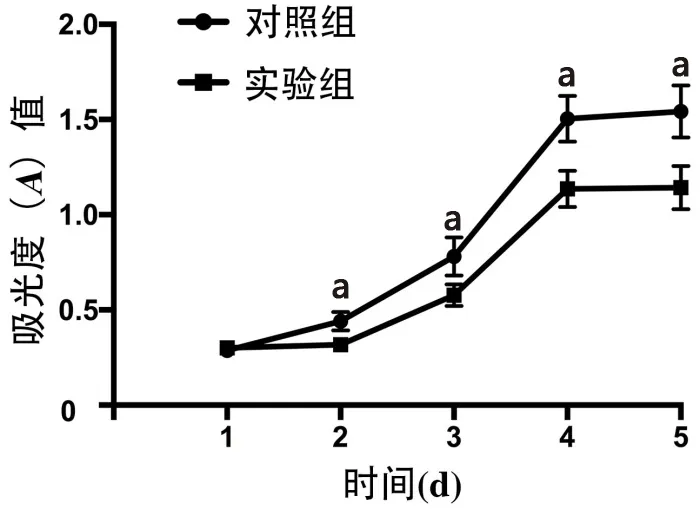
图2 circ-BTG2对786-O细胞增殖情况的影响
2.3 Transwell迁移实验检测转染后786-O细胞的迁移情况 Transwell迁移实验分析显示,对照组和实验组迁移786-O细胞数分别为(94.91±15.34)个和(25.48±6.60)个,实验组迁移细胞数明显减少(t=4.16,P<0.01),这表明circ-BTG2可导致786-O细胞迁移能力明显降低,见图3。
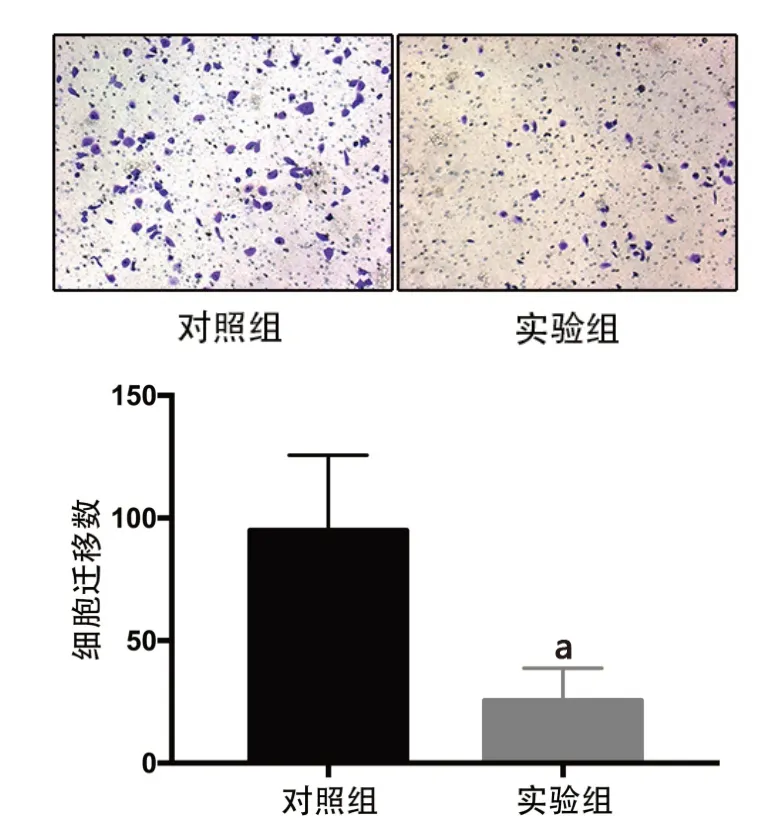
图3 circ-BTG2对786-O细胞迁移情况的影响(×100)
2.4 qRT-PCR检测转染后786-O细胞中GAB2 mRNA的表达 在786-O细胞株中,对照组与实验组中GAB2 mRNA表达量分别为(2.86±0.24)和(1.27±0.18),实验组GAB2 mRNA表达被明显抑制(t=5.25,P<0.01)。
2.5 Western blotting检测GAB2蛋白和AKT/mTOR信号通路蛋白的表达 与对照组786-O细胞相比,实验组786-O细胞中GAB2蛋白表达明显降低,AKT/mTOR信号通路蛋白如p-AKT蛋白、p-mTOR蛋白表达明显降低,见图4。
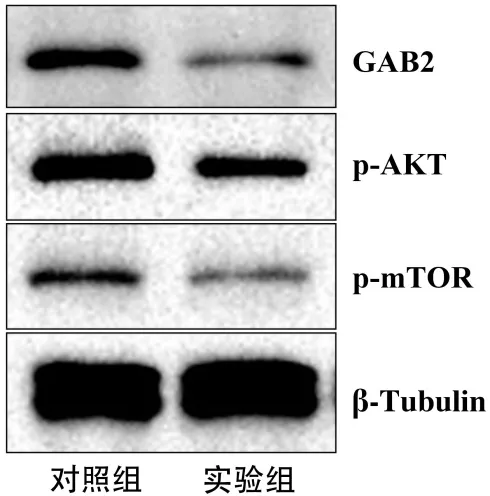
图4 Western blotting检测GAB2蛋白及AKT/mTOR信号通路蛋白相对表达
3 讨 论
circRNA广泛存在于动植物细胞内,直接影响细胞的分化、增殖、发育等生物学功能[5]。越来越多的circRNA被证实在肾癌中异常表达,在肾癌的发生、发展中起到了非常重要的调控作用[6]。Sun等[7]报道,circ-SCARB1在肾癌组织和细胞系中升高,敲除circ-SCARB1抑制细胞增殖、迁移和侵袭,同时诱导细胞凋亡,miR-510-5p是circ-SCARB1的靶标。Liu等[8]报道,肾癌细胞系和组织中circPTCH1表达上调,其高水平表达的患者生存率降低,circPTCH1可在体外和体内诱导肾癌细胞迁移和侵袭能力增加。circ-BTG2是一种新发现的长链非编码RNA(lncRNA),circ-BTG2在肾癌细胞中作用及机制尚未见报道。
本研究显示,下调circ-BTG2能够抑制肾癌细胞的增殖和迁移,表明circ-BTG2高表达可能参与肾癌的发生和发展。GAB2蛋白由1 870个氨基酸构成,其在多种恶性肿瘤如卵巢癌、前列腺癌、乳腺癌中存在过量表达,与肿瘤的分期、分级相关,沉默GAB2蛋白可显著抑制肿瘤细胞的增殖和转移[9-10]。Mu等[11]报道,miR-218通过抑制GAB2蛋白表达抑制肾癌细胞的恶性生物学行为,GAB2在肾癌中表现为癌基因作用。本研究结果表明,下调circ-BTG2可明显抑制GAB2基因的表达。AKT/mTOR信号通路在肾癌细胞的恶性转化中发挥关键作用[12]。GAB2蛋白表达被抑制后,AKT/mTOR信号通路蛋白表达明显降低,表明AKT/mTOR信号通路被抑制。
综上所述,本研究证实过表达circ-BTG2有助于抑制肾癌细胞的增殖和侵袭,其具体机制可能与抑制GAB2基因表达相关。circ-BTG2的深入研究可能为肾癌的基因治疗提供新的突破口。
利益冲突:作者已申明文章无相关利益冲突。

