参附注射液对脓毒症模型小鼠脾脏淋巴细胞Treg/Th17免疫平衡的影响*
吴峥嵘,李渊,郝素英
北京中医药大学东方医院,北京 100078
脓毒症是指机体对感染导致的宿主免疫功能失调而引起的危及生命的器官功能障碍[1-2],对人类健康造成了巨大威胁,已成为全球范围内危重患者死亡的主要病因[3]。研究表明,免疫抑制是脓毒症晚期最重要的变化,脓毒症患者因免疫功能低下导致反复出现全身性严重感染[4]。中医学认为,脓毒症的病机为邪毒内陷、正气无力、抗邪之气微阳脱、脏腑衰弱所致的气机逆乱。参附注射液由人参、附子组成,具有益气扶正、补气通阳的功效[5]。研究表明,参附注射液可以通过调节脓毒症患者的免疫功能,维持免疫和炎症之间的平衡,从而改善临床症状[6-7]。研究显示,T淋巴细胞凋亡与脓毒症后期的免疫抑制关系密切[8]。阻断淋巴细胞凋亡能明显延长脓毒症小鼠的生存期[9]。在调控T淋巴细胞分化中Notch信号通路发挥重要的作用,抑制Notch信号通路能提高脓毒症小鼠的抗感染能力[10-12]。参附注射液对脓毒症的免疫调节机制尚未报道,本研究基于Notch信号通路探讨参附注射液对脓毒症的免疫调控作用,为临床提供数据支持。
1 材料
1.1 动物SPF级C57BL/6雄性小鼠40只,8~10周龄,体质量28~30 g,动物许可证号:SCXK(京)2012-0001,由北京维通利华实验动物技术有限公司提供。依照本院实验动物管理办法,室温下标准饲料、自由饮水、分笼(4笼)适应性饲养一周后用于实验。本研究中所有动物实验操作均经本院实验动物管理伦理委员会批准,伦理批号:2019-032。
1.2 药物与试剂参附注射液(雅安三九药业公司,批号:01811201)。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、IL-10酶联免疫测定试剂盒(enzyme linked immuno sorbent assay,ELISA)(南京建成生物有限公司,批号:NJ1256、NJ60082、NJ00283);苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒(北京索莱宝生物科技有限公司,批号:G112015);原位末端标记(TdT-mediated dUTP nick and labeling,TUNEL)试剂盒(美国Trevigen公司,批号:TR25658);兔抗小鼠Notch1单抗和羊抗小鼠Hes1单抗(美国Invitrogen公司,批号:46-2500、46-1589)。
1.3 仪器LIOOS600T型荧光显微镜(日本Nikon公司);GelDoc Go型凝胶成像系统(美国Bio-Rad公司);RM2135型组织切片机(德国Leica公司);20PR-52D型高速冷冻离心机(日本Hitachi公司);FACS420型流式细胞仪(美国BD公司)。
2 方法
2.1 动物模型构建和分组处理小鼠适应性喂养1周后随机分为4组,每组10只,即假手术组、模型组、参附注射液低剂量组(5 mL·kg-1)、参附注射液高剂量组(10 mL·kg-1)。除假手术组外,其余各组小鼠采用盲肠结扎穿孔手术制备脓毒症模型[13]:术前12 h禁食,10%异氟烷腹腔注射将小鼠麻醉后,取仰卧位固定在无菌操作台上,于腹正中行纵切口2 cm,牵出盲肠,使用4号线结扎盲肠根部,同时使用14G套管针将盲肠贯通穿孔,轻微用力挤出少许大便,确保穿刺空的通畅,使肠管回腹腔,逐层缝合伤口。假手术组小鼠仅暴露盲肠后即进行伤口缝合,其他操作同上。造模后2 h各组给予相应的药物,每12 h腹腔注射1次,连续4次,假手术组和模型组注射同体积生理盐水。
2.2 ELISIA法检测小鼠血清中TNF-α、IL-6和IL-10水平采用摘除眼球法收集各组小鼠外周血后,离心,取血清,ELISIA试剂盒检测小鼠血清中 TNF-α、IL-6、IL-10水平。
2.3 计算小鼠脾脏指数取血后,将小鼠以颈椎脱臼法处死,在显微镜下准确剥离小鼠脾脏,称取质量,计算小鼠的脾脏指数。
脾脏指数=脾脏质量/体质量
2.4 HE染色检测各组小鼠脾脏组织病理学改变每组随机选择3只小鼠,取脾脏,置于40 ng·L-1多聚甲醛中固定,按HE染色步骤制作切片,光镜下观察小鼠脾脏病理改变。
2.5 TUNEL染色检测各组小鼠脾脏细胞凋亡取上述HE染色的蜡块,二甲苯浸洗两次,梯度乙醇浸洗5 min,风干后用3%双氧水-甲醇浸泡 10 min,PBS漂洗3次,每次3 min,然后4 ℃预冷乙醇上进行如下操作:0.1%TritonX-100、0.1%缓冲液处理2 min,PBS漂洗3次,每次3 min,加入TUNNEL反应混合液,加封口膜在暗湿盒中反应1 h,37 ℃ PBS漂洗,梯度乙醇脱水,二甲苯透明,中性树脂封片,荧光显微镜观察小鼠脾脏的细胞凋亡情况。
2.6 流式细胞术检测各组小鼠脾脏组织中Treg、Th17淋巴细胞的百分比将每组小鼠静脉血1 mL放入EDTA抗凝管中,加入抗体(FITC抗人IL-17 mAbIgG、FITC 抗人CD25mAb)10 μL,室温下避光孵育30 min,然后加入200 μL溶血素避光放置 15 min,裂解红细胞,3 000 r·min-1离心5 min,用PBS重悬后再离心,洗涤2次,沉淀用100 μL 10 ng·L-1多聚甲醛溶液固定,流式细胞仪检测Treg、Th17细胞百分比。
2.7 Western blot检测各组小鼠脾脏组织中Notch1、Hes1蛋白表达每组随机选择3只小鼠,取脾脏,提取总蛋白,经BCA试剂盒测定蛋白浓度后,变性,取50 μg总蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,将样品蛋白转至PVDF转膜上,脱脂奶粉封闭后,一抗(11 500)稀释后,4 ℃ 孵育过夜,洗涤加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗孵育3 h,增强化学发光ELC显色30 min,经曝光、显影、定影后,以GAPDH为内参来表示蛋白的表达水平。

3 结果
3.1 参附注射液对小鼠脾脏指数的影响与假手术组比较,模型组小鼠脾脏指数显著降低(P<0.05);与模型组比较,参附注射液低、高剂量组小鼠脾脏指数显著升高(P<0.05),且高剂量组变化更明显。见图1。
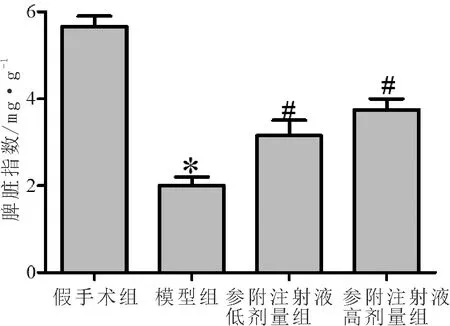
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05图1 各组小鼠脾脏指数的比较
3.2 参附注射液对小鼠脾脏组织病理学改变的影响假手术组小鼠脾脏表面有光泽,结构完整,红髓、白髓界限清晰,脾小体形态和数量正常,脾小结性状正常,淋巴细胞未见有明显的分化分裂现象,细胞分布致密;模型组小鼠脾脏肿胀明显,体积变大,脾脏结构破坏明显,红髓、白髓分界不清,红髓缩小,白髓区域扩张,滤泡增加,结缔组织增加,脾小体数量明显减少,脾小结不同程度肿胀,淋巴细胞排列稀疏;参附注射液低、高剂量组小鼠脾脏可见清晰的白髓、红髓以及边缘区,脾小体数量、淋巴细胞数量有所增加,脾脏病理变化均有所改善,且高剂量组改善更明显。见图2。

注:A:假手术组;B:模型组:C:参附注射液低剂量组;D:参附注射液高剂量组图2 观察各组小鼠的脾脏组织病理损伤改变(HE染色,×200)
3.3 参附注射液对小鼠脾脏细胞凋亡的影响与假手术组比较,模型组小鼠脾脏细胞凋亡率显著升高(P<0.05);与模型组比较,参附注射液低、高剂量组小鼠脾脏细胞凋亡率显著下降(P<0.05),且高剂量组变化更明显。见图3。
3.4 参附注射液对小鼠脾脏Th17、Treg淋巴百分比的影响与假手术组比较,模型组小鼠脾脏Th17淋巴细胞百分比显著升高,Treg淋巴细胞百分比显著降低(P<0.05);与模型组比较,参附注射液低、高剂量组小鼠脾脏Th17淋巴细胞百分比显著降低,Treg淋巴细胞百分比显著升高(P<0.05),且高剂量组变化更明显,说明参附注射液可明显改善脓毒症小鼠Th17、Treg淋巴细胞百分比,维持免疫调节功能的平衡。见图4。
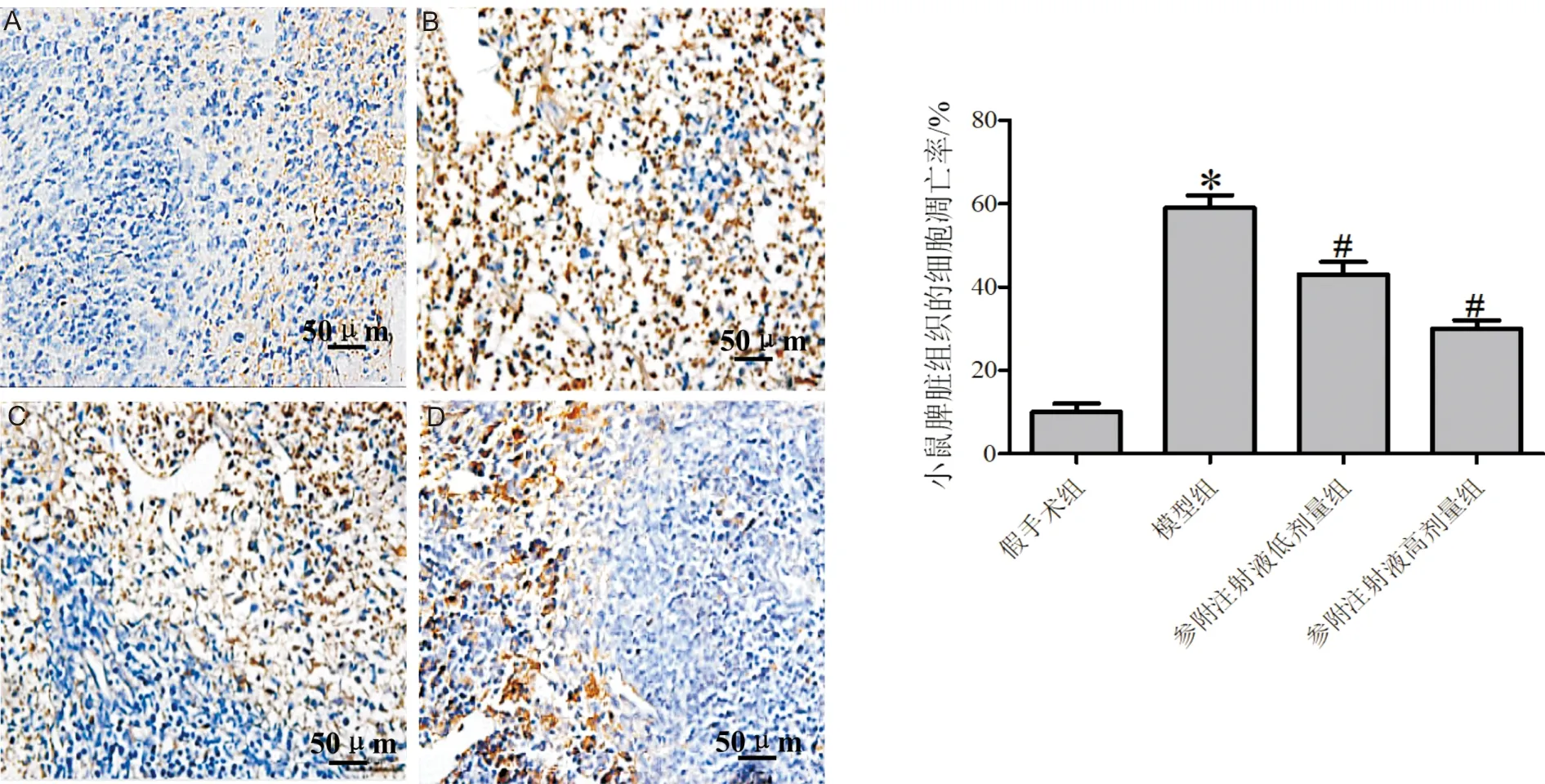
注:A:假手术组;B:模型组;C:参附注射液低剂量组;D:参附注射液高剂量组。与假手术组比较,*P<0.05;与模型组比较,#P<0.05图3 TUNEL染色检测小鼠脾脏组织中细胞的凋亡(×400)

注:A:假手术组;B:模型组;C:参附注射液低剂量组;D:参附注射液高剂量组。与假手术组比较,*P<0.05;与模型组比较,#P<0.05图4 各组小鼠脾脏Th17、Treg淋巴细胞百分比
3.5 参附注射液对小鼠血清中TNF-α、IL-6和IL-10水平的影响与假手术组比较,模型组小鼠血清中IL-17、TNF-α水平显著升高,IL-10水平显著下降(P<0.05);与模型组比较,参附注射液低、高剂量组小鼠血清IL-17、TNF-α水平显著下降,IL-10水平显著升高(P<0.05),且高剂量组变化更明显。见图5。
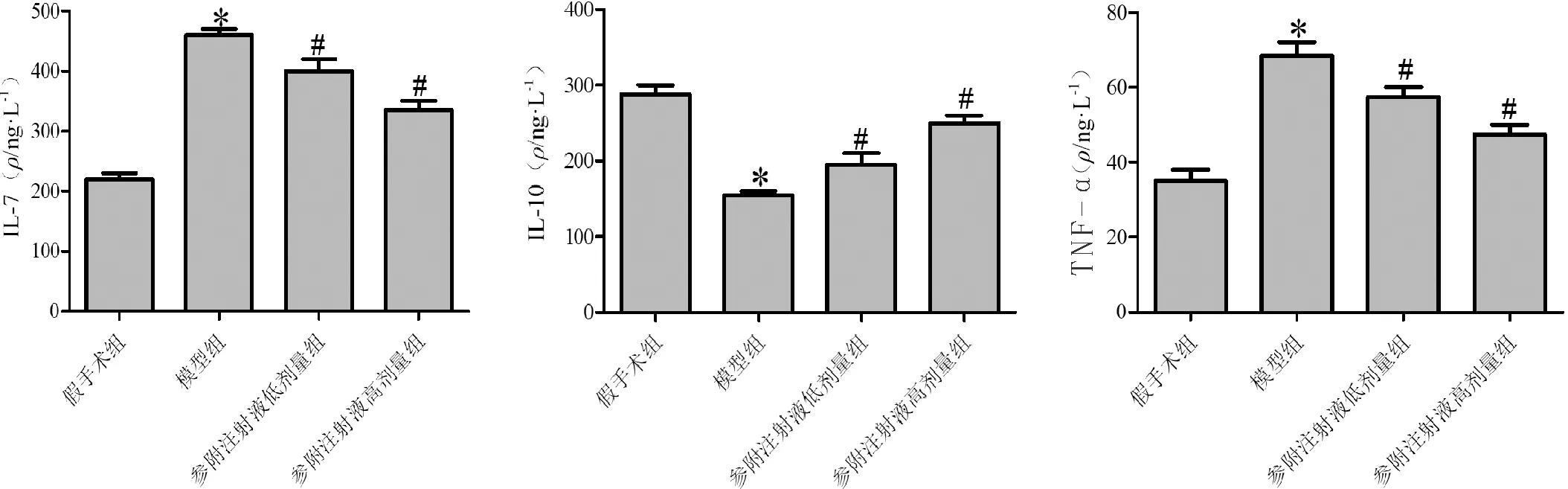
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05图5 检测各组小鼠血清中IL-17、IL-10和TNF-α水平
3.6 参附注射液对小鼠脾脏Notch1、Hes1蛋白表达的影响与假手术组比较,模型组小鼠脾脏Notch1、Hes1蛋白表达显著升高(P<0.05);与模型组比较,参附注射液低、高剂量组小鼠脾脏Notch1、Hes1蛋白表达显著降低(P<0.05),且高剂量组变化更明显。见图6。

注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05图6 Western blot检测各组小鼠胸脾脏组织中Notch1和Hes1蛋白的表达
4 讨论
脓毒症是一种与免疫抑制紧密相关的危及生命的器官功能障碍综合症。该病常见于外科术后、创伤以及免疫低下等,细菌引起的全身性严重感染,如不能有效的控制感染,可进一步演变为脓毒症休克或多器官衰竭综合症,导致患者失去生命[14-15]。脓毒症临床发病多以虚实夹杂或虚证为主,邪气耗气伤阴,失治误治又犯“虚虚实实”之弊。抗生素苦寒,往往伤阳或加重阳虚之势,甚者形成虚阳外越、阳气欲脱之势[16-18]。参附注射液是根据中医古方参附汤演化而来,参附汤是益气温阳、扶正固本的代表方,且在临床应用取得了良好的效果。有学者认为,脓毒症诱发的免疫抑制甚或免疫麻痹状态所产生的反应即是机体处于正虚无力抗邪的急性虚证状态,此期主要的病机为“邪毒炽盛,正气已虚”[19]。
免疫系统是包括器官、组织、细胞和效应分子的综合复杂系统,其中脾脏是关键的外周免疫器官,也是机体最大的淋巴器官,免疫器官的脏器指数是衡量免疫系统脏器是否受损的初步指标[20]。本研究中模型组小鼠脾脏指数显著低于假手术组,经过参附注射液治疗后,脾脏指数显著升高,说明参附注射液能够修复免疫系统脏器损伤。研究发现,参附注射液能够调节脓毒症小鼠的免疫系统,抑制炎性反应,减轻器官损伤[21]。T细胞是机体细胞免疫的主要效应细胞,主要介导机体对寄生病原体以及肿瘤细胞的清除[22]。研究表明,脓毒症应激过程中脾脏可受到不同程度的损伤,导致T淋巴细胞功能受限,出现免疫抑制[23]。Th17和Treg细胞属于CD4+T细胞亚群,二者在生理功能上相互制约,共同参与调节机体免疫反应[24]。当机体处于稳态时,T细胞趋于向Treg细胞方向分化;当发生炎症反应或感染时,免疫系统被激活,T细胞向Th17细胞分化,发生自身免疫性疾病[24]。Treg细胞与其他CD4+T细胞不同,是一类具有抑制炎症反应作用的细胞,可提高外周血Treg淋巴细胞的水平、减轻肾损伤[25]。严重脓毒症患者使用参附注射液后,能明显改善T细胞亚群,有助于维持免疫炎症调节功能的平衡[26]。
Th17/TregT细胞亚群对机体起免疫平衡调节作用,通过分泌IL-17、TNF-α、IL-10等细胞因子,抑制巨噬细胞、Th细胞释放促炎因子,从而抑制炎症反应[27]。本研究中模型组小鼠脾脏IL-10水平及Treg细胞百分比均显著低于假手术组,而 IL-17、TNF-α及Th17细胞百分比明显高于假手术组,提示脓毒症加剧了Th17和Treg细胞平衡向Th17转化,参与全身炎症反应,而参附注射液可能通过恢复脓毒症小鼠脾脏Th17/TregT细胞亚群介导的免疫平衡,达到治疗的目的。
Notch信号通路是T细胞分化、增殖和活化的重要通路,在多种免疫疾病中发挥重要作用。在成熟的免疫细胞表面均有Notch受体的表达,Notch是一种单次跨膜受体蛋白,通过细胞间相互作用可活化下游靶基因hes,影响T细胞的生理功能,特别是在Th17/Treg细胞分化中作用最为显著[28]。研究发现,肺炎小鼠Th17细胞百分比及Th17/Treg明显升高,同时Notch蛋白表达明显上调[29-31]。本研究结果显示,参附注射液低、高剂量组小鼠脾脏组织中Notch1、Hes1蛋白表达明显下调,表明参附注射液可能通过Notch信号通路调节Th17/Treg免疫平衡参与脓毒症的进展。
综上所述,参附注射液可以减轻脓毒症模型小鼠脾脏功能损伤,可能是通过Notch信号通路调节Th17/Treg免疫平衡,从而改善脓毒症的免疫抑制。

