心理因素、肠道菌群、环境与溃疡性结肠炎发病的关系分析
匡 琪 王爱祥 向 瑶
【提 要】 目的 研究焦虑和抑郁与溃疡性结肠炎(UC)患者发病的关系。方法 以2017年1月-2019年1月于我院治疗的活动期UC患者、缓解期UC患者以及同期入院的健康受试者作为研究对象,分别为活动期组(n=62)、缓解期组(n=56)和对照组(n=60),调查3组受试者的一般背景资料,精神状态(HAMA、HAMD评分),检测其免疫因子(5-HT、IL-2、IL-6、IL-8)和肠道代表性细菌数量,采用Pearson相关分析法分析HAMA、HAMD评分和免疫因子之间的关系,采用logistic回归分析法分析患者环境信息及肠道细菌因素与UC发病的关系。结果 活动期患者HAMA和HAMD评分高于缓解期和对照组受试者(P<0.05),其IL-6、IL-8水平也显著升高(P<0.05),患者HAMA、HAMD评分与IL-6和IL-8水平呈正相关,与IL-2水平呈负相关;肠道SB、EC、EMB、BL、LC的数量与UC的发病具有相关性;牛奶、吸烟和精神紧张因素也是UC发病的危险因素,其中牛奶和精神紧张会增加UC风险,吸烟可能是保护性因素。结论 焦虑、抑郁等精神心理因素通过神经递质5-羟色胺(5-HT)影响导致胃肠功能失调,人体免疫因子的分泌,加重炎症反应,人体肠道菌群紊乱、摄入牛奶也会增加UC发病风险,这对于阐述UC发病机制以及加强UC的防治工作具有重要的临床指导意义。
溃疡性结肠炎(ulcerative colitis,UC)隶属非特异性结肠炎的类型,是结肠炎重要的发病类型,也是我国常见的消化系统疾病。UC发病机制尚不明确,临床报道可能与遗传、外源性物质、机体免疫系统、环境等因素有关[1-3]。其中,肠道微生态变化对肠道疾病的影响较为显著,肠道优势菌群对于维持肠道微生态的稳定起着至关重要的作用[4];此外,心理因素,如焦虑、抑郁等心理状态对患者疾病的诱发、恶化、复发及活动度均有重要影响[5]。有研究显示,5-羟色胺(5-hydroxytryptamine,5-HT)[6]作为一种自体活性神经递质,不仅能使人体产生愉悦情绪,影响大脑调节情绪、精力和记忆力功能,还能通过影响神经-内分泌-免疫系统,改变人体免疫因子的合成和分泌,在UC等胃肠道疾病中显示出重要作用。UC患者因病情持续、迁延反复,生活长期无规律、情绪压抑,生理心理均产生较大负担,多合并焦虑抑郁情绪,对患者机体神经、体液分泌均造成严重影响。本研究探讨心理因素、肠道菌群、环境与UC患者发病的关系,拟为该类疾病的临床防治工作提供指导。
资料与方法
1.一般资料
选取2017年1月-2019年1月于我院治疗的118例UC患者为研究对象,所有患者年龄为22~69岁,平均年龄为(45.34±5.64)岁,其中男性65例,女性53例,病程为(11.25±3.12)月。将所有患者按病情分为活动期组(n=62)和缓解期组(n=56),以同期入院的健康受试者作为对照组(n=60)纳入研究。3组研究对象基本资料如表1所示,3组患者年龄、性别、婚姻状况、教育水平等一般资料方面差异无统计学意义(P>0.05)。受试者详细了解本研究方案,自愿签署知情同意书。此外,研究获得了医院伦理委员会的批准同意。
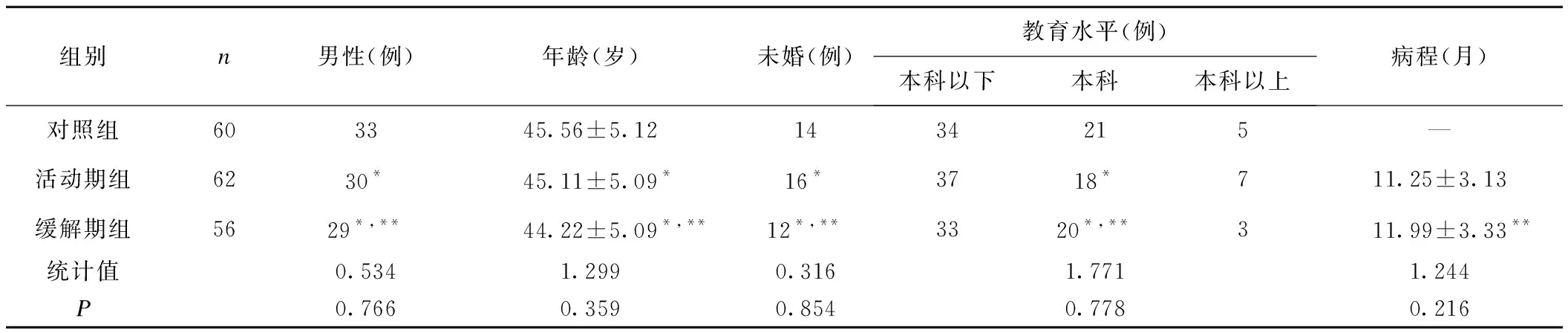
表1 3组研究对象基本资料
纳入标准:①患者符合炎症性肠病诊断与治疗指南[7]关于UC的诊断标准;②患者无抗生素、肠道细菌制剂治疗史;③患者病历资料完整;④健康受试者与UC患者组一般资料无显著性差异,具有可比性。
排除标准:①伴有严重心肝肾功能障碍、恶性肿瘤、凝血功能障碍、传染性疾病患者;②合并其他消化性系统疾病、其他自身免疫系统疾病患者;③有结肠Crohn病病史及特异性结肠炎患者;④精神异常或有神经性疾病、语言障碍,无法配合研究调查问卷的患者。
2.方法
(1)问卷调查
采用问卷调查的方式对所有研究对象进行调查,调查内容包括吸烟、饮酒、饮食(油腻、辛辣、牛奶摄入)等日常行为习惯,肠道感染史、过敏史、精神紧张等疾病史,口服避孕药、非甾体抗炎药、阑尾切除手术等治疗史。
(2)心理测评
采用汉密尔顿焦虑量表(Hamilton Anxiety Scale,HAMA)和汉密尔顿抑郁量表(Hamilton Depression Scale,HAMD)[8]对患者的焦虑和抑郁情绪进行评估,HAMA量表采用0~4分五级评分法进行评估,从0~4分分别为无症状、轻度、中度、重度、极重度,共包括14个项目,分为躯体性和精神性焦虑两类。量表总分信度系数为0.93,单项信度系数为0.83~1.00,效度系数为0.36(P<0.05)。HAMD量表同样采用0~4分5级评分制,共包括17个项目,量表总分信度系数为0.88~0.99(P<0.01),效度系数为0.92。
(3)临床指标观察
采用酶联免疫法对患者的细胞因子进行检测,包括5-HT、白细胞介素-6(interleukin-6,IL-6)、IL-2、IL-8。患者清晨空腹静息0.5h后,坐位,肘静脉取血5ml,样本以1000rpm的速度离心15min,取上清,冰箱-20℃保存,采用美国赛默飞世尔Multiskan FC全自动酶标仪进行含量检测。试剂盒均来自于abcam(上海)公司。
(4)细菌培养
无菌条件下收集研究对象5g新鲜的粪便,保存于厌氧罐中,进行菌群检测,其中厌氧菌包括拟杆菌(bacteroides,BD)、双歧杆菌(bifidobacterium lactis,BL)、真杆菌(eubacteriales,ES)、小梭菌(clostridium difficile,CD)、乳杆菌(lactobacillus,LC)、消化球菌(peptococcus,PS),需氧菌包括肠杆菌(enterobacterium,EMB)、酵母菌(saccharomyces boulardii,SB)、葡萄球菌(staphylococcus sp,SP)、肠球菌(enterococcus,EC),需氧及厌氧培养基均来自于Gibco公司。
3.统计学处理
结 果
1.HAMA、HAMD评分与UC的关系
3组研究对象HAMA、HAMD评分以及各项免疫指标如表2所示,活动期组HAMA和HAMD评分最高,5-HT、IL-6、IL-8水平最高,IL-2水平最低,数据资料具有统计学意义(P<0.05)。HAMA、HAMD评分与5-HT、IL-6、IL-8水平呈正相关关系,与IL-2水平呈负相关关系,如表3所示。

表2 3组研究对象HAMA、HAMD评分和免疫相关指标

表3 UC患者组HAMA、HAMD评分与免疫相关指标相关性分析
2.肠道菌群与UC的关系
3组研究对象肠道菌群分布如表4所示,活动期组BD、EC、BL、LC检出率明显高于对照组。logistic回归分析结果显示,SB、EC、EMB、BL、LC数量与UC发病具有相关性,见表5。
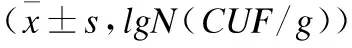
表4 3组研究对象肠道菌群检出率及数量比较
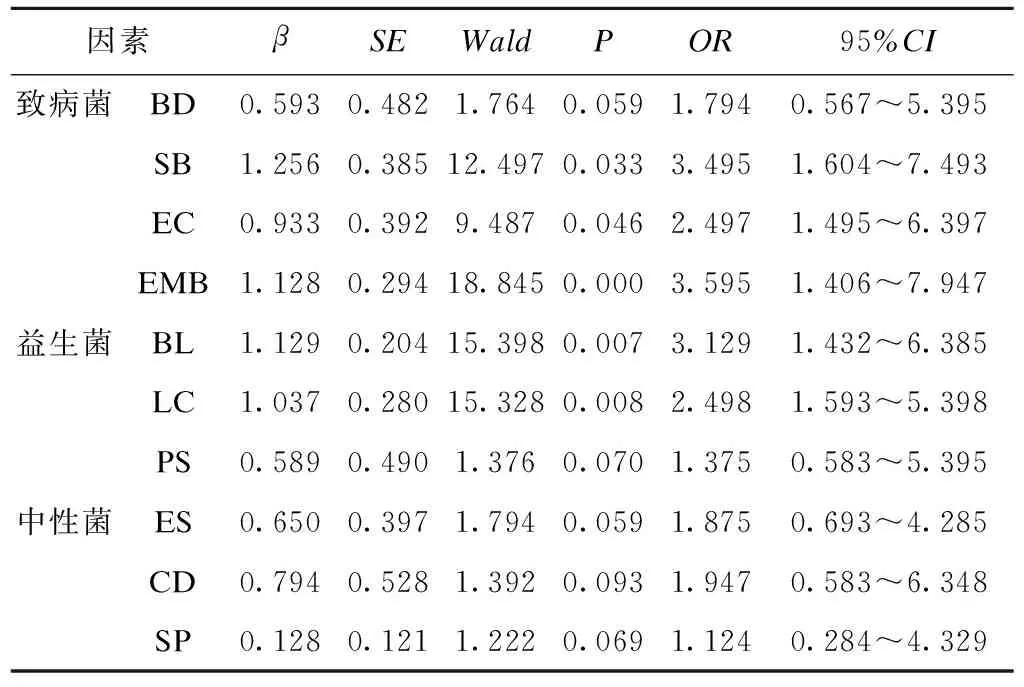
表5 与肠道菌群相关的影响UC发病的logistic回归分析
3.环境与UC的关系
受试者环境信息如表6所示,患者吸烟、饮酒、油腻饮食、牛奶摄入、感染史、精神紧张的例数具有统计学差异(P<0.05),logistic回归分析结果显示,牛奶、吸烟、精神紧张是影响UC发病的关键因素,见表7。
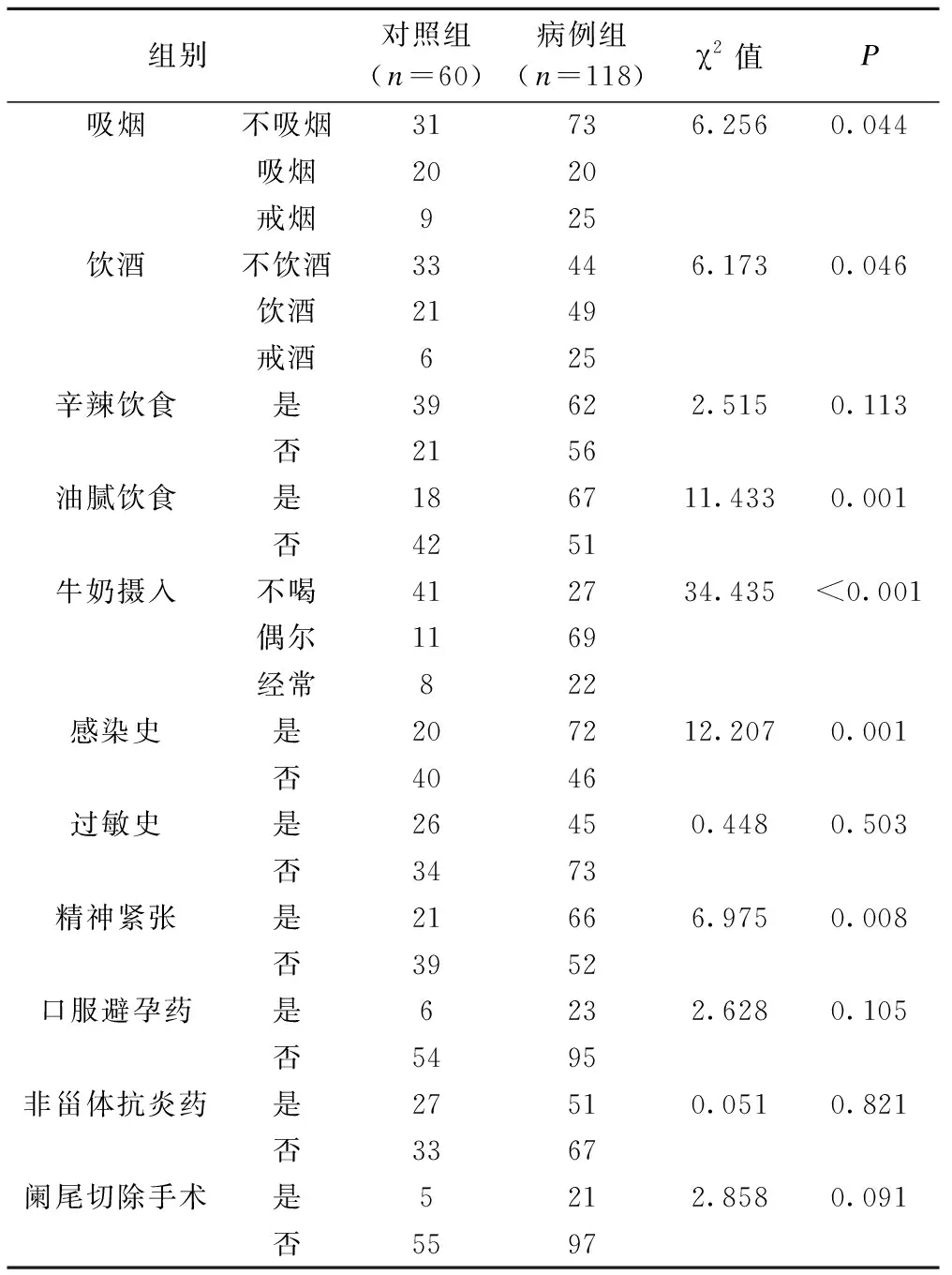
表6 影响UC发病的单因素分析

表7 影响UC发病的多因素logistic回归分析
讨 论
UC作为一种累及直肠和乙状结肠的非特异性炎症性肠病(inflammatory bowel disease,IBD),以腹痛、腹泻、粘液脓血便为主要症状[9-10]。肠道菌群作为人体消化系统的重要组成部分,与人体相辅相依,直接参与人体营养物质吸收和代谢过程。若肠道环境发生改变,肠道菌群结构失衡,致病菌数量增多,机体免疫力下降使肠道通透性增加,会造成局部炎症水平升高[11]。饮食、治疗史、疾病史等环境因素同样是影响患者生理病理状态的相关指标,不健康的饮食、加速身体产生有害物质,损害肠道黏膜细胞,加重胃肠道炎症反应,增加致病风险。国外研究报道称,精神心理因素与UC的发病也息息相关[12],负性精神刺激可通过影响脑-肠轴功能,降低内脏神经的敏感性,减慢胃肠动力,诱导全身及局部发生促炎反应。5-HT作为一种重要的脑肠肽,在该过程中发挥着重要作用,通过介导下游信号通路最终改变胃肠动力和内脏内分泌功能,提高神经敏感性。任天华等[13]报道了UC患者中,5-HT介导的信号通路多个环节发生改变,其释放量与UC疾病的活动度呈正相关的关系。本研究即分析了心理因素、肠道菌群、环境与UC发病的关系,确认其危险因素。
5-HT是一种单胺类脑肠肽,广泛分布于下丘脑神经元和胃肠道嗜铬细胞内,参与焦虑、抑郁等心理情绪和胃肠功能的调节过程[14]。5-HT还能促进炎症因子的富集,刺激免疫细胞分泌IL-2、IL-6、IFN-γ等免疫因子,从而影响患者肠道神经功能[15]。IL-2由Th1细胞分泌,能介导T细胞活化、增殖和分化过程,是免疫调节中重要的功能性因子之一,宋瑞花等[16]报道了IL-2通过调节CD4+Treg诱导小鼠发生IBD。IL-6则由巨噬细胞、B细胞、T细胞等多种免疫细胞分泌,介导UC炎症反应过程;IL-6水平升高时,肠道上皮细胞黏膜通透性增加,中性粒细胞浸润至炎症部位,参与疾病进展[17]。IL-8则来自于活化的单核细胞、淋巴细胞、内皮细胞等免疫细胞,利用免疫细胞的趋化作用激活中性粒细胞,增加溶酶体活性,提高吞噬功能。研究[18]报道了IL-8与炎性肠病之间的关系,具有肠道促炎作用。本研究结果显示UC病例组患者的HAMA和HAMD评分均高于健康受试者,其中活动期组患者最高,显示UC患者发生焦虑、抑郁的风险明显高于健康人群,且随着病情的加重而增加。免疫相关指标中,活动期患者5-HT、IL-6、IL-8水平最高,IL-2水平最低,经相关性分析发现,HAMA、HAMD评分与5-HT、IL-6、IL-8水平呈正相关,与IL-2水平呈负相关。该结果表明焦虑、抑郁等精神状态可能通过改变5-HT等递质的分泌,从而影响神经-内分泌-免疫系统和脑-肠轴系统,导致IL-2、IL-6、IL-8等免疫因子分泌功能的异常,参与UC的发病过程;而上述免疫因子亦可通过该网络系统反馈于5-HT,促进其分泌,加重患者焦虑和抑郁的程度[19]。因此,保持心情愉悦是降低UC发病率的重要手段。
UC患者肠道环境改变,微生态系统受到破坏,致病菌数量增加,机体免疫功能下降,肠道炎症反应加重。本研究结果显示,活动期组患者BD、EC、BL、LC检出率明显较高,细菌数量与UC发病logistic分析结果表明SB、EC、EMB、BL、LC数量与UC发病具有相关性,提示与健康受试者相比,UC患者体内具有肠道微生态体系失衡的现象,SB、EC、EMB菌群数量较高。研究的所有菌种中,BD、SB、EC、EMB属条件致病菌,在肠道遭受刺激时,其数量和功能发生改变,转化为感染菌,释放有害毒素损伤肠道上皮细胞,从而屏蔽上皮细胞的信号识别功能,甚至产生错误反应,促进免疫抑制蛋白分泌并作用于黏膜调节系统,加剧内毒素和抗原等物质的入侵,引起疾病。BL、LC、PS则属于益生菌,在肠道炎症反应中保护肠道黏膜,加强防御功能。因此,在UC发病时,SB、EC、EMB等条件致病菌数量增加,取代BL、LC等益生菌成为优势菌群时,致病风险升高。由此,监测人体肠道菌群状态,维持益生菌的优势地位,对于预防UC的发生具有重要意义。
本研究结果显示,牛奶、吸烟等因素以及精神紧张状态也是造成患者发病的独立危险因素。食物性的抗原是肠道非细菌性抗原的重要组成部分,与炎症因子、免疫因子一同作用调节炎症反应。牛奶是人体日常摄入的营养物质,部分UC患者的发病机制可能与机体不耐受牛奶中某些关键成分有关,其中含有的过氧化酯能造成肠道内环境紊乱,产生大量硫化氢、氨气等有害物质,损伤肠道粘膜。吸烟对UC患者的具体作用机制尚不清晰,但与不吸烟患者相比,少量吸烟患者UC发病风险降低,且随着吸烟量的增加呈负相关,其原因可能在于烟草中的尼古丁具有一定程度的抗炎作用,能减少促炎因子的释放,缓解炎症反应;另外,低剂量的CO功效与尼古丁类似,能上调抗炎因子,共同调解肠道粘膜糖蛋白的合成,使上皮细胞间的纤维连接更加紧密和牢固,从而降低表层的通透性,提高肠道的屏障功能。然而,吸烟对于肝肺肾、心脑血管的损伤是不可逆的,还具有致癌性,因此并不提倡通过吸烟来发挥胃肠道的保护功能。
虽然本研究的研究方案较为完整,并对质量进行了有效控制,但仍有一些不足之处,如选取的患者受地域和人文等因素的限制,与国内外相关研究报道仍存在差异,如本研究未显示出肠道感染、过敏史等疾病史和治疗史与UC发病的关联性,说明不同地区不同人群UC发病的影响因素可能不同[20-21]。另外,研究的样本量有限,不能准确详实的反映出不良情绪与免疫因子之间的具体关系,需要扩大样本量开展进一步研究,以提供更精确的数据支持。
综上所述,焦虑、抑郁等负面情绪通过间接影响人体免疫因子的分泌,从而增加UC的发病风险。此外,患者肠道微环境紊乱,导致SB、EC、EMB等条件致病菌数量增加,部分患者摄入牛奶,均会加重机体炎症反应,提高UC发病率,而吸烟可能是保护性因素。探究UC发病的危险因素,开展针对性预防措施,这对于UC机制研究以及临床疾病的防治具有重要指导意义。

