抗生素与重金属复合污染废水处理的研究进展
徐舟影, 孟发科, 吕意超, 班宜辉, 刘建军, 曾海波
1.武汉理工大学土木工程与建筑学院, 湖北 武汉 430070
2.武汉理工大学化学化工与生命科学学院, 湖北 武汉 430070
3.中国电建集团华东勘测设计研究院有限公司, 浙江 杭州 311122
4.中国水利水电第五工程局有限公司, 四川 成都 610066
随着城市化进程的不断发展,实际水体中的污染物种类大幅增加,抗生素和重金属作为典型的污染物可以通过多种途径先后或同时进入水生环境,从而导致水体抗生素和重金属复合污染[1-4]. 复合污染通常是指同一环境介质(水、土壤、大气)中,两种或两种以上种类不同、性质不同的污染物共同存在且相互作用或反应,从而引发的污染[5]. 相比单一污染,复合污染更加接近实际情况,值得深入研究. 由于畜牧业和水产养殖业的发展,抗生素和重金属常同时作为生长促进剂添加到动物饲料中,而这两种物质很难被消化吸收,往往会通过动物尿液和粪便排放到水环境中,其中四环素和磺酰胺类抗生素以及Cu和Zn是最常见的类型[6-10]. 将动物粪便用于土地施肥以及医药、工业废水的集中化处理等做法也会导致地表水或地下水中的抗生素和重金属复合污染[11-12]. 目前,全球许多国家的水体中均检测到抗生素和重金属(见表1),因此,水体抗生素和重金属的复合污染现象普遍存在,且二者在水环境中具有一定的稳定性[25].
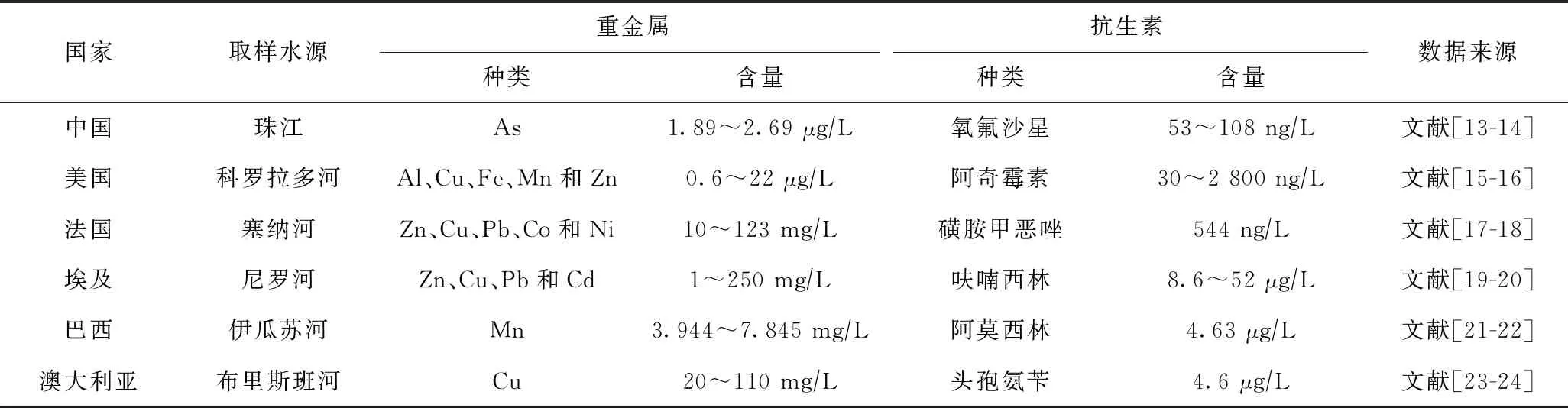
表1 不同国家水体中抗生素和重金属种类及含量
对于水中抗生素和重金属复合污染的控制和处理,当前面临重大挑战. 一方面,两种类型的污染物具有不同的环境行为. 水环境中的抗生素会影响微生物群落结构和生态功能,短时间作用下抗生素有杀菌抑菌作用,导致部分微生物种群及其生态功能消失,长期作用下会导致耐药菌的形成[26]. 而重金属因其具有持久毒性、不可生物降解性和生物富集性,也被认为是有害的环境污染物[27]. 此外,水体中的抗生素和重金属能够诱导细菌产生抗生素抗性基因(ARGs)和重金属抗性基因(MRGs),细菌充当抗性基因的载体,随食物链不断迁移最终威胁人类健康[28]. 另一方面,抗生素与重金属的理化性质存在显著差异,有研究[29]表明二者的相互作用会形成结构和毒性可变的络合物,这使得抗生素和重金属的复合污染废水比单一污染废水的处理更有难度. 尽管水中抗生素和重金属复合污染的处理比较复杂,但是近年来许多技术方法已经被证实对此类污染的治理有一定的效果,如吸附、絮凝、膜分离、高级氧化和生物修复等[30-34],然而,目前尚缺乏作用机理、技术优缺点及应用潜力等方面的类比和分析. 基于此,该文综述了抗生素和重金属相互作用的机理,讨论了抗生素和重金属复合污染废水的处理方法及其作用机制,并比较了它们的优缺点. 此外,笔者还对未来该领域亟待开展的研究方向进行了探讨并作出展望,以期为今后相关技术应用于抗生素和重金属复合污染水体的治理提供思路和参考.
1 抗生素和重金属相互作用机理
当抗生素与重金属在水体中共存时,它们可能分别以有机物分子和重金属离子形态独立存在,互不影响〔见图1(A)〕,也可能在某些条件下发生络合反应形成抗生素-金属离子络合物〔见图1(D)〕. 抗生素官能团的种类、重金属离子的类型和溶液pH是影响络合物形成的3个最主要因素[35].
许多抗生素,如广泛使用的喹诺酮类和四环素类抗生素都含有羧基、羰基或哌嗪基,它们能充当潜在的电子供体来配位重金属[36],而磺胺类抗生素官能团种类和数量均较少,主要是含氮官能团参与配位[37]. 虽然四环素类抗生素官能团众多,理论上易与重金属离子发生络合反应,然而过多数量的官能团可能会带来空间位阻作用,使络合能力降低[38]. 有研究[39]表明,四环素类抗生素易与重金属络合的原因在于良好的电子跃迁、重金属离子的离子半径和螯合环的稳定性.
重金属离子的类型也会影响抗生素和重金属二者的络合作用. 有研究[40]表明,重金属离子所带的电荷数越高,与抗生素络合的可能性越大. K+等一价重金属离子基本无法与抗生素络合,Cu2+与Fe3+具有较强的络合能力,但二者与抗生素的络合效果相当. 重金属离子与抗生素络合的本质是重金属离子与抗生素官能团原子共用电子,因此,重金属离子的电负性(对电子的吸引能力)越强,络合作用越显著.
此外,溶液pH能够通过静电作用力影响抗生素与重金属的络合. 由于带有易离子化基团羧基、羟基和氨基等,抗生素在不同的pH条件下会解离为不同的形态[41],中性或碱性条件下,抗生素可解离为阴离子,倾向于与带正电的重金属离子发生络合.
除了抗生素和重金属之间可发生络合作用外,重金属离子之间可通过架桥(如EDTA、有机酸和重金属捕集剂等)发生络合反应〔见图1(C)〕,抗生素之间也能形成络合物. 有研究[42]发现,两性离子态的中性喹诺酮类抗生素能够形成简单的络合物〔见图1(B)〕,喹诺酮类抗生素也可以作为桥联配体形成多核络合物. 抗生素与重金属在水体中的络合情况复杂多变,二者相对数量也能从一定程度上影响络合物的形成,重金属离子的存在会改变水体中原有离子态物质与络合物的比例,进而影响抗生素的去除率.

图1 抗生素与重金属水中共存的作用机理
2 抗生素与重金属复合污染废水的处理技术
2.1 吸附
吸附法是当前应用最多的处理抗生素与重金属复合污染废水的一种方法. 研究表明,吸附剂对于重金属离子的作用机制包括静电相互作用、共沉淀与内层配位、表面络合、化学沉淀、离子交换与物理吸附等[43],而对于抗生素的作用机理主要为静电吸引、氢键与π-π键相互作用[44]. 然而,与抗生素或重金属单一污染吸附相比,复合污染的吸附机理有所不同. 重金属离子可与抗生素中的各种官能团相互作用,从而产生了不同的抗生素-重金属络合物,并改变了吸附剂的吸附行为. 重金属离子对吸附剂吸附抗生素的影响一直存在争议,但都存在合理的理论解释. 一方面,重金属离子可以通过静电吸引、盐析效应(如溶液中Na+浓度增加会降低抗生素水溶性,增强其疏水性,从而导致更多的抗生素向吸附剂表面扩散)或阳离子桥联作用增加吸附剂对抗生素的表面吸附;另一方面,金属离子也能通过竞争或者外层配位(中心重金属离子的外层电子与吸附剂的配位络合)减少吸附剂对抗生素的吸附. 不同的机制并不互斥,它们可以共同影响吸附剂对抗生素吸附效果[45]. 迄今为止,已有多种吸附剂用于处理抗生素和重金属复合污染废水,如生物炭、黏土、壳聚糖、石墨烯和蛭石等[46-50]. 其中,生物炭因其比表面积较大,吸附亲和力强和生态友好等特点,被广泛应用于抗生素与重金属复合污染废水的处理中. 此外,可以通过多种修饰方法对吸附剂表面改性,如添加氧化剂、酸、碱或者金属等来增强其吸附能力[51-54].
吸附法的优点是吸附剂材料来源广泛,成本低,操作简单,吸附能力强,对多种抗生素和金属均有去除效果. 然而,它也存在一定的固有局限性,如吸附材料难以再生,所适用的pH范围有限以及无法真正将污染物质降解等. 未来的研究方向应着力于开发和优化实用高效的吸附材料,并解决其回收再利用的问题.
2.2 絮凝
与吸附不同,絮凝指在某些高分子絮凝剂存在下,基于架桥作用,使胶粒形成较大絮凝团的过程. 研究发现,絮凝剂对重金属的絮凝作用强于抗生素[55],原因在于重金属通常是强电子受体,当絮凝剂主链上存在巯基、羧基和膦酸基等强电子供体时,重金属将在絮凝过程中被去除,而抗生素由于其复杂的结构或可变的理化特性而无法通过絮凝作用轻易去除[56]. 当利用絮凝剂来处理抗生素和重金属复合污染水体时,基于“软硬酸碱”理论和空间效应,重金属离子可以在特定条件下“桥接”絮凝剂与抗生素,形成三元络合物从而达到协同去除污染物的目的[12]. Jia等[31]合成了一种具有芳香官能团的壳聚糖基絮凝剂(BDAT-CTS),用于同时处理溶液中的四环素和Cu2+,结果表明,Cu2+通过电荷吸引与配位作用被BDAT-CTS絮凝,而该絮凝剂中带正电荷的三嗪环与四环素中带负电荷的芳香环通过π-π堆叠作用使得四环素被絮凝.
絮凝是一种操作简便、成本低、效益高的技术,已被广泛用于污水处理. 当使用基于生物质的絮凝剂时,还具有环保的优点[57]. 然而,在处理抗生素与重金属复合污染废水时,传统絮凝剂无法凝聚电荷易变的复合污染物,因此,可以基于絮凝剂与金属离子和抗生素的共同适配性对絮凝剂进行改性处理,从而实现对抗生素与重金属复合污染废水的高效净化.
2.3 膜分离
膜分离技术是利用选择性分离功能的膜材料来实现溶液中不同组分分离纯化的过程. 因其具有绿色节能的优点,膜分离技术目前已被广泛应用于近零排放、无有害添加剂的领域[58]. 该技术是根据污染物颗粒大小、溶液浓度、pH和施加压力来分离污染物,被认为是从污染源中分离污染物的关键技术之一[59]. 目前,膜分离技术主要有三类模式,即双重截留模式、截留吸附模式和双重吸附模式,这三类模式均可同时去除废水中的有机污染物和重金属离子[60]. 传统膜材料分为陶瓷膜和聚合物分离膜两种类型,由于陶瓷膜具有疏水性和更好的化学稳定性,更加适用于工业废水的处理[61]. Zhao等[62]将青霉素酶共价固定在溴甲基聚合物超滤膜上,实现了青霉素污染废水的快速高效处理. Shukla等[63]合成了一种羧化氧化石墨烯-聚苯砜纳滤膜,用于去除废水中的砷、铬、镉、铅和锌5种重金属离子,去除率约为80%. Du等[64]在过氧单硫酸盐辅助原位氧化技术与混凝工艺的基础上结合陶瓷膜,同时去除了地下水中的Fe2+、Mn2+和磺胺二甲嘧啶. 但是,由于渗透选择性与渗透通量相互制约,传统陶瓷膜难以实现污染物的高效分离,而具有多孔网络结构的新型材料——金属有机骨架(MOFs)成为了可供选择的膜材料. MOFs由金属离子(或离子簇)与有机配体通过化学键合作用连接而成,将MOFs引入高分子聚合物制备出MOFs/高分子聚合膜,抗生素分子在膜表面被吸附,重金属离子与骨架上的金属通过离子交换而去除[65-66].
膜分离技术具有工艺简单、功能选择性强及能耗低等优点,且在应用中易与其他技术相结合. 然而,在膜过滤过程中,吸附在膜表面的抗生素分子易导致膜结垢从而影响分离效率,而且即使抗生素解吸后,膜也无法完全被回收利用. 因此,新颖高效、可重复使用的膜材料的开发是提高膜分离效率的重要途径.
2.4 光催化
随着环境日益恶化,资源不断耗竭,太阳能等可再生资源的利用备受关注. 近年来,光催化氧化成为处理复合污染废水的主要研究方向之一. 光催化反应速率主要取决于光催化剂和光能. 光催化剂是具有电子结构的半导体材料,在光辐射下刺激生成的光致空穴和光生电子能够参与抗生素与重金属的氧化还原反应[67]. 光催化可以破坏溶液中已经生成的络合物并释放出重金属离子,抗生素分子被空穴氧化降解,金属离子得到电子被还原. 在抗生素与重金属复合污染废水的处理过程中,常用的光催化剂主要包括二氧化钛、氧化锌和氧化石墨烯等[68-70]. 此外,研究表明,两种不同的半导体材料复合形成的异质结(两种不同的半导体相接触所形成的界面区域)可以有效提高废水中的抗生素和重金属的去除率,如Wan等[71]合成了Z型纳米复合材料四氧化三钴/银/钨酸铋异质结,实现了盐酸四环素(TCH)和Cr6+的同时去除,异质结在Cr6+与TCH共存体系下对污染物的去除率比单一体系分别高出6.86倍(Cr6+)和2.58倍(TCH);He等[72]利用聚邻苯二胺-钴铁氧体对废水中的四环素进行光催化降解并同时还原了Cu2+,从而证实两种光催化剂具有协同作用.
光催化技术的广泛应用是基于它能够在环境温度和大气压条件下实现有机配体的完全矿化,同时产生低毒的副产物[73]. 光催化是一种高效、快速的污染物处理技术,既经济又没有二次污染的影响,是处理抗生素-重金属复合污染废水较为理想的技术手段. 然而,光催化过程中电子和空穴容易复合,影响了光催化剂的实际使用效果. 因此,未来可通过对光催化剂改性或其他修饰方法来增强光催化系统的有效性和对污染物的去除能力.
2.5 零价铁基
近年来,零价铁(ZVI)去除废水重金属和有机污染物的能力引起了广泛关注. 然而,由于钝化和表面活性降低,ZVI在水中的反应性降低,因此需要对ZVI改进来提高其反应效率[74]. 纳米尺度零价铁(nZVI)通过增加比表面积来增强活性,有研究者提出使用nZVI作为活化剂可以消除有机物的官能团,能够降低有机物毒性,提高生物降解性[75]. Li等[76]的研究证实,nZVI能够快速同时去除多种重金属(如Cu、Zn、Ni和As等). 因此,nZVI在抗生素和重金属的联合去除方面具有广阔的应用前景,然而,目前将nZVI直接用于抗生素与重金属复合污染废水处理的研究较少,一般是将nZVI与其他金属或者材料复合使用. 如褚蓉洁[77]利用nZVI-Cu双金属活化过硫酸盐去除重金属Cr6+的过程主要是通过吸附还原共沉淀的方式完成,而对盐酸四环素的去除是通过联合协同作用;Shao等[78]采用液相还原法合成了小麦秸秆负载的nZVI复合材料用于去除金霉素和Cu2+,研究发现,在抗生素和重金属二元污染系统中,低浓度的Cu2+(Cu2+<10 mg/L)对金霉素的去除具有协同作用,高浓度的Cu2+则表现为竞争抑制.
零价铁基技术运行成本低且反应时间短,在抗生素和重金属复合污染废水的处理中具有很高的应用价值[79]. 然而,利用该技术处理水体污染物的研究大多数是在受控模式下进行的,而实际水环境中存在复杂的基质干扰和意外干扰(如可能的微生物副产物或化学抑制作用). 因此,ZVI的实际应用效果可能会受环境因素的限制和影响,将ZVI改性或者与不同的物理、化学或生物方法相结合去除复合污染废水是未来ZVI技术研究的重点.
2.6 人工湿地
人工湿地是经过设计和构建的工程系统,可以模拟自然湿地中发生的生物、化学和物理过程来去除污染物,能在更可控的环境中去除水中的污染物[80]. 已有研究[81-82]表明,人工湿地可以去除废水中存在的多种单一类型的污染物,包括抗生素和重金属. 抗生素在人工湿地中可能的降解机制包括在黑暗中的水解、光照过程中的光降解、基质的吸附、植物吸收以及根际微生物的降解[83]. 不同类型的植物对特定的抗生素具有抗药性和降解性,如湿地植物短叶茳芏(Cyperusmalaccensisvar.brevifolius)和水生黍(Panicumpaludosum)能够耐受一定浓度的磺胺嘧啶污染[84];芥菜(Brassicajuncea)对废水中四环素的降解率可达到71%[85]. 微生物对不同类型的抗生素也有不同的降解方式,其主要通过氧化、水解、官能团转移和取代、裂解和羟基化/双羟基化作用降解抗生素[86]. 人工湿地处理重金属的机制主要为湿地基质对重金属的吸附以及植物根系分泌某些代谢产物改变重金属价态,并转运重金属离子至地上部分积累再通过收获而去除,湿地微生物可通过胞外吸附、胞内积累以及氧化还原或甲基化等作用转化重金属[87].
然而,实际环境水体的抗生素和重金属复合污染现象更为普遍,并且抗生素和重金属的相互作用也不容忽视. Sayen等[88]研究发现,溶液中Cu2+的存在能够增强芦苇(Phragmitesaustralis)吸收恩诺沙星,而恩诺沙星却抑制了芦苇对Cu2+的积累. 此外,Almeida等[89]发现,在处理抗生素和重金属复合污染废水时,湿地中同时存在恩诺沙星和头孢噻呋会改变植物对Cu2+的吸收机制,从而延长处理周期,影响其去除率. 抗生素和重金属共存可能会抑制酶和微生物活性,并且可能对水生植物产生负面影响,同时会促进抗生素和重金属交叉抗性基因的进化[90]. Li等[91]开展了人工湿地耦合微生物燃料电池对抗生素和重金属复合污染废水的净化研究,发现在初始阶段Zn胁迫增加目标ARGs的丰度,而随着时间延长,过多的Zn积累降低了ARGs的丰度. 此外,有研究表明可以通过曝气或对湿地植物接种真菌等手段来强化人工湿地对抗生素或重金属的净化能力,如Chen等[92]研究发现,可以利用人工湿地预曝气的方式去除水中11种常见的抗生素,抗生素的总去除率为87.4%~95.3%;Xu等[93]通过将丛枝菌根真菌(AMF)接种至湿地植物芦苇根际形成芦苇-AMF共生体系,接种AMF后的人工湿地对Cd和Zn的去除率分别达到了95.56%和86.88%. AMF通过提高抗氧化酶(超氧化物歧化酶和过氧化物酶)活性,减少脂质过氧化物(丙二醛和活性氧自由基)积累,从而增强湿地植物对重金属胁迫的耐受性[94]. 另外,Cao等[95]研究发现,AMF可在土壤中降解差向土霉素,其为土霉素(OTC)的主要降解产物,由此途径AMF间接加速了OTC的降解. 据此可以推测,强化型人工湿地对于净化抗生素和重金属复合污染废水甚至是ARGs污染具有潜在的研究价值.
与常规的水处理技术相比,人工湿地具有操作简便、投入量少、运营成本低等优点,并且植物和微生物协同净化废水的模式没有二次污染,环境影响小[96]. 但是,利用人工湿地净化废水的速率较慢,且植物和微生物对毒性化学物质较为敏感[97]. 另外,人工湿地净化抗生素和重金属复合污染废水的研究较少,复合污染下的处理效果及稳定性尚不明确. 因此,在今后的研究中应重点关注抗生素和重金属在人工湿地系统中的环境行为和迁移分布规律,并探明人工湿地净化二者复合污染的作用机制,与此同时,应充分考虑水中抗生素与重金属相互作用,选择合适的湿地植物,并联合其他处理技术以提高污染物的去除率.
综上,已有研究者在实验室采取以上技术针对抗生素和重金属复合污染废水进行了处理. 不同处理技术的特点及去除率如表2所示.
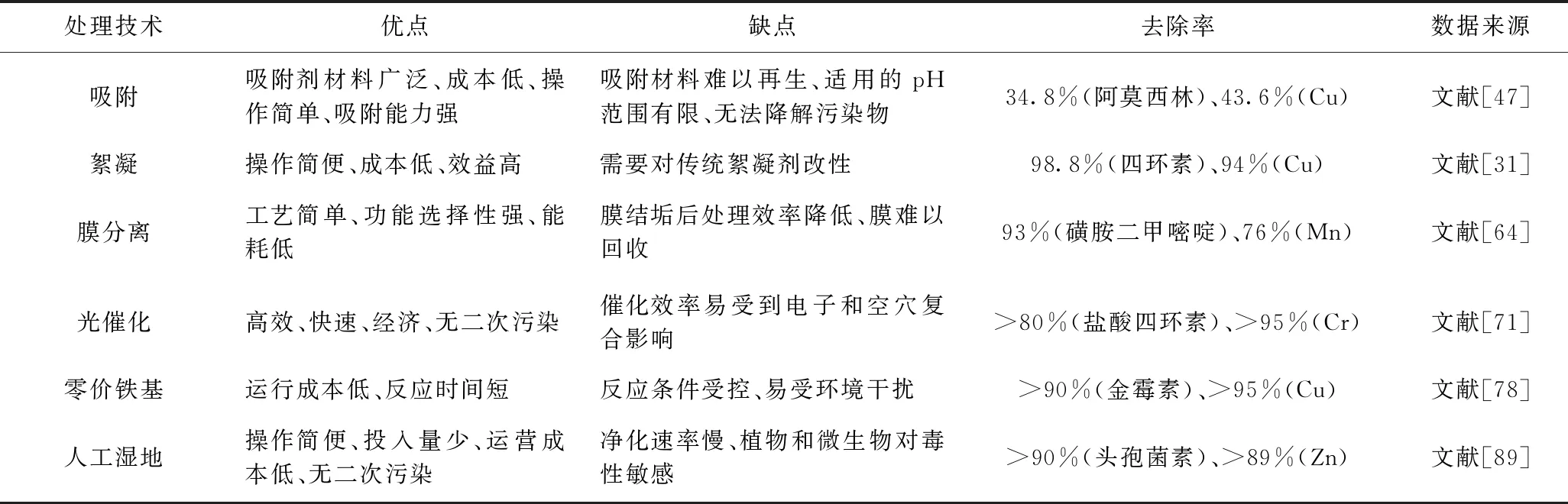
表2 不同处理技术的特点及去除率
3 结论与展望
a) 抗生素和重金属在水环境中能够相互作用,其络合物的形成主要受到抗生素官能团的种类、重金属离子的类型和溶液pH的影响. 由于络合物的结构复杂,毒性可变,目前鲜有研究报道水中抗生素和重金属络合物的去除技术. 鉴于当前处理技术对抗生素和重金属已有较高的去除率,未来还应进一步开展针对络合物去除技术的研究,挖掘不同技术对抗生素和重金属复合污染去除的综合潜力,全方面提高去除效率,达到改善抗生素和重金属复合污染水体的目的.
b) 当前对抗生素与重金属复合污染废水的净化技术主要包括吸附、絮凝、膜分离、光催化、零价铁基和人工湿地等. 其中,吸附法是当前应用最多的一种方法,光催化和人工湿地技术由于处理成本低及环境友好的特点而具备广阔的发展前景,而絮凝剂和零价铁基的改性能提高去除效率. 对于抗生素和重金属复合污染水体的治理,目前面临的挑战是节能、资源回收以及开发更有效可控和环保的水处理技术. 为了更好地利用不同技术对抗生素和重金属复合污染水体的净化机制,寻求经济高效的技术组合实现对污染物的协同处理值得深入研究.
c) 环境水体中重金属和抗生素复杂多样,相互作用会对水生环境产生影响,目前研究都是在实验室可控条件下进行的,今后应关注各种处理技术在实际环境水体中的应用效果,综合评估复合污染的环境影响. 由于环境水体中抗生素的浓度很低,一般以ng计,对水体抗生素的快速精准检测在技术上还比较困难,国外目前也没有任何国家或机构将抗生素纳入环境监测指标,当前我国只针对含高浓度抗生素废水的制药行业发布了《发酵类制药工业水污染物排放标准》(GB 21903—2008). 但抗生素的环境影响是长期的,因此仍需开发快速有效的水体抗生素检测技术,制订水体抗生素排放标准的相关法规,并对新污染物ARGs和MRGs的生成机理及其影响因素开展进一步研究,以期为有效处理抗生素和重金属复合污染废水提供科学依据.

