海水青鳉摄食微塑料的荧光和C-14同位素法示踪定量研究
田莉莉, 文少白, 马旖旎, 季 荣
1.南京大学环境学院, 江苏 南京 210023
2.江苏省农业科学院农业资源与环境研究所, 江苏 南京 210014
3.海南医学院热带医学与检验医学院, 海南 海口 571199
微塑料(小于5 mm)作为环境中一种无处不在的污染物引起国内外广泛关注,2015年的联合国环境大会上,已经将海洋微塑料污染列为与全球气候变化、臭氧耗竭等并列的重大环境问题[1-3]. 近年来,微塑料在多种环境介质中被检出[4],如表层海水[5]、近海河口海岸[6]、沉积物[7-8]和海洋生物[9-10]等. 微塑料可能通过物理毒害、化学毒性或载体作用等多种方式危害生态系统健康[11]. 海洋微塑料的生物效应研究发现,高浓度的PVC(聚氯乙烯,polyvinyl chloride)微塑料会影响海洋浮游藻类的光合作用[12],PS(聚苯乙烯,polystyrene)微塑料会影响多种浮游动物和太平洋牡蛎的摄食效率[13-14]. 微塑料还会影响蚤状钩虾的生长[15],造成蓝贻贝细胞和组织产生一定的损伤[16],影响牡蛎的能量分配和繁殖[17],影响斑马鱼肝脏的脂质和能量代谢[18]等. 微塑料对海洋生物产生毒性的原因与其进入生物体以及在体内如何分布有一定相关性,因此全面地了解海洋生物对微塑料的摄入和排出过程对其毒性评估具有重要意义.
一般大尺寸塑料在水环境中的存在状态与其密度和形状直接相关,但是当塑料颗粒达到微米尺度时,由于自身性质和环境因素的影响,微塑料的存在状态会发生不同变化,如团聚、降解、迁移、沉降等行为. 环境中微塑料发生降解的关键因素是太阳光中紫外线的照射[19],微塑料表面接触到光的面积和能量会对其光降解产生一定影响[20]. 微塑料在环境中自身团聚或与环境中其他颗粒物发生异质团聚的行为造成微塑料发生沉降[21],微塑料被微生物附着后表面形成生物膜,导致自身浮力发生改变,使漂浮在水面或者悬浮在水中的微塑料向更深水层纵向迁移[22],微塑料被海洋生物摄食后可能在体内停留或随着粪便排出体外[10,13,23],微塑料的环境行为受到其赋存状态的影响,但目前海洋生物摄入和排出的过程对微塑料在环境中赋存状态的影响尚不清楚.
已有研究报道了海洋鱼体中微塑料的检出[24-25],但目前海洋鱼类对微塑料的摄入和排出的定量研究仍比较缺乏. 荧光标记法是实验室研究微塑料最常用的方法,荧光显微镜可以直接观察微塑料在生物体内的分布,如Pitt等[26]研究了斑马鱼对微塑料的摄食及其在斑马鱼体内的分布;Lee等[27]研究了斑马鱼胚胎对微塑料的富集;Cong等[28]通过荧光显微镜下计数研究了海水青鳉(marine medaka,Oryziasmelastigma)对微塑料的富集,并对颗粒浓度进行了分析. 当微塑料粒径较小时,在显微镜下无法实现计数,以颗粒浓度定量就不再适用. 荧光分光光度计可以实现质量浓度的检测,将生物组织消解处理后通过荧光信号的强度对生物体内的微塑料进行定量[29],然而荧光标记的检测限较高,当生物基质中存在荧光信号时研究结果会受到一定的影响. 因此,当微塑料含量较低或粒径较小时需要检测灵敏且易于排除背景干扰的方法. C-14同位素示踪技术具有灵敏度高、定量准确、检测方便等优点,在获得C-14标记微塑料的基础上可以用来定量研究微塑料在生物体内的富集与分布[30].
为了研究海洋中微塑料与海洋生物的相互影响,定量海洋生物对微塑料的摄入和排出,该研究以荧光法和C-14同位素法为基础,研究海洋生物对微塑料的摄食过程. 海水青鳉是一种具有个体小、世代周期短、产卵率高等特点的海洋模式生物,被广泛应用于海洋鱼类的毒性效应研究中[31]. 因此以海水青鳉为受试生物,选取荧光标记的PS微塑料和C-14标记的PS微塑料,使用不同方式定量研究微塑料在海水青鳉不同成长阶段的摄入情况,观察并定量研究微塑料在海水青鳉不同部位的分布特征,同时研究海水青鳉摄食行为对微塑料状态的影响,以期全面地了解海洋中微塑料与生物的相互作用,为海洋微塑料的环境风险评价提供理论支撑.
1 材料与方法
1.1 试验材料
氯化钠(NaCl)、十二烷基磺酸钠(SDS)和乙二胺四乙酸二钠(EDTA-2Na)均购自南京化学试剂股份有限公司;Tris-HCl(1 mol/L,南京建成生物工程研究所);蛋白酶K(>30 U/mg,上海麦克林生化有限公司);天然海盐购自天津中盐技术研究所;闪烁液购自英国Meridian生物科技有限公司;荧光PS微塑料(粒径0.5 μm)购自美国Thermo Fisher公司;C-14标记的PS微塑料(粒径为0.3~0.5 μm,放射性比活度为 2 300 Bq/mg)为笔者所在课题组实验室合成[20].
1.2海水青鳉培养
海水青鳉种源来自国家海洋监测中心,在笔者所在课题组实验室驯化培养3年以上,试验所用海水青鳉为繁殖三代后获得,仔鱼为1月龄,体长为(0.88±0.18) cm,成鱼为3月龄,体长为(1.9±0.2) cm. 试验前海水青鳉喂养于循环养殖系统(Z-A-S4,上海海圣生物实验设备有限公司),所用海水为天然海盐和纯水配制而成的人工海水,海水盐度为30‰,pH为8.2~8.4,培养温度为26~28 ℃,光照周期为光照14 h、黑暗10 h. 培养期间,仔鱼每日早晚各喂鱼食一次,成鱼每日早晚各喂食孵化24 h卤虫幼体一次,中午均喂鱼食一次. 喂食结束后,及时清理残留鱼食及粪便以免污染水质.
1.3 海水青鳉摄入微塑料的定量研究
1.3.1荧光标记法
试验开始前将海水青鳉从养殖系统转移至烧杯,不喂食情况下清肠48 h. 添加荧光PS微塑料到400 mL人工海水中,为了更好地进行摄食机制探究,该试验将PS微塑料浓度设置为50 mg/L,超声分散均匀. 分别设置摄食组和分布组,每组烧杯中加入4条海水青鳉成鱼,试验在光照培养箱(GZX-300BS-Ⅲ,上海新苗实验设备有限公司)中进行,温度设定为27 ℃,光照周期为光照14 h、黑暗10 h. 摄食组于培养24 h后取样,成鱼整体称重后消解,测定摄入总量;分布组于培养24 h后取一半成鱼解剖测定,另一半成鱼放入干净海水中进行排出试验,在排出72 h后取样测定,解剖分离鱼鳃、肠道和鱼体三部分,先通过荧光倒置显微镜(Eclipse Ti-S,尼康仪器上海有限公司)观察各部分荧光信号,观察结束后再分别消解测定不同部分荧光信号强度,并根据标准曲线计算PS微塑料含量.
1.3.2C-14同位素法
由于仔鱼带有荧光背景,会对信号检测造成干扰,因此试验又采用C-14标记PS微塑料开展. 选取大小一致的仔鱼,清肠48 h后待用. 设置低浓度组(5 mg/L)和高浓度组(50 mg/L),均添加C-14标记PS微塑料(分别为1.2、12 mg)于240 mL海水中,超声分散30 min. 每个处理组中均加入仔鱼12条,分别在24、48和72 h取样测定. 试验是在光照培养箱中进行,温度27 ℃,光照周期为光照14 h、黑暗10 h. 取样时用一次性吸管随机将仔鱼吸出,转移至干净海水中,清洗体表可能的残留,清洗3次后,将仔鱼放入闪烁管中称重,消解并测定其放射性量.
1.3.3生物体消解方法
试验采用蛋白酶消解法,参照Jiang等[32]研究方法并进行一定改进,试验证明酶解过程对生物体内荧光微塑料的信号无影响. 配置混合消解液的步骤:计算配制1 L消解液所需各物质的量,称取相应固体物质加入到1 L容量瓶,再加入1 mol/L Tris-HCl 250 mL,并加水定容至1 L,超声20 min使物质充分溶解,即得混合消解液,其具体成分如表1所示.

表1 混合消解液成分表
成鱼解剖后的不同组织分装入离心管,鱼鳃和肠道加入1 mL混合消解液,剩余鱼体部分加入5 mL混合消解液,仔鱼直接放入离心管,加入1 mL混合消解液,然后将离心管放在50 ℃恒温水浴锅中加热15 min,再加入蛋白酶K(0.5~3)mg,升温至60 ℃,继续消解24 h. 消解结束后,取200 μL组织消解液加入到96孔板中,以不含生物组织的消解液作为空白,荧光酶标仪(Synergy H4, 美国Biotek有限公司)测定不同样品中的荧光信号强度.
1.4 微塑料的赋存形态
为了观察微塑料被生物摄食后在环境中赋存形态的改变,选取荧光PS微塑料喂食海水青鳉成鱼,并记录摄食过程. PS微塑料试验浓度为50 mg/L,超声20 min至PS微塑料在水中完全分散,加入4条成鱼,培养过程中不喂食. 培养24 h,培养期间观察并拍照记录,培养结束后,取鱼的粪便通过荧光倒置显微镜观察,另取少量粪便低温烘干,固定于导电胶后喷金45 s,通过扫描电子显微镜(Quanta 250 FEG,美国FEI有限公司)观察PS微塑料的形貌变化,工作电压设定为10 kV,灯丝电流为171 μA.
1.5 检测方法
C-14放射性量检测:使用液体闪烁计数仪LSC(LS6500,美国Beckman有限公司)测定样品中放射性含量. 液体样品1 mL与3 mL闪烁液充分混合后测定;生物样品需经过消解后,将消解液与闪烁液以体积比为1∶3的比例混合均匀后测定.
荧光含量检测:首先配制浓度为 1 000 mg/L的荧光PS微塑料储备液,超声分散30 min,梯度稀释到浓度分别为2、5、10、20、100 mg/L,取200 μL加入到96孔板中,每个浓度5个平行,以纯水作为空白,使用荧光酶标仪测定不同浓度荧光微塑料的荧光信号强度,所得荧光强度扣除背景信号后,根据PS浓度和荧光信号强度绘制标准曲线. 样品中荧光微塑料的信号扣除背景信号后,根据标准曲线即可计算得到生物体内不同组织中微塑料的含量.
1.6 数据处理
数据以平均值±标准偏差(SD)形式表示,不同数据之间显著性差异分析通过SPSS 18.0软件进行One-way ANOVA分析,P<0.05即视为具有显著性差异,且采用GraphPad Prism 5软件绘图.
2 结果与讨论
2.1 海水青鳉摄入微塑料的定量研究
根据荧光PS微塑料的荧光信号强度与标准溶液浓度绘制标准曲线(见图1),R2为0.999,线性较好. 测定消解液的荧光信号后根据标准曲线定量消解液中的微塑料含量,结果如图2所示. 由图2可见,当PS微塑料浓度为50 mg/L时,海水青鳉成鱼在24 h 内摄食PS微塑料含量为(246.8±38.1)mg/g(以鱼湿质量计),显著(P<0.05)高于同样暴露时间的仔鱼摄食量〔(4.32±0.77)mg/g,以鱼湿质量计〕. 这表明海水青鳉成鱼具有更高的微塑料摄食能力.
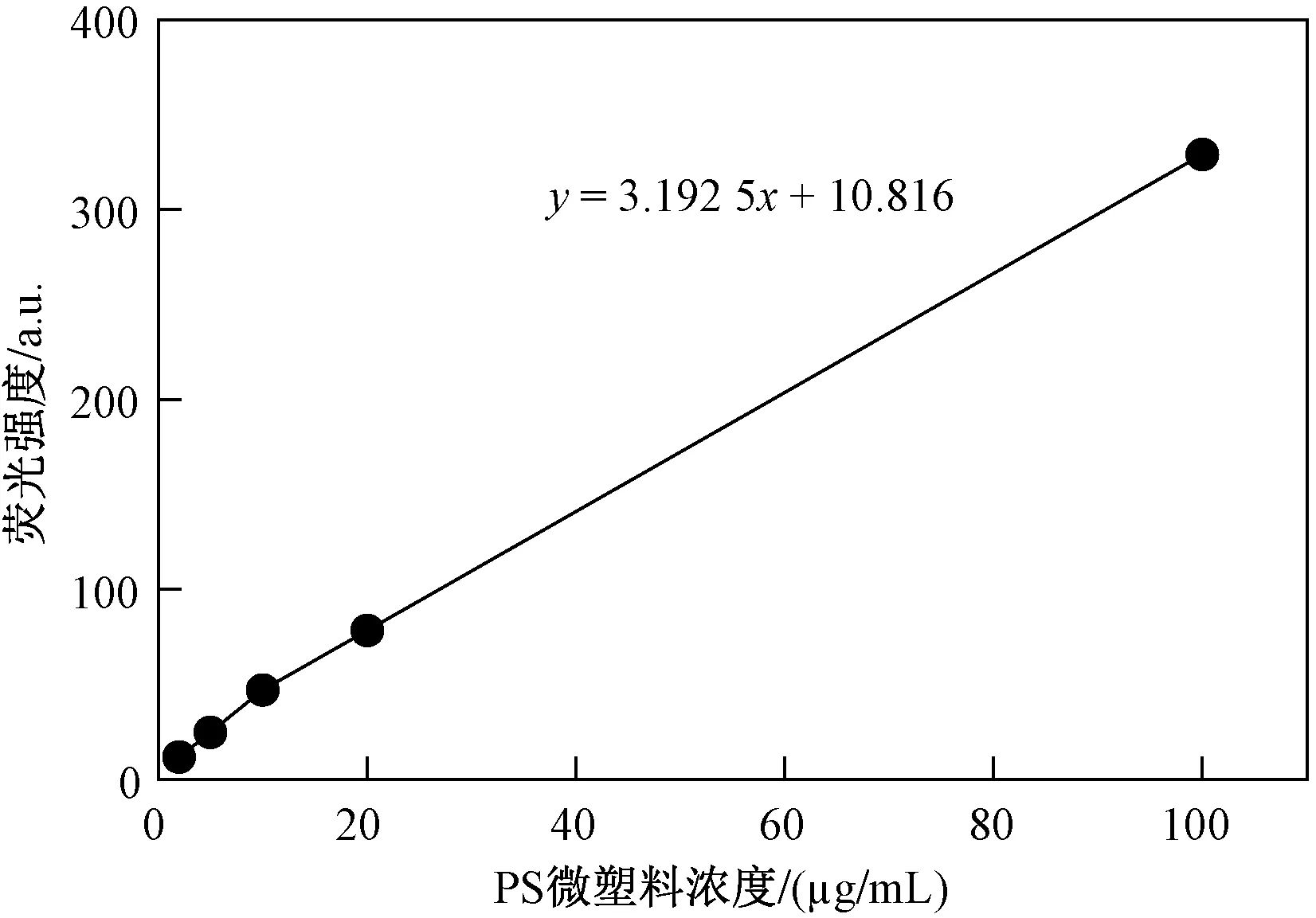
图1 PS微塑料浓度与荧光强度的标准曲线

注: 不同字母表示数据之间具有显著性差异(P<0.05).
从海水青鳉仔鱼摄食动力学结果(见图3)可以看出,在不同浓度处理组中仔鱼都摄食了一定量C-14标记PS微塑料,均是24 h摄入量较高,其中5 mg/L处理组PS微塑料最高含量为(1.49±1.18)mg/g(以鱼湿质量计). 随着培养时间的增加,PS微塑料含量先降后升,说明青鳉仔鱼对PS微塑料的摄食是一个动态过程. 这与Cong等[28]研究结论一致,其通过荧光显微镜的观察发现青鳉仔鱼24 h摄食PS微塑料(10 μm)含量最高,但并未对摄入量进行定量. 由于目前常用的微塑料定量方法是在荧光显微镜下观察计数微塑料的颗粒数,但对于粒径较小的微塑料,在样品处理过程中可能会造成信号泄露或显微镜下计数困难[32],因此小粒径微塑料的定量数据目前报道较少. 该研究采用较为温和的酶消解方式处理生物样品,避免了因荧光信号泄漏对试验结果的影响,通过制备得到C-14标记PS微塑料,利用C-14信号实现小粒径微塑料在低浓度下的质量浓度检测,以该实验室制备所得C-14标记PS微塑料的最大比活度(8.0×104Bq/mg)来计算,最低检测限可达2.5 μg/L,若能够使用更高放射性比活度的C-14标记微塑料,可进一步降低检测限. 由此说明C-14同位素法是检测低浓度小粒径微塑料的有效方法.
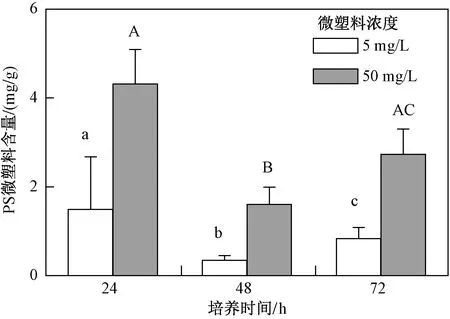
注: 不同小写字母或大写字母表示数据之间具有显著性差异(P<0.05).
2.2 荧光标记法示踪微塑料在海水青鳉体内的分布特征
Al-Sid-Cheikh等[30]采用C-14标记的纳米级PS微塑料在扇贝(Pectenmaximus)体内的摄入、分布和排出情况,结果表明试验所用的PS微塑料(24和250 nm)可以被扇贝快速摄入,粒径越小摄入越多,而排出14 d后,粒径较小的PS微塑料(24 nm)已经检测不到,但是粒径较大的PS微塑料(250 nm)排出28 d后仍有检出,说明粒径会影响微塑料的摄入和排出. 因此,小粒径微塑料在海洋鱼类中的摄入和排出仍值得关注.
海水青鳉成鱼摄食PS微塑料24 h后,解剖分离鱼鳃、肠道和鱼体部分,荧光显微镜观察结果(见图4)显示,海水青鳉摄食的PS微塑料鱼鳃中有少量检出〔见图4(a)〕,肠道内有大量检出〔见图4(b)〕,鱼体表皮〔见图4(c)〕未观察到明显荧光信号,这说明鱼体表皮对PS微塑料吸附作用可能较小. 这与已有研究[18,23,28]中发现消化道是鱼富集微塑料的主要部位一致. Cong等[28]研究中将海水青鳉暴露于10 μm PS微塑料,发现肠道中富集PS微塑料最多,但并未在其他部分检测到PS微塑料的存在. 该研究在鱼鳃中也检测到了PS微塑料,这可能与该研究中所用PS微塑料的粒径(0.5 μm)较小有关,PS微塑料可能随着鱼的呼吸进入鱼鳃,并被鱼鳃截留. Lu等[18]研究中同样发现,5 μm PS微塑料可以进入斑马鱼的鱼鳃. 排出72 h后,通过荧光显微镜观察肠道、鱼鳃和鱼体部分,结果发现,鱼鳃〔见图4(d)〕中PS微塑料已经完全排出,肠道〔见图4(e)〕中微塑料仍有部分停留在肠道末端,这可能是由于排出阶段未喂食,造成微塑料在肠道内的滞留. Cong等[28]研究中也有类似发现,在不喂食情况下,微塑料排出缓慢,喂食会加速微塑料的排出.

图4 荧光显微镜下观察海水青鳉摄入和排出后PS微塑料在鱼鳃、肠道和鱼体中的分布情况
将显微镜观察后的海水青鳉不同组织进行消解并定量检测,根据2.1节中的标准曲线进行定量,结果(见图5)发现,摄食24 h后,PS微塑料在海水青鳉肠道内含量为(246.6±38.1)mg/g(以鱼湿质量计),占总摄入量的99.9%,而鱼鳃(占0.07%)和体表(占0.03%)含量较少. 经过72 h排出后,肠道内剩余PS微塑料的含量为(1.29±0.52)mg/g. 表明PS微塑料主要通过摄食活动进入鱼体,并在肠道内大量富集,随后PS微塑料随粪便缓慢排出,但被海水青鳉成鱼排出之后的PS微塑料是否会重新悬浮到水中或重新进入生物体有待开展更深入的研究.
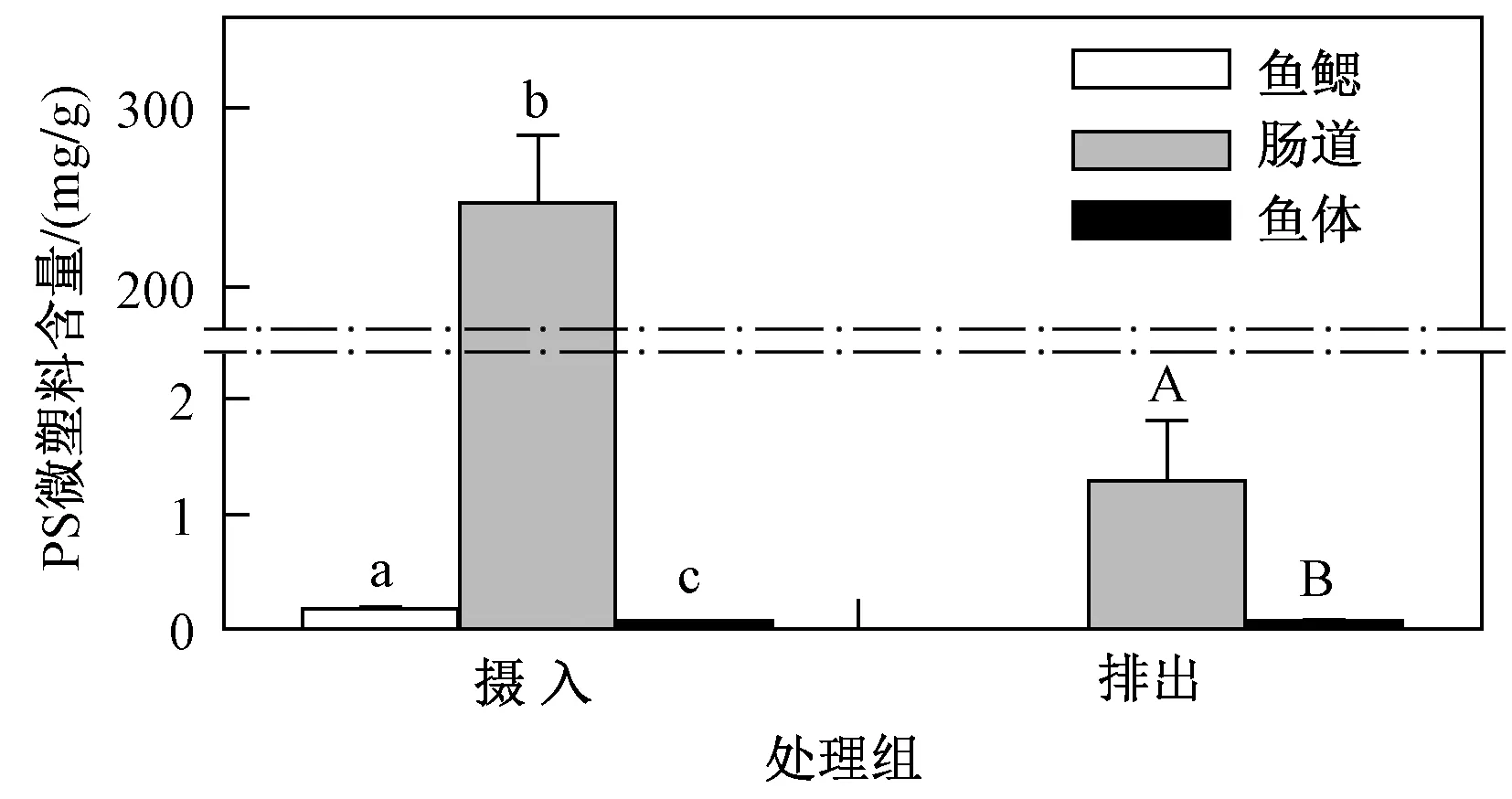
注: 不同小写字母或大写字母表示数据之间具有显著性差异(P<0.05).
2.3 海水青鳉摄食对微塑料赋存形态的影响
生物摄食活动对微塑料环境行为的影响目前研究较少,该研究结果(见图6)发现,初始加入时PS微塑料颗粒在海水中呈分散状态〔见图6(a)〕,但经过海水青鳉摄食,大部分PS微塑料变成粪便沉到水底〔见图6(b)〕,说明生物摄食会改变PS微塑料在海水环境中的存在状态. 选取一粒粪便通过荧光显微镜观察,结果〔见图6(c)〕发现粪便中有较强荧光信号,通过扫描电镜放大观察粪便内部,结果〔见图6(d)〕显示,PS微塑料以颗粒形式汇聚在粪便中,形貌无显著变化,表明海水青鳉摄食可以改变PS微塑料的存在状态但对其形貌无显著影响. 由于密度的差异,微塑料在环境中存在状态不同,密度较轻的微塑料一般会漂浮在水面或悬浮于水中,而经过生物摄食后会使漂浮的微塑料团聚而变重,发生沉降. Katija等[33]研究也发现巨型海鞘能够通过摄食微塑料将其转化为粪便包裹物,加速了微塑料从海水表层向深层的转移,因此海洋微塑料的监测应该考虑对不同水层深度的采样,以免造成微塑料含量的低估. 有研究发现PE(聚乙烯,polyethylene)微塑料经过南极虾消化系统后可以破碎产生纳米塑料[34],说明生物摄食行为可能增加环境中产生纳米塑料的风险. 海水青鳉不断摄食其周围环境中悬浮态微塑料,将其转化为粪便排出体外,但不会再次摄食以粪便形式存在的微塑料,因此海水青鳉的摄食是一种将悬浮分散的微塑料不断转化为团聚沉降的过程,这可能会影响微塑料的生物可利用性,但是否增加腐食性生物或底栖生物的暴露风险值得进一步探究.

图6 微塑料在海水青鳉成鱼摄食前后的状态以及粪便的荧光信号表征和扫描电镜形貌表征
3 结论
a) 该研究针对生物体内小粒径微塑料定量示踪的技术难题,提出荧光法和C-14同位素法,并对比了两种方法在检测限、灵敏度和定性定量等方面的差异. 对比发现荧光法可以直观观察微塑料,在研究生物体内的分布及高浓度暴露时的荧光定量方面较为适用,而C-14同位素法因具有更低的检测限和高的灵敏度,在复杂介质中进行低浓度暴露时的定量检测更具优势.
b) 利用两种示踪技术研究海水青鳉成鱼和仔鱼对微塑料的摄食动力学和体内分布发现:成鱼和仔鱼摄入微塑料的量随着培养时间而变化,均在24 h摄入较多微塑料,且成鱼比仔鱼具有更高的摄食能力;微塑料在海水青鳉的肠道分布极多,远大于鱼鳃与体表,表明摄食是微塑料进入海水青鳉的主要途径,且在不喂食情况下排出72 h后,肠道内仍残留相当一部分微塑料无法排出.
c) 值得注意的是,虽然鱼类摄食微塑料后很难真正进入内循环系统,但其摄入、消化、排出过程在很大程度上改变了微塑料尤其是小粒径微塑料的环境赋存形态. 海水青鳉通过对水中悬浮状态微塑料的摄入,将海水中的微塑料由初始悬浮分散态变成粪便团聚体沉入水底,摄食行为对微塑料形貌虽无显著影响,但可能会对微塑料的环境过程和生态效应产生未知影响.

