“红阳”猕猴桃果实低温贮藏期糖代谢分析
贾德翠,卜范文,蒋娟琼,涂洪强,彭书明,陈 环,马幸幸,王元顺
(1. 湘西自治州农业科学研究院,湖南 吉首 416000;2. 湖南省园艺研究所,湖南 长沙 410125;3. 吉首市乡村振兴局,湖南 吉首 416000)
猕猴桃(Actinidia chinensis)也称奇异果,是一种多年生的藤本植物[1],果实清香味美、甘甜可口,富有丰富维生素C、可溶性纤维、多种微量元素和矿物质元素等[2-3],具有较高的食用价值和一定的保健效果,尤其是在降血压血脂、降胆固醇、生津润燥、美容养颜、安神益智等方面具有较好的作用[4-5],素来备受广大消费者的喜爱[6]。我国是猕猴桃的原产国,种植面积和产量稳居世界第一,是我国农业发展的主要果树之一[7]。但果实不耐贮藏影响了其产业的健康稳定发展,尤其是中华系列的红肉猕猴桃耐贮性效果更差,因此探讨果实软化的机理具有重要的意义[8]。据相关研究表明果实硬度的下降与多糖分解酶的活性及相关酶基因的表达有关,罗静等[9]研究猕猴桃常温贮藏时发现,各个果胶酶基因在2~8 d 时间段会出现高峰值,一周后果实快速软化,另外果实经乙烯诱导后果胶酶基因的表达会有很大程度的提高,导致果实硬度提前快速降低。陈景丹等[10]测定了常温贮藏不同时间段猕猴桃淀粉酶基因的表达,同样发现各淀粉酶基因在2~8 d 时间段会出现高峰值,一周后果实快速软化,当果实采用1-MCP 处理后果实淀粉酶基因表达量会有所降低,果实硬度下降会有所延缓。贾德翠等[11]对猕猴桃进行低温贮藏,发现猕猴桃果胶酶和淀粉酶等多糖分解酶的活性在30 d 左右会出现峰值,在50 d 左右酶活性开始快速降低,当果实采用肉桂提取物处理后可较大程度降低酶活性,延缓果实的软化。目前有关猕猴桃贮藏期硬度方面的研究主要集中在常温条件下某一种基因表达对其硬度的影响,或相关多糖分解酶活性变化对其硬度的影响,而对于猕猴桃采后低温贮藏成熟期间,果实硬度与相应酶基因表达和酶活性之间的关系的研究还未曾报道。为此,笔者以不耐贮藏的红阳猕猴桃为试验材料,探索果实在低温条件下软化的主要机理,以期为进一步阐明猕猴桃采后多糖分解酶基因表达及其酶活性与果实成熟软化进程之间的关系提供理论依据。
1 材料与方法
1.1 试验材料
以六年生至八年生红阳猕猴桃植株的果实为试材,果实于2019 年9 月中旬采自湖南永顺猕猴桃基地。18:00—19:00 采摘,采摘后立刻放入经冰袋预冷的泡沫箱中,连夜运回实验室在温度(4±1)℃、空气相对湿度90%的条件下冷藏。
1.2 试验方法
1.2.1 贮藏期间果实生理指标测定挑选果实大小均一、无机械损伤、无病虫害及成熟度一致的果实进行有机酸(酸碱滴定法测定[12])、还原糖(硫酸苯酚显色法测定[13])、可溶性固形物(手持可固分析仪测定)和果实硬度(GY-3 果实硬度计)的测定,每15 d 测定一次,每次测定分别随机取5~8 个果实果肉混匀,每次测定3 个重复。
1.2.2 贮藏期间果实多糖分解酶活性测定纤维素酶、β-1,3 葡聚糖酶活性采用试剂盒(索莱宝生物科技有限公司)测定,淀粉酶活性、果胶酶(PG)活性参考曾邹林等[14]的方法测定。每15 d 测定一次,每次测定分别随机取5~8 个果实果肉混匀,每次测定3 个重复。
1.2.3 实时荧光定量PCR分析采用Trizol 试剂盒提取猕猴桃果实的RNA。RNA 逆转录成cDNA,然后以cDNA 为模板进行PCR 扩增,引物序列如表1 所示,由上海生工生物工程技术服务有限公司合成。反应体系:1 μL 上游引物(10 nmol/L),1 μL 下游引物(10 nmol/L),10 μL SYBR Green qPCR SuperMix,1 μL模板,灭菌后的双重蒸馏水补充至20 μL。反应条件:95℃条件下预变性10 min;95℃条件下变性10 s,60℃条件下退火30 s,72℃延伸15 s,循环40 次。以Actin作为内参,参照陈义挺等[15]的方法,采用相对定量2-ΔΔCt 分析法(CT 值比较法)计算样品中各基因的相对表达量。

表1 引物序列
1.3 数据处理
采用SPSS 16.0 软件对数据进行主成分分析,采用Origin 2019 软件进行制图,采用Statistix 8.0 统计软件进行统计学分析,所有指标数据均采用平均值±标准差(mean±SD)表示,并用最小显著极差法(LSD)对数据进行显著性差异检验。
2 结果与分析
2.1 贮藏过程中猕猴桃果实生理指标的变化
由图1 可知,随着贮藏期的延长,果实硬度和可滴定酸值逐渐下降。贮藏45 d 时,硬度由初始的15.03 kg/cm2下降到9.36 kg/cm2,此时果实已经较为软化;可滴定酸由初始的1.52%下降到0.76%。而果实还原糖及可溶性固形物的含量随着贮藏期的延长呈逐渐增加的趋势,果实刚采摘时可溶性固形物和还原糖含量均较低,分别仅有6.8%和4.3%,当果实贮藏45 d 时可溶性固形物和还原糖含量分别高达16.8%和9.9%,此时果实的糖酸比和固酸比分别达到了22.11和13.05,果实口感已有较大的提升。另外,从图1中还可以看出,贮藏前后4 个指标的差异均达极显著水平(P<0.01)
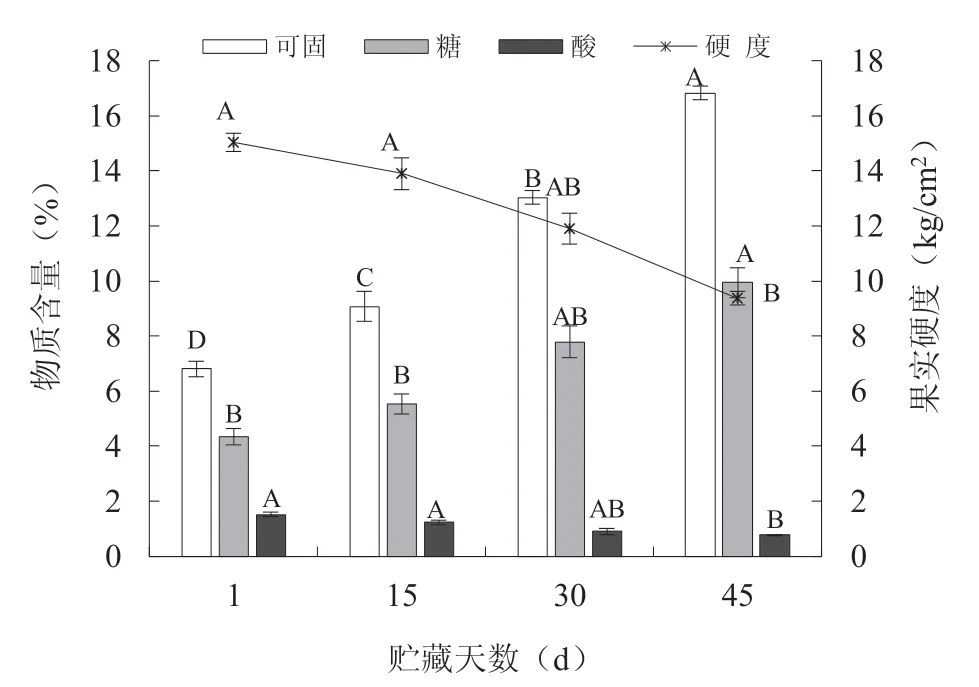
图1 不同贮藏时期果实的生理指标
2.2 贮藏过程中猕猴桃果实多糖酶活性的变化
由图2 可知,4 种多糖分解酶活性均表现出了“较高—高—低”的变化趋势,且贮藏45 d 后酶活性均低于刚采摘时。果胶酶和葡聚糖酶活性在贮藏30 d 时出现了最大值,分别达到了8.09 mg/(min·g)和26.01 U/g,在贮藏45 d 时便急剧下降,分别仅为4.86 mg/(min·g)和7.88 U/g。淀粉酶和纤维素酶活性贮藏15 d 时出现了最大值,分别达到了1.06 mg/(min·g)和114.32 U/g,同样贮藏45 d 时便急剧下降,分别仅为0.63 mg/(min·g)和36.74 U/g.4 种酶活性的峰值与贮藏45 d 时的数值均有极显著差异。这体现了果实贮藏过程中多糖分解酶活性由初始的较高到后来的高再到最后急剧下降的变化规律。
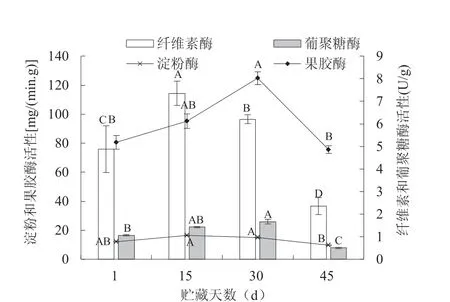
图2 不同贮藏时期果实的多糖酶活性
2.3 贮藏过程中猕猴桃果实多糖酶基因表达的变化
由图3 可知,4 种多糖分解酶基因在贮藏15~30 d 时均表现出了较高的表达量。例如果胶酶基因Achn305411 和Achn293521 在贮藏30 d 时相对表达量分别高达1.77 和2.89,但贮藏45 d 时果胶酶基因的表达量急剧下降,仅在0.1~0.2 之间;淀粉酶基因Achn072001 和Achn273151 在贮藏15 d 时相对表达量分别高达2.44 和1.66 贮藏30 d 时表达量略微降低,但贮藏45 d 时则下降明显,仅有0.3~0.5 之间;与淀粉酶基因一样,纤维素酶基因Achn189731和Achn294591 在贮藏15 d 时相对表达量分别高达3.71 和2.33,贮藏30 d 时表达量略微降低,贮藏45 d 时下降明显,仅有0.2~0.4 之间;葡聚糖酶基因Achn058881 和Achn171941 在贮藏30 d 时相对表达量分别高达2.57 和4.62,贮藏45 d 时下降明显,仅有0.2~0.5 之间。总体上各个基因在贮藏15~30 d 时表达量较初始阶段有较大程度地提高(P<0.01),但贮藏至45 d 时便急剧下降(P<0.01),说明此时果实已经开始进入快速衰老期,这与前文提到的果实中各种酶活性的变化趋势基本一致。
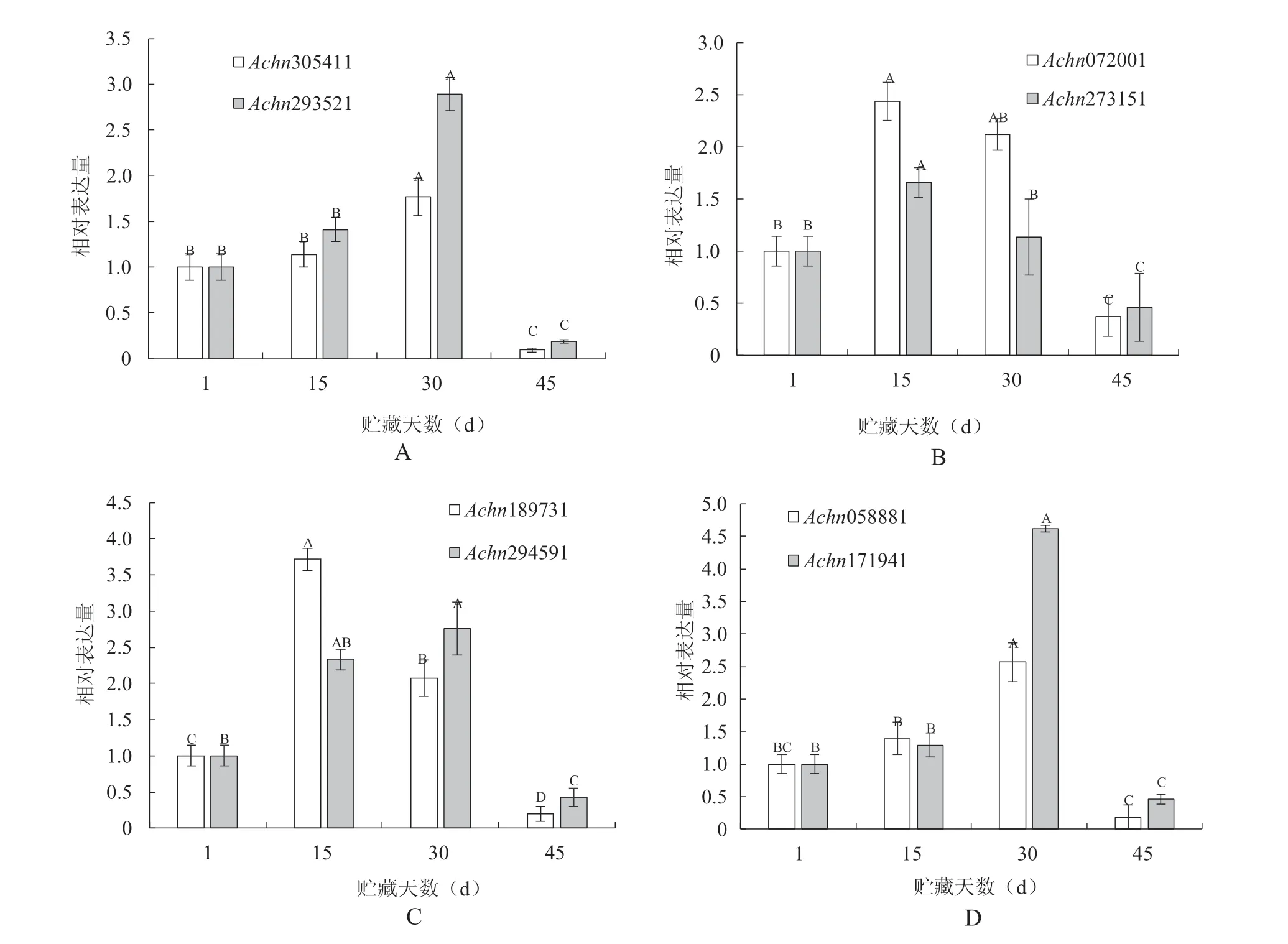
图3 不同贮藏时期果实多糖分解酶基因的相对表达量
2.4 贮藏过程中猕猴桃果实糖代谢指标主成分分析
2.4.1 主成分个数确定由表2 可知,10 个糖代谢指标共得到2 个主成分,主成分1 特征值为7.07,贡献率为70.70%;主成分2 特征值为2.69,贡献率为26.96%。2 个主成分的累积贡献率为97.66%,已经包含了原有10 个指标的全部信息。第1 主成分主要凸显指标由“高—低”的变化趋势,在相应成分矩阵中可溶性固形物、还原糖、固酸比、糖酸比为负值,在主成分分析图(图4)的左侧,说明它们与第一主成分的相关性非常小,因为它们主要凸显指标由“低—高—低”的变化趋势。第2 主成分主要凸显理化指标由“较高—高—低”以及“低—高—低”的变化趋势,其中4 个酶是较大的正值,说明它们于第2 成分相关性非常大,可滴定酸和硬度是负值,在主成分分析图(图4)的下侧,说明它们与第2 成分相关性非常小。图4 中A 的位置表示,果实刚采摘时与第一主成分正相关,与第二在主成分负相关,B/C/D 以此类推,这与表3 中f1、f2值的正负关系一致。
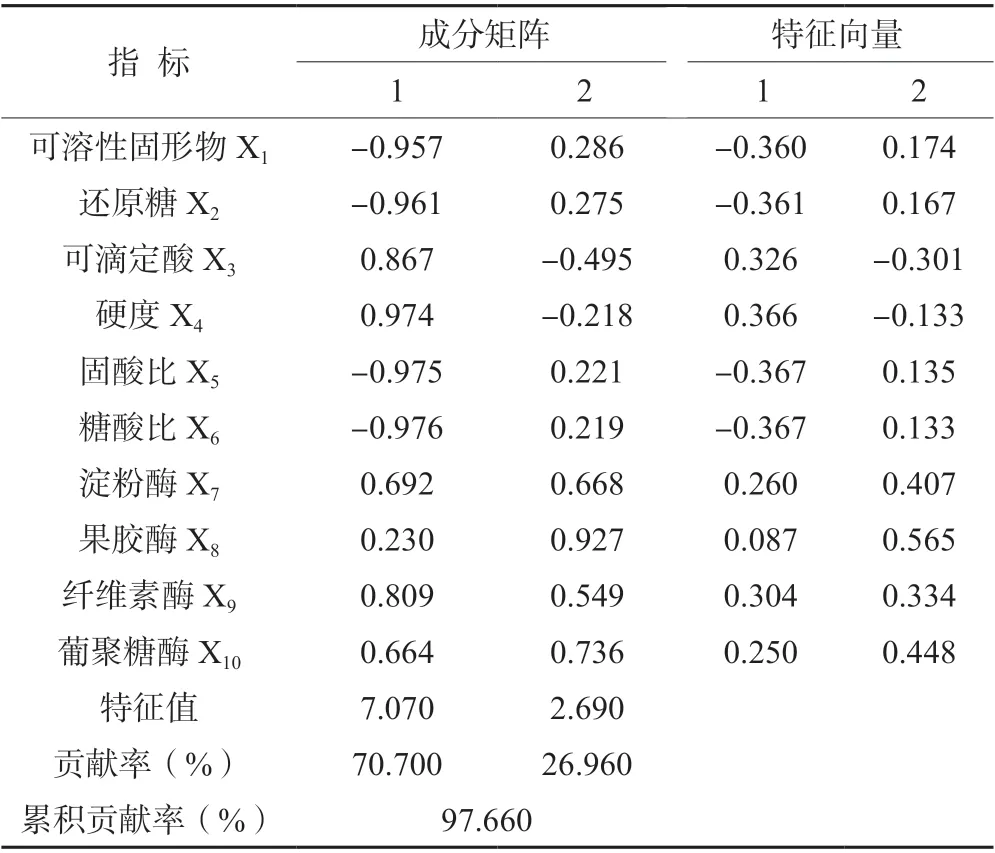
表2 各指标载荷矩阵和特征向量
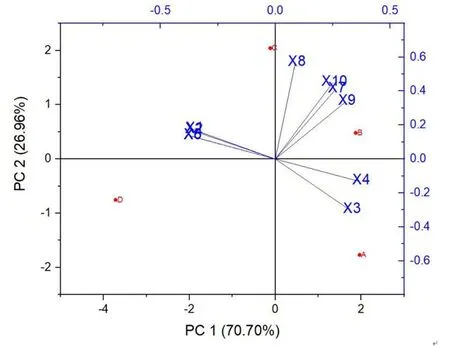
图4 主成分分析图
2.4.2 主成分综合模型构建由表2 获得第1 主成分、第2 主成分的模型f1、f2,再选取的第1、第2 主成分的方差贡献率a1、a2为权数,构建综合评价模型:
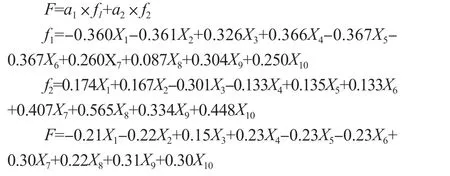
由表3 可知,f1主要表现由高到低变化趋势的理化指标,果实在贮藏30 d 时,开始显著性降低;f2主要表现由“低—高—低”变化趋势的理化指标,果实在贮藏45 d 时,开始显著性降低。F 值是对2 个主成分的总结性归纳,F 值在贮藏45 d 时开始出现负值,说明此时果实已经进入快速软化后熟期。
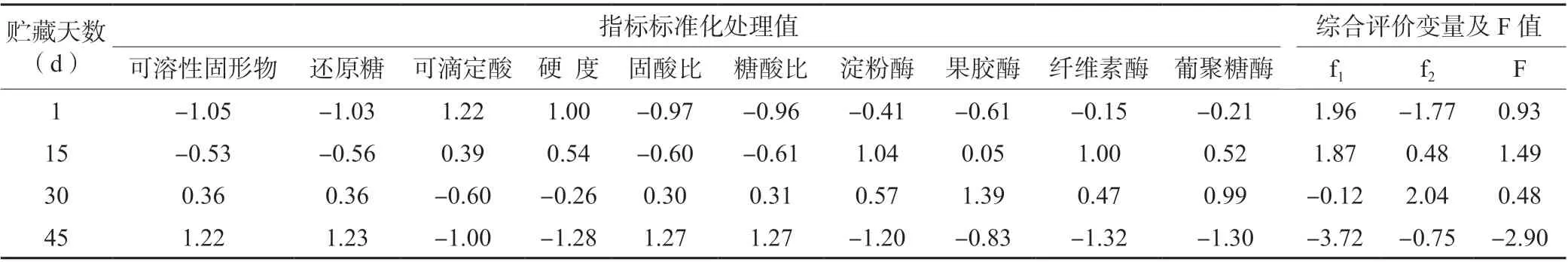
表3 果实理化指标标准化值与综合得分
3 讨论与结论
猕猴桃贮藏期间果实硬度的降低、还原糖和可溶性固形物的增加主要是由于多糖类物质、大分子蛋白等物质的分解所造成的[16-17],一般低温贮藏可延缓这些物质的分解,其主要原因是低温可有效降低果实的呼吸作用强度从而减少糖类物质的分解与消耗,降低乙烯的释放量,同时抑制果实体内大分子物质分解酶的活性和相关酶基因的表达等[18]。通过试验发现,猕猴桃果实在(4±1)℃条件下贮藏45 d 时,果实的可溶性固形物和还原糖含量较刚采摘时虽有较大程度的升高,但此时果实的硬度仍有9.36 kg/cm2,说明果实还未完全软化。果实体内果胶酶、淀粉酶、纤维素酶和葡聚糖酶在贮藏15~35 d 时出现酶活性最大值,说明此时果实正处于快速软化的前期阶段,贮藏45 d 时果实酶活性大幅度降低,可能是此时酶基因表达有所下降所致[19-20]。陈金印等[21]发现在低温条件下,猕猴桃淀粉酶活性在果实贮藏30 d 时出现峰值,果胶酶活性在贮藏30~60 d 时出现峰值,因此,在贮藏30 d左右果实的淀粉、果胶含量及硬度开始快速降低。果实贮藏期果胶酶、淀粉酶、纤维素酶和葡聚糖酶基因表达强弱与对应的酶活性大小所呈现的规律基本一致,同样也是在贮藏15~35 d 时出现基因表达高峰,45 d 时表达量急剧下降。猕猴桃果实在贮藏45 d 时出现酶活性降低、相关酶基因表达量下降以及果实理化指标综合评价值(F 值)负值的情况均表明果实开始走向衰老,但不意味着果实的腐败变质。据报道,果胶酶在果实成熟前期对果实的软化基本不起作用,在果实成熟中后期对果实软化作用明显[22],因此预计在贮藏45~60 d 这段时间可出现还原糖和可溶性固形物的最大值,在60~80 d 时果实还原糖会由于果实自身的呼吸作用而逐渐降低。预计在第80 天后果实开始逐渐出现腐烂变质的情况。果实贮藏期是否能够得到有效的延长主要看能否在果实贮藏初期的30 d 内有效降低果实体内相关酶基因的表达,并控制果实体内的相关生理活性,这段时间是导致果实软化的关键期,在今后的研究中可进行除低温外的其他复合药剂处理,以进一步抑制果实在此段时间的多糖代谢活性。

