倒立水母Cassiopea andromeda的POU、Hox基因家族的多样性及系统发育分析
陈依婧, 郑森林*, 彭胜蓝, 林 茂, 付腾苇
(1.自然资源部第三海洋研究所, 福建 厦门 361005; 2.景德镇陶瓷大学, 江西 景德镇 333046)
刺胞动物门最早出现在前寒武纪[1-2],作为真后生动物中最原始的类型,刺胞动物门的多样性是动物界中最古老的进化事件之一[3]。系统发育基因组学分析表明刺胞动物门(包括水母动物亚门和珊瑚动物亚门)是两侧对称动物的姊妹分支[2, 4-5],水母动物亚门是研究发育生物学和真后生动物早期多细胞演化的理想材料。水母动物亚门由立方水母纲、钵水母纲、水螅虫纲和十字水母纲组成[6]。目前已经对几种刺胞动物的全基因组进行了测序,如珊瑚虫纲的指形鹿角珊瑚(Acroporadigitifera)[7]、星状海葵(Nematostellavectensis)[8]、水螅虫纲的水螅(Hydravulgaris)[9]、半球美螅水母(Clytiahemisphaerica)[6]和钵水母纲的海月水母(Aureliaaurita)[10]。目前NCBI数据库中水母亚门仅有6属9种全基因组数据,其中钵水母纲仅有3属全基因组数据,可见相关研究尚较匮乏。
绝大多数水母的生命周期都包含营固着生活的水螅体形态,它经过无性繁殖产生浮游形态的水母体[11-12],但是有一类水母在形成水母体之后仍然保持部分的附着及倒立的行为,这就是俗称的“倒立水母”。安朵仙水母(Cassiopeaandromeda)是一种最为常见的倒立水母,常见于热带及亚热带浅海沿岸生态系统,如红树林、砂质泥滩和海草床[13],最常在红树林树叶覆盖的泥质基质上定居,因而也被称为“红树林水母”。仙女水母属(Cassiopea)隶属于钵水母纲,与其他浮游钵水母行为显著不同,其生命周期大部分为呈静止状态的水母体,形态特异的中凹扁平伞部附着于基质上,而其凸出的触手和口唇朝上[14]。仙女水母这种特殊的倒立附着生物学行为,理论上应有其遗传学基础。但这种倒立水母的全基因组尚无数据,本研究对典型的倒立水母——安朵仙水母进行了全基因组测序,并同步测序了同属钵水母纲的巴布亚硝水母(Mastigiaspapua)、海蜇(Rhopilemaesculentum)用于平行比较。
目前关于仙女水母特殊倒立行为相关基因的研究只见零星报道。仙女水母的特殊行为包括:倒立、附着、活动能力较低。生物倒立行为可能与感知重力的结构有关,刺胞动物门中仅有钵水母和立方水母的伞缘有感觉器(Rhopalia),其细微结构眼点(Ocelli)感知光,平衡石(Statoliths)感知重力,还能控制游泳肌肉收缩的速度,是水母网状神经系统的组成部分[15]。已有研究认为水母感觉器是其祖先具有感觉功能的结构通过不同感觉细胞群中POU编码基因的差异表达而演变出来的[16]。
仙女水母的“睡眠”类似行为值得关注,作为刺胞动物的代表,它是动物界能被观察到该生物行为的最早的一支进化分支[17]。其“睡眠”特征为可快速逆转的静止状态,及其在“睡眠”期间对感官刺激的延迟响应[13, 17]。因此,本研究对水母神经、感官发育的相关基因进行了分析,包括决定胚胎前后轴分化的Hox蛋白[18]和调节胚胎神经系统发育的POU蛋白[19]。
在附着行为方面,常见的水生生物粘附蛋白有神经肽和磷酸化蛋白等,但目前关于水母粘附的分子机制的研究信息很少[20],本研究着重比较分析安朵仙水母、巴布亚硝水母、海蜇与营附着生活的水螅的粘附相关蛋白的种类和数目差异。
1 材料与方法
1.1 样本采集和基因组测序
用于基因组分析的安朵仙水母、海蜇、巴布亚硝水母的样本由实验室培养获得,其母代采集地分别为中国海南海、中国海渤海和热带西太平洋岛屿。取水母的伞部组织在CTAB缓冲液中用20 mg/L的蛋白酶K(Sigma公司)消化过夜,然后使用酚氯仿试剂(Solarbio公司)提取基因组DNA,获得的DNA样在-20 ℃下保存。采用PE150建库方案及HiSeq×10测序平台,预估测序深度为水母基因组(参照海月水母基因组)的200×。
1.2 全基因组拼接和注释
使用MEGAHIT软件[21]将高质量的滤后数据组装到不同的重叠群(Contig)。为了对这3种水母进行基于同源性的基因预测,我们使用TblastN(阈值1.0E-5)检索了同源物种水螅的蛋白序列[22]。利用GenBlast[23]的程序GenBlastA与GenBlastG对外显子区进行检索及注释。
1.3 同源基因比对和系统发育分析
将安朵仙水母、海蜇、巴布亚硝水母的所有注释蛋白序列与刺胞动物门水螅、指形鹿角珊瑚、星状海葵及海月水母的所有POU、Hox/ParaHox基因做BLASTP[22]最佳匹配(阈值1.0E-5),另外利用Orthofinder-V2.2.7[24]进行同源基因家族聚类,得到预测的POU、Hox/ParaHox基因序列集。使用MUSCLE[25]对POU、Hox/ParaHox基因进行多重序列比对。使用ModelGenerator[26]选择最佳替代模型LG+G后,使用PhyML-V3.0[27]构建POU基因的最大似然法(Maximum Likelihood,ML)系统发育树,自展值(Bootstrap)=1 000。使用FastTree-V2.1.11[28]、LG+CAT模型构建Hox/ParaHox基因的ML系统发育树。输出结果应用BioEdit[29]绘蛋白序列比对图、Evolview V3[30]美化系统发育树。
2 结果与讨论
2.1 全基因组测序及注释
我们测序并组装了3种钵水母安朵仙水母、巴布亚硝水母和海蜇的首个全基因组(表1)。巴布亚硝水母样本的原始测序数据去除杂质后得到78.78 G的数据,组装后最终得到506 Mb的基因组;拼接获得的重叠群一共506 243 595 bp,总共372 755条重叠群,N50值(将重叠群按长度从大到小排列累加长度,当总长达到总碱基数50%时的重叠群长度)为2 748 bp。重叠群最小长度为200 bp, 最大为68 090 bp, 平均1 358 bp。安朵仙水母样本的原始测序数据去除杂质后得到67.05 G的数据,组装后最终得到423 Mb的基因组;拼接获得的重叠群一共423 279 109 bp,总共205 460条重叠群,N50 值为4 888 bp。重叠群最小长度为200 bp, 最大为76 879 bp, 平均2 060 bp。海蜇样本的原始测序数据去除杂质后得到65.83 G的数据,组装后最终得到384 Mb的基因组;拼接获得的重叠群一共384 147 202 bp,总共337 206条重叠群,N50 值为2 348 bp。重叠群最小长度为200 bp, 最大212 791 bp, 平均1 139 bp。通过对全基因组应用同源基因预测方法,我们预测了39 815个巴布亚硝水母的蛋白质编码基因,63 191个安朵仙水母的蛋白质编码基因,66 907个海蜇的蛋白质编码基因。可见3种钵水母中,海蜇基因组最小但非冗余蛋白编码基因最多。
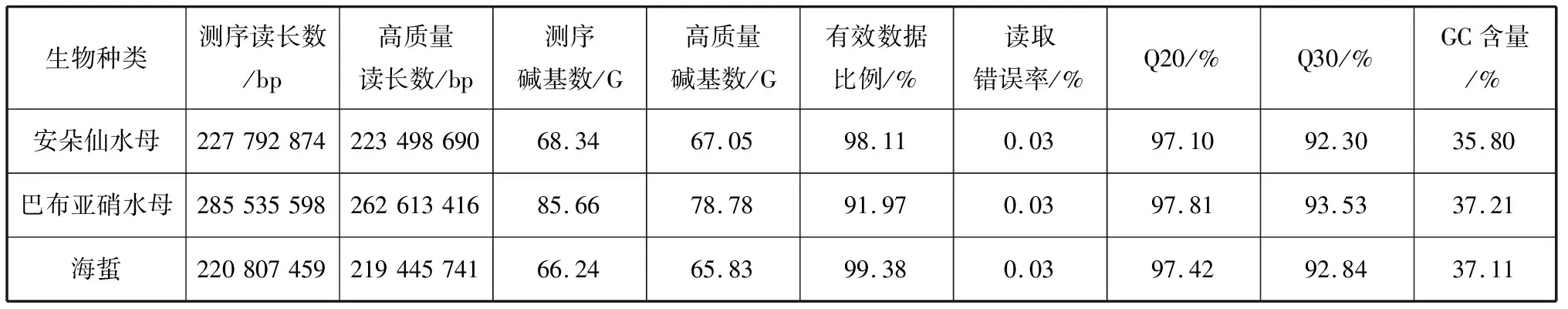
表1 测序产出数据质量
2.2 Hox蛋白序列的多样性与系统发育分析
分别检索到安朵仙水母的11个、海蜇的11个和巴布亚硝水母的9个Hox同源异型盒(Homeobox)蛋白序列(不计重复序列)。系统发育分析显示这些序列与同属钵水母纲的海月水母的亲缘关系较近,且刺胞动物的Hox基因的相同亚型聚类在一起(图1、2)。从类型上划分,安朵仙水母的其中6个、海蜇的其中6个及巴布亚硝水母的其中4个属于“后段Hox基因”即HoxE,HoxF(PosteriorHoxGene),这3种钵水母“后段Hox基因”完整。与其他刺胞动物门一样,安朵仙水母、海蜇和巴布亚硝水母不存在“中段Hox基因”(CentralHoxGene)。安朵仙水母、海蜇和巴布亚硝水母的“前段Hox基因”(AnteriorHoxGene)仅有HoxA,但是HoxB,C,D缺失,这与海月水母一致。关于Hox基因的旁系同源(Paralogue)ParaHox基因,安朵仙水母、海蜇和海月水母都含有完整的GSX及XLOX/CDX基因,但是巴布亚硝水母和水螅、指形鹿角珊瑚一样只含有GSX基因。
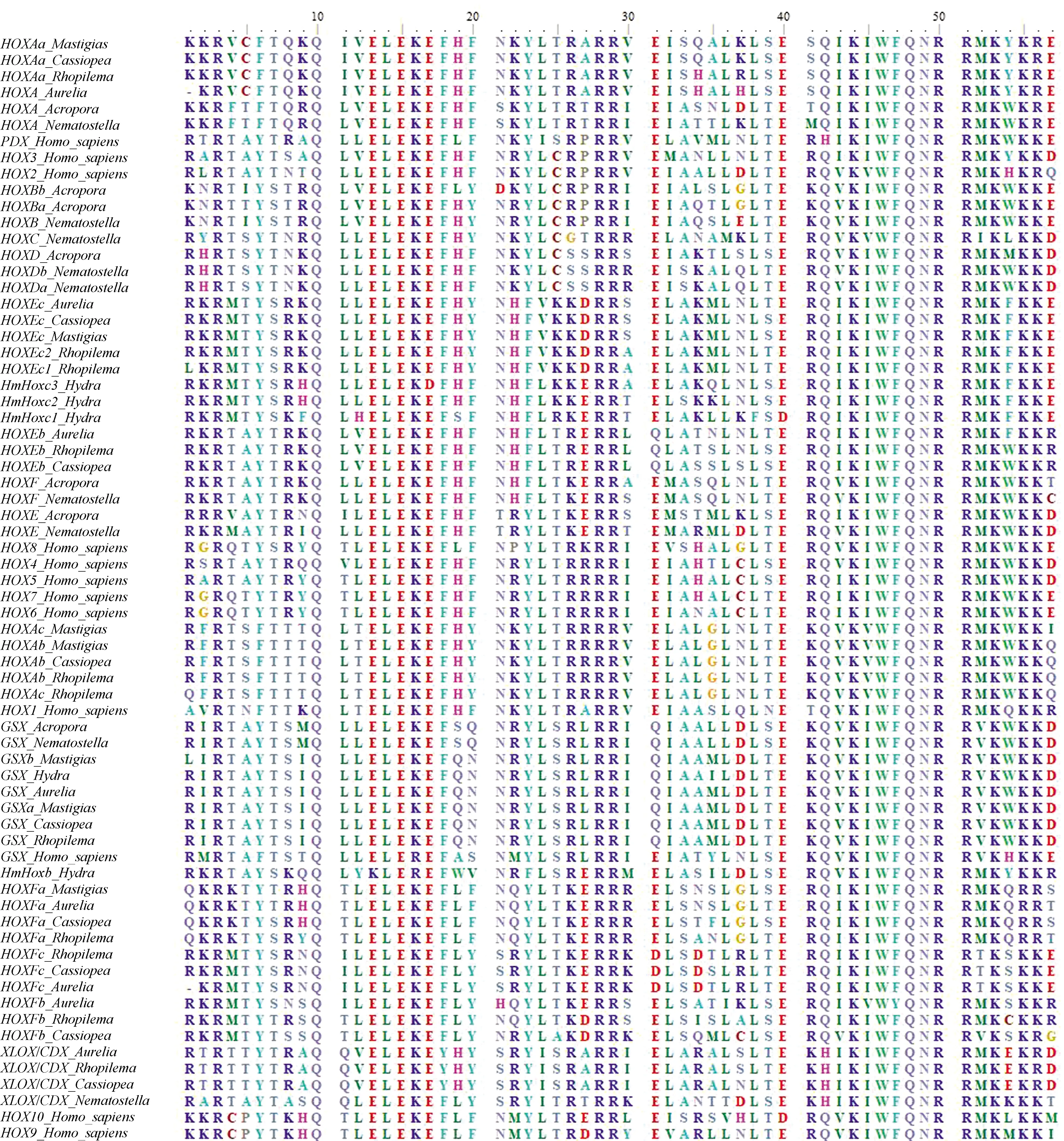
图1 刺胞动物门及人类的Hox/ParaHox基因家族蛋白序列比对
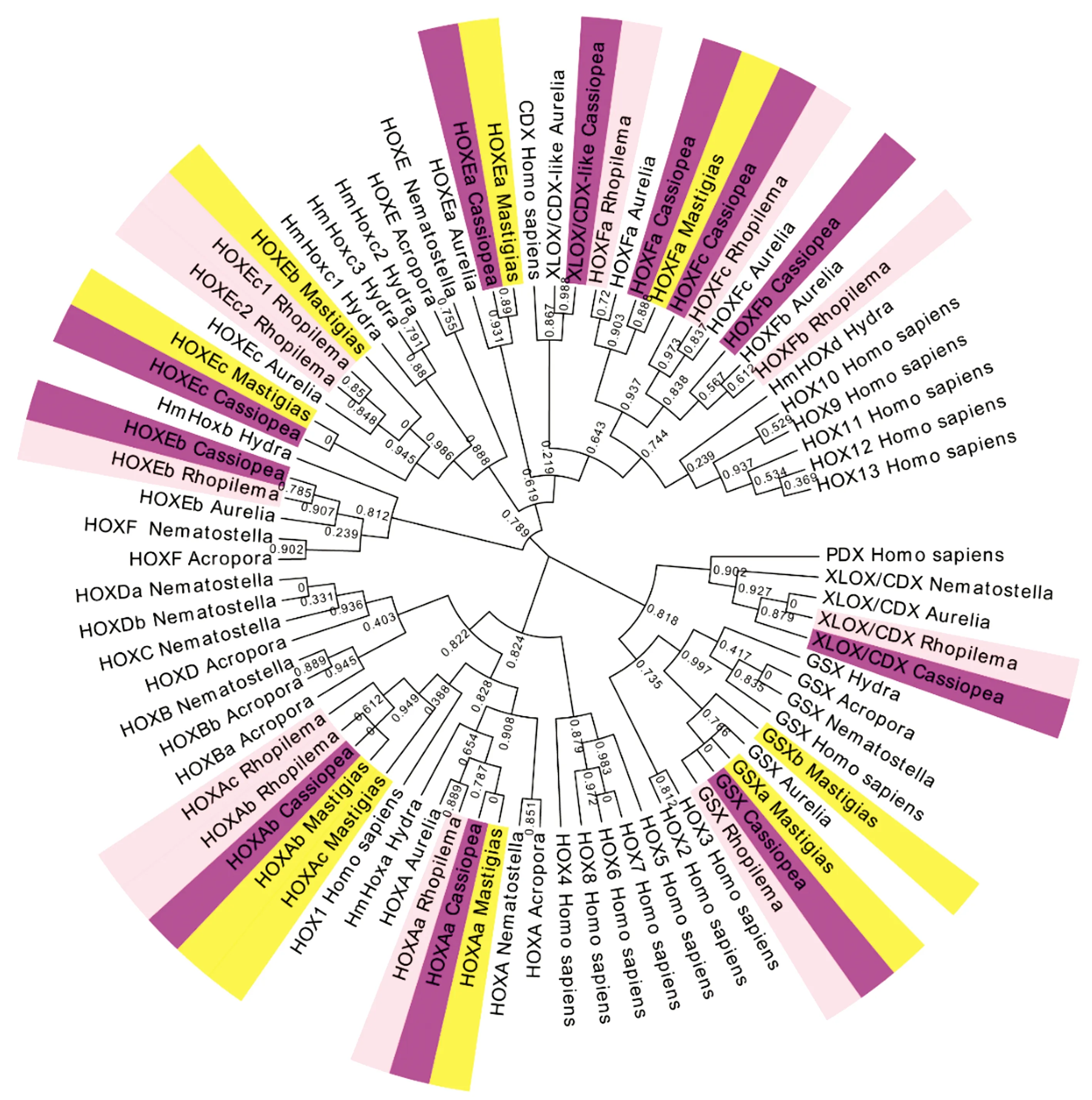
图2 刺胞动物门及人类的Hox/ParaHox基因家族蛋白序列的ML系统发育树
2.3 POU蛋白序列的多样性与系统发育分析
Hox和POU基因家族都具有高度保守的结构域,而钵水母纲POU的类型和数目具有更大的种间差异性(图3、4)。在根口水母目中,安朵仙水母和海蜇各有4种POU亚型,而巴布亚硝水母仅有2种。安朵仙水母和海蜇有POU-1,-2/3/5,-4,-6基因;巴布亚硝水母仅有POU-3,-6基因;旗口水母目的海月水母则有2种亚型POU-1和POU-4,缺少POU-2/3/5和POU-6亚型。可见POU蛋白有两个结合域,位于N端的POU特异结构域(POU Specific Domain,1—73 位)与位于C端的POU同源异形域(POU Homeodomain,102—158 位)[31-32],各亚型的特异性氨基酸位点如111、131、158等处见图3。系统发育分析显示,刺胞动物POU蛋白的相同亚型分别聚类在一起;各亚型中,3种钵水母的POU蛋白序列与同属钵水母纲的海月水母的亲缘关系较近,与珊瑚虫纲亲缘关系较远。在进化关系方面,POU-1,6是最原始的POU家族成员。
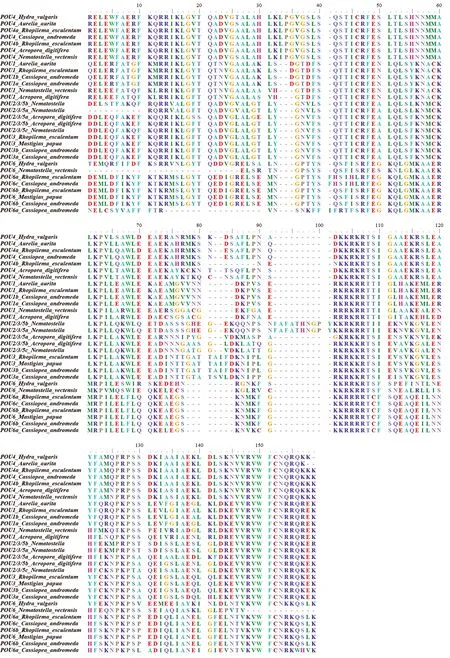
图3 刺胞动物门及人类的POU基因家族蛋白序列比对

图4 刺胞动物门POU基因家族蛋白序列的ML系统发育树
2.4 与附着机制相关的粘附蛋白的比较
通过比较3种水母基因组注释信息和已报道的水螅粘附蛋白[20],我们发现α-l-阿拉伯呋喃糖苷酶B(Alpha-l-arabinofuranosidase B,即AbfB)和Galaxin-like蛋白是安朵仙水母、巴布亚硝水母、海蜇共有的潜在粘附蛋白。安朵仙水母具有巴布亚硝水母、海蜇所不具有的独特潜在粘附蛋白:铁螯合物还原酶类似蛋白(Ferric-chelate Reductase)和具有半乳糖结合凝集素结构域的鼠李糖结合凝集素类似蛋白(Rhamnose-binding Lectin-like Protein with Galactose binding Lectin Domain)。安朵仙水母的粘附相关谷氨酰胺合成酶的编码基因拷贝数比巴布亚硝水母多出8个。但我们没有在这3种水母中发现水螅粘附蛋白中的其他蛋白质家族(包括过氧化物酶、FRG1家族类似蛋白、半胱氨酸蛋白酶抑制蛋白结构域、甲壳素结合环磷酰胺A蛋白结构域和多表皮生长因子类似蛋白11结构域)。
2.5 讨论
安朵仙水母具有全面的POU基因亚型,由于POU是神经系统和感觉器官发育的重要调节因子,这很可能是该水母具有倒立附着行为特征的重要遗传因素之一。在后生动物中,POU一共有6种亚型,其中2/3/5亚型从进化上聚为一簇,可归为一个类型[33],即共4个亚型。本研究发现安朵仙水母、星状海葵、海蜇具备所有这4种亚型基因,指形鹿角珊瑚有3种亚型,而水螅和钵水母纲的海月水母、巴布亚硝水母仅有2种亚型。在本研究分析的刺胞动物中,安朵仙水母的POU-1,-6亚型的核苷酸多态性最高,可能与其特殊的倒立附着行为有关。其中POU-2/3/5亚型在星状海葵、指形鹿角珊瑚、安朵仙水母中序列变异较多,分别有3、2、2种不同序列,但在海蜇、巴布亚硝水母中仅有1种序列,且在水螅及海月水母中缺失。根据以上所述的种类和数目情况,营附着生活的安朵仙水母的POU基因家族可能与营固着生活的珊瑚、海葵更接近。其中安朵仙水母所具有的POU-3亚型可能是个潜在的扩增基因,它在两侧对称动物中未被检索到[10]。POU表达具有组织特异性,比如在索氏桃花水母(Craspedacustasowerbyi)中,POU-6多数在平衡囊(Statocyst)中表达,较少在生殖腺(Gonad)和胃腔(Gastric cavity)中表达;POU-4中csPOU-4f1在平衡囊中表达,csPOU-4f2在生殖腺和平衡囊中表达,仅csPOU-4f3未被观察到在平衡囊中表达;POU-4,-6都几乎未被观察到在卵母细胞组织(Oocyte)中表达[32],安朵仙水母POU-4与其中csPOU-4f3序列相似性最高。已知POU-4参与控制视觉器官的发育,如调控脊椎动物中视网膜神经节细胞的发育[34],但是该蛋白在水母眼点处的表达情况仍未知。已有研究认为POU-1和POU-4指引了水母不同感觉细胞群类群的发育,如在海月水母中POU-4被认为参与位于顶端细胞表面、具有微绒毛的机械感觉细胞发育过程,而POU-1参与位于感觉器的外细胞层的感觉细胞发育过程[16]。可见POU基因的多样性对水母的感觉器官功能有重要影响,很可能与安朵仙水母“睡眠”态中对感官刺激延迟响应的特征有关,这反映了尽管简单生物水母未发育出发达的眼结构,但其相对复杂的感知系统已具备深入研究的价值。由于安朵仙水母具有完整的POU亚型,这些基因可能起到不同功能,共同参与了其倒立、睡眠态行为的复杂神经调节过程。但目前对POU的研究主要集中在高等动物,如POU促进哺乳动物伤口愈合、细胞凋亡、神经诱导、神经元定位等[19, 35],在低等的刺胞动物中的功能尚不明确,其与倒立水母的具体功能关系需进一步研究。
Hox基因家族是决定两侧对称动物的胚胎前后轴的分化及其他发育基因的重要调节因子,它在非两侧对称动物中仅存在于刺胞动物门中,所以在刺胞动物门中的研究对Hox基因的早期演化有重要意义[36]。Hox蛋白在刺胞动物门中表现出高度相似的结构域,钵水母属中不同物种的相同Hox亚型都聚类在一起,都说明其在进化上具有一定的保守性。本研究从全基因组角度发现,在安朵仙水母、海蜇和巴布亚硝水母中未找到“中段Hox基因”,这与先前的研究认为“中段Hox基因”仅在两侧对称动物中出现、在刺胞动物不存在“中段Hox基因”假说是一致的[36]。本研究发现的另一个现象为安朵仙水母、巴布亚硝水母、海蜇的“前段Hox基因”仅有HoxA(这与海月水母一致),而珊瑚虫纲的星状海葵则同时存在Hox-A,B,C,D所有“前段Hox基因”亚型,指形鹿角珊瑚也具有Hox-B,C,D(图1),这一现象说明钵水母及水螅在进化过程中“前段Hox基因”产生了部分缺失。先前研究认为星状海葵只具有一支“前段Hox基因”[37-38],但本研究发现其同样具有“后段Hox基因”HoxE,F。近年以星状海葵作为模式生物深入研究了Hox基因在刺胞动物的胚胎发育过程中的作用机理[39],但是对于水母中Hox基因的具体功能还了解甚少[40]。
粘附相关蛋白的编码基因在安朵仙水母和巴布亚硝水母、海蜇间具有明显差异,推测是安朵仙水母倒立行为的另一个特征因素。水螅基盘细胞分泌的粘接剂的主要成分是蛋白质和聚糖[41],多糖的大量表达是满足可逆粘附(Reversible Adhesion)的一个条件,但聚糖在粘附蛋白中的根本作用机制仍有待明确[20, 41]。谷氨酰胺合成酶(Glutamine Synthetase)是一种粘附关键酶,它控制细胞内氮的使用,从而生成富含氮的蛋白质[42],安朵仙水母的该酶编码基因拷贝数比巴布亚硝水母多出8个,说明其表达量可能较多。鉴于已知AbfB具有催化O-糖基化合物进行水解反应的功能,推测安朵仙水母和巴布亚硝水母、海蜇的主要粘附相关蛋白可能是O-糖基化的。本研究发现安朵仙水母具有巴布亚硝水母、海蜇所不具备的粘附相关的半乳糖结合凝集素蛋白,而凝集素结构域可为分泌到体外的粘附物质提供额外的比如具有抗细菌降解功能的物质[43],许多附着物种粘附蛋白具有半乳糖结构域,如海胆Nec-1、Nec-2蛋白[44]、海星Sfp1蛋白[45]。铁螯合物还原酶类似蛋白为安朵仙水母特有的,但巴布亚硝水母、海蜇并不具备,推测这种抗氧化活性物质对水母粘附起作用,可能替代了水螅中过氧化物酶催化粘附蛋白聚合[20, 41]的作用。
尽管水母的细胞类型和数目相对高等动物较少,但仍然呈现了一个复杂的调节网络:倒立水母“睡眠”态行为可能与网状神经系统调节运动和感觉器官功能有关,倒立水母附着行为除了受控于基盘处肌肉运动的物理因素[41],还可能与凝集素、蛋白酶、多糖等多种分泌因子相关。
3 结论
通过比较安朵仙水母、海蜇、巴布亚硝水母及其他刺胞动物的重要转录调节因子多样性与系统发育关系发现,安朵仙水母具有更多POU编码基因和复杂POU亚型,以及具有粘附相关凝集素及还原酶的编码基因,可能是与安朵仙水母倒立附着生活方式相关的关键遗传信息。首先,安朵仙水母具有全面的POU亚型,其POU亚型的核苷酸多态性较高,非冗余蛋白序列最多。安朵仙水母的POU基因家族的种类数目情况与营固着生活的珊瑚、海葵更接近。其次,安朵仙水母具有巴布亚硝水母、海蜇所不具有的粘附相关鼠李糖结合凝集素和一类抗氧化活性物质铁螯合物还原酶。3种钵水母共有ABfB和Galaxin-like潜在粘附蛋白。另外,本研究发现钵水母“前段Hox基因”存在部分亚型缺失;安朵仙水母和海蜇的Hox旁系同源ParaHox基因种类完整;研究结果支持刺胞动物不存在“中段Hox基因”的假说。

