牛病毒性腹泻病毒离子孔道蛋白p7多肽多克隆抗体的制备和鉴定
付强 郭妍婷 陈俊贞 王金泉 史慧君
(新疆农业大学动物医学学院,乌鲁木齐 830052)
牛病毒性腹泻病毒(bovine viral diarrhea virus,BVDV)是导致牛病毒性腹泻(bovine viral diarrhea,BVD)的病原[1]。牛、羊、鹿等易感动物感染BVDV后,会造成腹泻、急和慢性黏膜病、病毒血症、免疫耐受和持续感染、免疫抑制、繁殖障碍等症状[2],是严重危害我国养殖业的重要传染病之一。国际兽疫局(Office International Des Epizooties,OIE)将BVD定为B类传染病,在我国进出口检验检疫中也将其列为二类传染病。
BVDV的非结构蛋白p7,位于E2蛋白与NS2蛋白之间,分子量约7 kD,是主要由疏水氨基酸构成的一个小分子肽[3]。由Harada和Carrere-Kremer等人最初提出BVDV和HCV的p7蛋白寡聚并形成离子通道[4]。因为p7的离子通道活性使其被纳入在病毒孔蛋白(Viroporin)家族中,Viroporin是一种小的疏水蛋白,当这些蛋白质在宿主细胞膜中寡聚时,它们会形成亲水孔,增加膜的通透性,进行离子和小分子运动,破坏细胞的许多生理特性[5-6]。大量研究发现,许多的病毒能表达膜蛋白结构,表现出细胞的离子通道样的某些功能,以介导病毒进入细胞、帮助病毒复制和调节病毒释放[7]。目前,针对BVDV p7的研究较少,p7寡聚形成离子孔道的机理尚不明确,抗p7抗体是开展研究工作的必要工具。本试验通过合成p7蛋白的抗原表位多肽,免疫动物后获取多克隆抗体,为进一步探索BVDV致病机制提供了有利工具。
1 材料与方法
1.1 材料
1.1.1 细胞、病毒和动物 MDBK细胞购自上海细胞库;BVDV毒株NADL为国际标准毒株,购自中国药品监察所;新西兰大白兔,体重约2.5-3.0 kg,购自陕西西咸新区沣东新城实验动物养殖场。本实验通过新疆农业大学实验动物福利伦理委员会批准(批准号2020040)。
1.1.2 主要试剂和耗材 弗氏完全/不完全佐剂(F5881)和明胶购自Sigma公司;蛋白标准Marker和透析袋10 kD购自Thermo公司;细胞爬片购自NEST公司;Proclin 300和Casein购自北京索莱宝生物公司;HRP标记山羊抗兔IgG(H+L)(SA00001)和 CoraLite594-conjugated Goat Anti-Rabbit IgG(H+L)(SA00013)购自武汉三鹰生物技术有限公司;TMB显色液、BCA蛋白定量试剂盒、考马斯亮蓝染色、Triton X-100、小牛血清白蛋白BSA、山羊血清购自上海碧云天生物技术有限公司。
1.1.3 主要仪器 酶标仪(111-7)、蛋白电泳槽和电源购自Bio-Rad公司;NanodropTMOne(DS-11)购自DeNovi+公司;恒温振荡器(B0101123)购自太仓实验设备厂;激光共聚焦显微镜(Zeiss LSM500)购自德国蔡司公司。
1.2 方法
1.2.1 p7蛋白多肽抗原的设计与合成 使用蛋白二级结构预测平台JPred(http://www.compbio.dundee.ac.uk/jpred4 /index.html)进行BVDV p7蛋白(GenBank登录号NC_001461.1)的二级结构分析,预测抗原表位,设计多肽并偶联KLH载体蛋白形成MSQYGAGEIVMMGN-Cys-KLH,交由吉尔生化(上海)有限公司合成,并由该公司完成RP-HPLC检测多肽纯度和质谱分析多肽分子量。
1.2.2 抗血清的制备 首次免疫前,对2只新西兰大白兔进行耳缘静脉采血并分离血清,作为阴性对照。取多肽与等体积的弗氏完全佐剂或弗氏不完全佐剂进行充分乳化;对2只新西兰大白兔进行背部皮下多点免疫注射,首免使用弗氏完全佐剂,剂量为400 μg/只,浓度为1 mg/mL;此后使用弗氏不完全佐剂乳化多肽,每两周进行一次免疫;第5次免疫PBS溶解的多肽,剂量为400 μg/只,浓度为2 mg/mL。免疫完成后对新西兰大白兔进行心脏采血,收集血清。
1.2.3 抗原亲和柱制备 将多肽与溴代预活化的交联琼脂糖基质Bromohydrin Purose®4 Fast Flow偶联。先用10倍体积纯水将基质中乙醇洗净,用筛选通过注射器抽干基质;使用偶联缓冲液(0.2 mol/L Na2CO3和 0.5 mol/L NaCl,pH 10) 溶 解 多 肽 成 7 mg/mL多肽溶液;将活化的基质与多肽溶液按1∶1混合,25℃反应约20 h;使用Nanodrop测定流出液的浓度并计算偶联效率,大于95%表明多肽偶联成功;偶联结束后,用10倍柱体积的去离子水冲液洗去多肽溶液;添加1 mol/L乙醇胺反应8 h,以封闭未反应的活性基团;反应结束后用去离子水冲洗干净。
1.2.4 抗原特异性抗体纯化 将上述抗原亲和基质装填重力柱,上样前先用5倍柱体积0.1 mol/L,pH 9.5的Na2HPO4·12H2O冲洗亲和柱,进行柱平衡;加入抗血清,每次10 mL,弃去流出液;加入5倍柱体积的0.1 mol/L,pH 9.5 Na2HPO4·12H2O淋洗,弃去淋洗液;加入3倍柱体积的0.2 mol/L,pH 4.0 柠檬酸溶液洗脱抗体,收集洗脱液后立即加入1 mol/L,pH 8.0 Tris缓冲液中和;将洗脱抗体溶液使用PBS溶液透析2 h;0.22 μm滤器过滤后,4℃保存备用。
1.2.5 抗体效价检测 使用pH 9.6碳酸盐缓冲液将600 ng/孔多肽包被至96孔酶标板,4℃孵育过夜;每孔加入200 μL封闭液(2%明胶、1‰ Proclin 300、5‰ Casein,PBS配制),37℃孵育2 h;对纯化后的抗体进行10倍比梯度稀释,稀释比依次从1∶10-1∶1×1012;按照每孔100 μL将稀释后的抗体加入各孔中,37℃孵育1 h;每孔100 μL加入HRP标记羊抗兔 IgG(H+L)(稀释度 1∶5 000),37℃孵育 30 min;TMB 显色液显色10 min后,使用2 mol/L稀硫酸终止显色反应,酶标仪测定OD450nm值。检测孔OD450nm值平均值/阴性对照孔OD450nm平均值 > 2.1则判定为阳性;可检测到阳性信号的抗体最低稀释倍数为抗体效价。
1.2.6 抗体纯度检测 使用BCA蛋白定量试剂盒对抗体蛋白定量后,加入5×SDS-PAGE loading buffer混匀,100℃加热10 min使蛋白变性。使用12%SDS-PAGE电泳分离5和10 μg变性蛋白,100 V电泳约2 h;使用考马斯亮蓝染色30 min,脱色液(30%甲醇、10%冰醋酸,PBS配制)脱色2 h。使用GeL Doc2000成像系统获得图像,并使用ImageJ分析p7抗体所占灰度值。
1.2.7 间接免疫荧光检测多克隆抗体特异性 将MDBK细胞接种至铺有细胞爬片的24孔细胞培养板中,置于细胞培养箱中继续培养,待细胞汇合度达60%时,接种1 000 TCID50BVDV感染24 h后,弃掉细胞培养液,使用4%多聚甲醛溶液固定15 min,加入0.5% TritonX-100孵育10 min,加入封闭液(0.5%Triton X-100、3% BSA、1%山羊血清,PBS配制)封闭1 h;加入p7多克隆抗体(稀释度1∶100),4℃孵育过夜;使用CoraLite594-conjugated Goat Anti-Rabbit IgG(H+L)(稀释度1∶250)室温孵育1 h,使用抗荧光淬灭封片液封片,使用激光共聚焦显微镜观察荧光阳性情况及定位。
2 结果
2.1 p7蛋白多肽抗原的设计
为合成p7蛋白的多肽抗原,使用JPred预测p7蛋白抗原表位,结果如图1所示,BVDV p7蛋白共由71个氨基酸所组成,其中绿色为β片层结构,红色为α螺旋结构,其中B表示氨基酸疏水情况;在25% cut-off溶剂可及性时,p7蛋白的亲水区域主要位于该蛋白的氨基端,设计MSQYGAGEIVMMGN多肽,并偶联KLH载体蛋白以刺激辅助T细胞,进而诱导B细胞免疫反应,合成MSQYGA GEIVMMGNCys-KLH多肽。
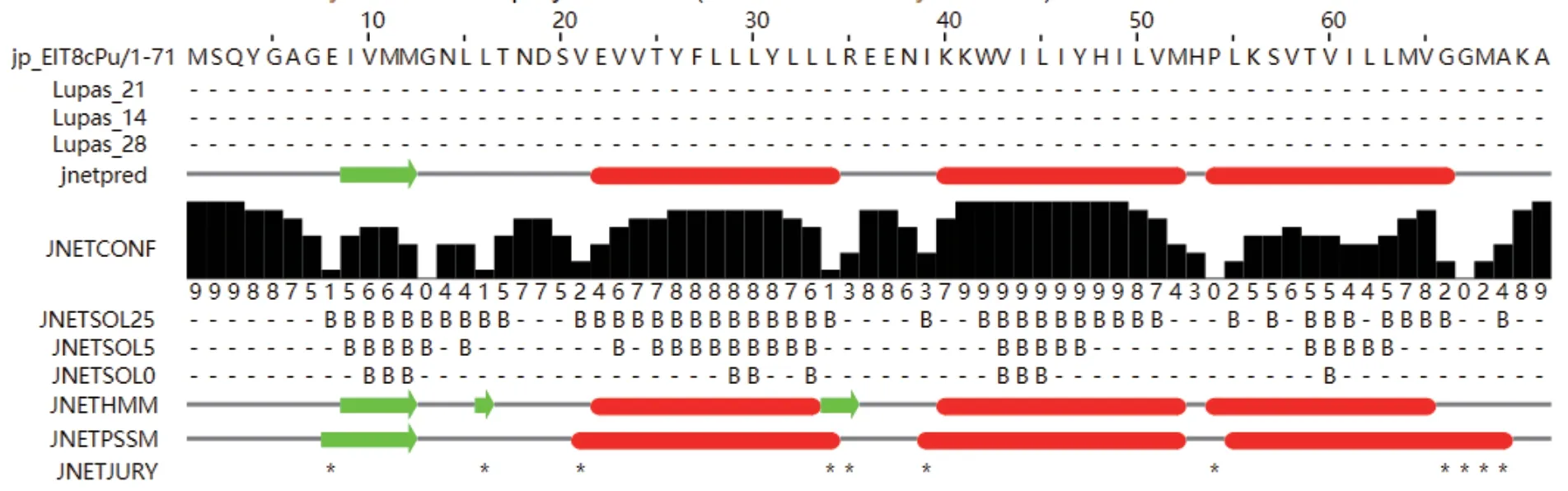
图1 P7蛋白二级结构预测Fig. 1 Prediction of secondary structure of P7 protein
2.2 多肽纯度和分子量检测
使用RP-HPLC检测多肽的纯度,同时使用质谱分析多肽的分子量。结果如图2和3所示,合成多肽的保留时间为9.810 min,峰面积1 197 903(mAU*s),多肽的纯度为 80.19%(1 197 903/1 493 847),合成的多肽分子量为794.2 Da。

图2 RP-HPLC检测多肽纯度Fig. 2 Determination of polypeptide purity by RP-HPLC
2.3 p7多肽抗体效价检测
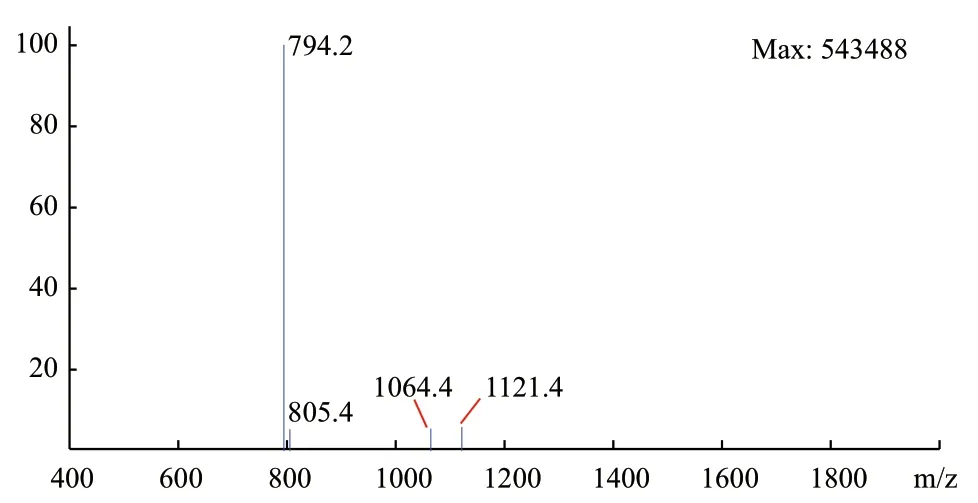
图3 质谱鉴定多肽分子量Fig. 3 Identification of molecular weight of polypeptide by mass spectrometry
第5次免疫后10 d,心脏采血并收集血清,使用多肽偶联的抗原纯化柱进行亲和纯化。间接ELISA检测纯化后、PBS对照组和免疫前的抗体反应性。结果如表1所示,经过亲和纯化后的抗体效价达1∶100 000(PBS对照组的阴性参考值为OD450nm=0.110),与抗原有显著的反应性,满足后续实验需求。

表1 间接ELISA检测抗体效价Table 1 Detection of antibody titer using indirect ELISA
2.4 SDS-PAGE检测抗体纯化结果
多抗血清通过多肽偶联的抗原纯化柱亲和纯化后,使用10 kD半透膜对纯化血清进行透析,并使用0.22 μm滤器过滤除杂质。SDS-PAGE电泳后使用考马斯亮蓝染色鉴定抗体纯度。结果如图4所示,在55 kD处可见抗体重链分子,在25 kD处可见轻链分子,使用ImageJ分析p7抗体所占灰度值比为90.2%。表明已纯化出兔抗p7多肽IgG抗体。

图4 SDS-PAGE 检测抗体纯化结果Fig. 4 SDS-PAGE results of antibody purification
2.5 免疫荧光染色鉴定p7多肽多克隆抗体
为进一步鉴定多克隆抗体的反应性,使用免疫荧光染色鉴定BVDV感染MDBK细胞p7蛋白表达及分布情况。结果如图5所示,BVDV感染MDBK细胞后表达的p7蛋白能与p7多克隆抗体发生特异性反应,可见红色荧光广泛分布于BVDV感染MDBK细胞的细胞膜周围,与p7寡聚在细胞膜上形成离子孔道的蛋白分布一致,而对照组细胞则无法检测到红色荧光,表明p7多肽多克隆抗体具有较好的反应性和特异性。黑色箭头指示细胞核。
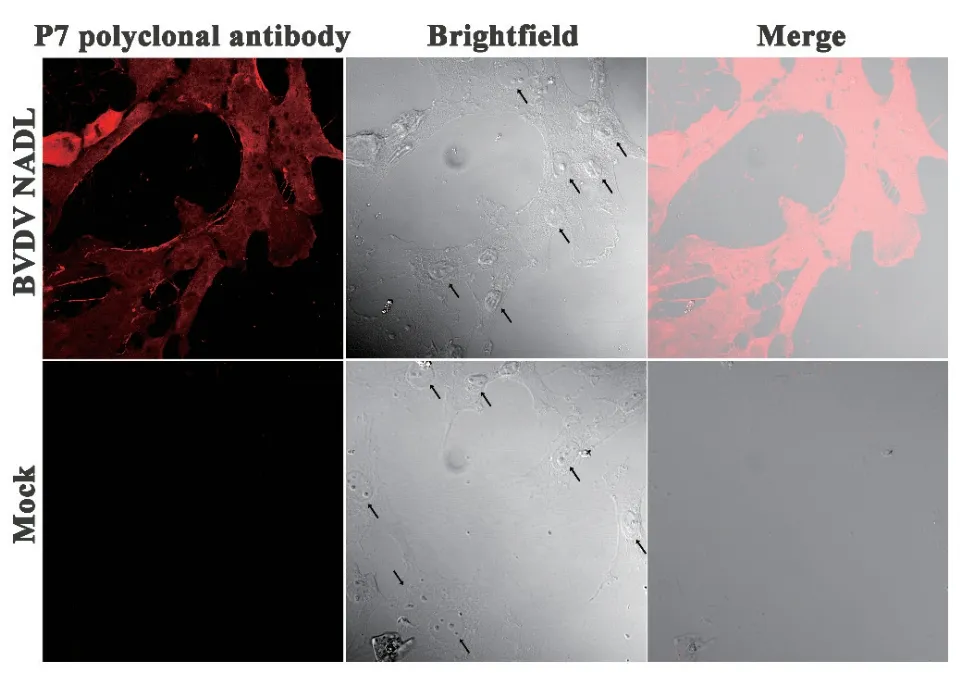
图5 免疫荧光染色测定p7多肽多克隆抗体的反应性Fig. 5 Determination of the reactivity of p7 polypeptide polyclonal antibody by immunofluorescence staining
3 讨论
病毒进入宿主后,病毒孔蛋白与宿主细胞中的不同细胞器膜相互作用,借助宿主细胞某些因子组装成离子通道,介导一些离子(Na+、Ca2+、K+、H+等)运输而对病毒进入细胞及子代病毒在细胞中成熟产生影响[8-9]。新型丙型肝炎病毒p7离子通道抑制剂BIT225可抑制脂质膜中的p7离子通道活性,并在BVDV感染试验中具有抗病毒活性,BIT225与重组干扰素α-2b的组合显示出针对BVDV的协同抗病毒作用,并且通过添加利巴韦林进一步增强了协同作用[10]。用长烷基链亚氨基糖衍生物处理人工脂质膜中的p7,对p7的离子通道活性的抑制作用随着浓度的升高而增强。而这类化合物对BVDV具有强大的抗病毒活性[11-12]。这表明病毒传播过程中离子通道活性的重要性,以及p7有可能是潜在的药物靶点。而目前关于p7如何形成离子孔道帮助BVDV释放?p7蛋白翻译后如何转运?需要哪些辅助蛋白的修饰和协作?这些问题的解决都需要构建p7蛋白抗体,否则难以检测其定位和表达,并探明其形成离子孔道的机制。在本研究中,使用p7蛋白的N端氨基酸,合成多肽,经多次免疫家兔后使用ELISA和免疫荧光染色检测多肽多克隆抗体具有较好的反应性和特异性。
使用生物信息学平台分析p7蛋白,发现N端1-14位氨基酸具有较好的亲水性。使用化学方法合成多肽并偶联KLH,免疫新西兰大白兔制备抗p7多抗血清。ELISA测定经抗原纯化柱亲和纯化后的抗体效价,结果显示抗血清效价在1∶100 000,说明制备的p7多肽抗体具有较好的反应性。Western blot检测抗p7多肽抗体结果显示在55 kD和25 kD处有较为明显的条带。免疫荧光染色BVDV感染MDBK细胞可见细胞膜上出现与p7多克隆抗体发生特异性反应,而p7蛋白主要形成离子孔道存在于细胞膜上,综上结果表明本研究获得的多肽多克隆抗体可作为抗BVDV p7检测方法中的具有特异性结合作用的抗体,也为后期深入研究BVDV p7的功能及作用机制奠定了基础。
4 结论
成功制备兔抗BVDV p7多肽多克隆抗体,使用ELISA和免疫荧光染色发现该抗体具有较好的反应性和特异性,为进一步研究p7形成离子孔道的机理提供了有利工具。

