环剥对红阳猕猴桃果实品质及糖代谢的影响
杨勇 陈露 陈成 阎永齐
摘要:以中华猕猴桃良种红阳为试材,研究不同时期、不同宽度环剥对红阳猕猴桃果实品质指标及糖代谢的影响。结果表明,花后30 d,环剥宽度等于结果枝直径的环剥处理可显著提高红阳猕猴桃果实单果质量、可溶性固形物含量、固酸比、维生素C含量(P<0.05),改善果实品质。同时,环剥处理通过相关酶活水平的调节影响糖代谢进程。环剥处理提高了果实发育期内腺苷二磷酸葡萄糖焦磷酸化酶(AGpase)的活性;花后58~156 d,果实蔗糖磷酸合成酶(SPS)活性较对照显著提高;果实发育后期,环剥处理诱导增强果实蔗糖合成酶(SS)活性,降低酸性转化酶(AI)和中性转化酶(NI)活性,最终提高了果实可溶性糖(蔗糖、葡萄糖、果糖)含量。建议在花后30 d,对红阳猕猴桃进行环剥宽度/结果枝直径为1的环剥处理。
关键词:红阳猕猴桃;环剥处理;果实品质;糖代谢;酶活性
中图分类号: S663.404文献标志码: A文章编号:1002-1302(2021)19-0156-08
红阳猕猴桃是我国自主选育的首个红肉型中华类猕猴桃品种,其鲜果剖面沿果心放射性排布紫红色条帶,形似太阳,光芒四射,故取名红阳[1-2]。红阳猕猴桃味甘甜,富含维生素C(VC),深受国内消费者的喜爱。近年来,国内外红阳猕猴桃的栽培面积不断增加,然而在红阳猕猴桃的商品化生产中,因其果实偏小(常规栽培条件下果实单果质量一般不超过70 g),严重影响其商品价值的提高和生产栽培的正常发展[3]。同时,伴随着日趋激烈的市场竞争环境,消费者对果实品质要求也在逐步提高。因此,采用切实有效的技术提升果实商品性,已成为果树栽培管理技术发展的主要方向。
目前,生产上大多使用氯吡脲(CPPU)[4]、噻苯隆[5-6]、2,4-二氯苯氧乙酸(2,4-D)[7]等植物生长调节剂来改善果实品质,但果实种植户通常不能掌握施用浓度和方法,从而造成生长调节剂滥用的现象,反而导致果实品质下降,贮藏性能降低[8-9],不仅没有提高经济效益,还带来食品安全问题[10],因此采用物理手段来代替生长调节剂的使用很有必要。环剥,又称环割技术,是一种有效简便的果园管理措施,在果树生产中具有重要的应用价值,在调控果树促花保果、增产提质等方面有良好效果,可有效降低生产中大量喷施植物生长调节剂对果实和环境造成的污染[11],是果树无公害、绿色生产的有效配套技术。目前,环剥技术在荔枝、葡萄、龙眼等果树上应用较多[12-14],多集中于对树体生长、果实产量与品质的影响研究[15-16],在猕猴桃上的鲜见报道。本试验拟探讨不同时期、不同宽度环剥对红阳猕猴桃果实大小等果实品质指标及糖代谢的影响,以期为猕猴桃的高产优质栽培提供参考依据。
1材料与方法
1.1材料与试剂
试验在江苏省镇江市句容市江苏丘陵地区镇江农业科学研究所猕猴桃试验园进行,以2014年定植的红阳猕猴桃嫁接植株为试验材料,株行距为25 m×5 m,采用水平棚架方式栽培,树势健壮。
淀粉试剂盒,北京索莱宝科技科技有限公司生产;酶试剂盒,上海科兴商贸有限公司生产。
1.2仪器与设备
PAL-1手持便携数显折光仪,日本Atago公司生产;GY-4数显式水果硬度计,浙江托普仪器有限公司生产;1100高效液相色谱仪,美国Agilent公司生产;电子数显游标卡尺,桂林广陆数字测控有限公司生产;DK-98-11A电热恒温水浴锅,天津市泰斯特仪器有限公司生产;高速冷冻离心机,德国Eppendorf公司生产;Spark 酶标仪,瑞士Tecan公司生产。
1.3方法
1.3.1试验设计采取单因素随机区组试验设计,2018—2019年连续2年选生长健壮、生长势和结果量基本一致的植株进行试验。2018年试验设置3个区组,每6株树为一个区组,区组内随机排列,每区组3个重复。选择生长势相当、结果量大体一致的结果母枝,进行环剥处理,分别于花后10、30、50 d进行不同时期的环剥试验。设3个环剥处理:不环剥、环剥宽度为结果枝直径的1/2和1。环剥部位为距离结果枝基部分枝2 cm处,深度达木质部。在果实平均可溶性固形物含量达到6.5%~7.5%时,小区内混合采收。选取成熟度一致、无病虫害和机械损伤的果实运回实验室,并于采收当天在每重复内随机抽取40个果实,其中20个果实进行单果质量、横径、纵径等果实指标的测定,另20个果实进行软熟处理,并测定软熟果实品质指标可溶性固形物含量、干物质含量、维生素C含量。
根据2018年的试验结果,2019年试验设置2个区组,每6棵树一个区组,区组内随机排列,每区组3个重复。于花后30 d进行结果母枝环剥处理,环剥宽度为结果枝直径的粗度,环剥位置、深度同2018年,以不环剥作为对照,环剥后立即使用愈伤涂膜剂涂抹环剥口,防止病菌侵染。分别于花后30、44、58、72、86、100、114、128、142、156、170 d以及果实软熟后测定果实相关指标。每次取样选择生长势相当、结果量大体一致的结果母枝中上部位果实,每次20个果实。
1.3.2果实外观品质性状的测定果实鲜质量:用电子天平测定,单位为 g。
果形指数:分别用游标卡尺测量果实横径(cm)、纵径(cm),果形指数=纵径/横径;
相对生长速率:参照Moscatello等的方法[17]进行测算。
果肉硬度用GY-4数显式水果硬度计测定,单位为kg/cm2。
1.3.3果实可溶性固形物和维生素C含量测定用折光仪测定可溶性固物含量,单位为%。
维生素C含量的测定参考Kampfenkel等的三价铁离子还原法[18],单位为mg/100 g。
1.3.4果实淀粉含量和可溶性糖含量测定淀粉含量参照徐昌杰等的碘显色法[19]测定,单位为mg/g。
可溶性糖(蔗糖、葡萄糖、果糖)含量参照沈志军等的方法[20],用高效液相色谱仪测定,单位为mg/g。
1.3.5有机酸含量测定奎尼酸、苹果酸、柠檬酸含量参照姚改芳等的方法[21]测定,单位为mg/g。
1.3.6糖代谢相关酶活性测定每个样品称取2 g猕猴桃果肉,液氮研磨,加入一定量的5 mmol/L磷酸盐缓冲盐溶液(PBS,pH 值7.4)提取缓冲液,匀浆,4 ℃低温离心20 min(2 000~3 000 r/min),收集上清液,进行蛋白定量和按照酶试剂盒(R&D,购自上海科兴商贸有限公司)说明书测定酸性转化酶(AI)、中性转化酶(NI)、蔗糖合成酶(SS)、蔗糖磷酸合成酶(SPS)、腺苷二磷酸葡萄糖焦磷酸化酶(AGpase)的活性。
计算:用标准物的浓度与吸光度(D)计算出标准曲线的直线回归方程式,将样品的D值代入方程式,计算出样品浓度,再乘以稀释倍数,即为样品的实际浓度。最终酶活性为浓度/蛋白量,单位为μmol/(min·g)。
2结果与分析
2.1不同时期、宽度环剥处理对果实软熟品质的影响
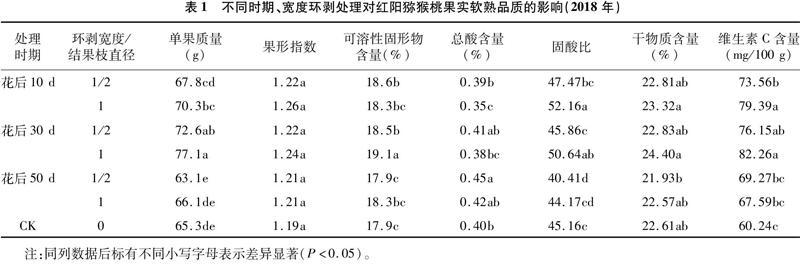
由表1可知,不同时期环剥处理均能够提高果实的果形指数,但差异不显著(P≥0.05)。同一环剥时期不同环剥宽度对果实单果质量和干物质含量无显著影响,花后10 d,环剥宽度/结果枝直径为1处理果实的总酸含量显著低于1/2处理(P<005),维生素C含量和固酸比显著高于1/2处理;花后30 d,环剥宽度/结果枝直径为1处理果实可溶性固形物含量和固酸比显著高于1/2处理;花后 50 d,不同宽度环剥处理对果实品质无显著影响。不同时期对红阳猕猴桃进行环剥处理的结果显示,当环剥宽度为结果枝直径1/2时,花后30 d处理果实的单果质量显著高于其他时期和对照;花后10 d和30 d处理果实的可溶性固形物含量和固酸比显著高于花后50 d处理。当环剥宽度等于结果枝直径时,花后30 d处理的果实单果质量和可溶性固形物含量分别达77.1 g和19.1%,显著高于其他时期处理和对照;单果质量分别较花后10、 50 d处理和对照提高9.7%、16.6%和18.1%;同时花后30 d处理果实的维生素C含量达82.26 mg/100 g,显著高于花后50 d处理和对照。
2.2环剥处理对猕猴桃果实生长的影响
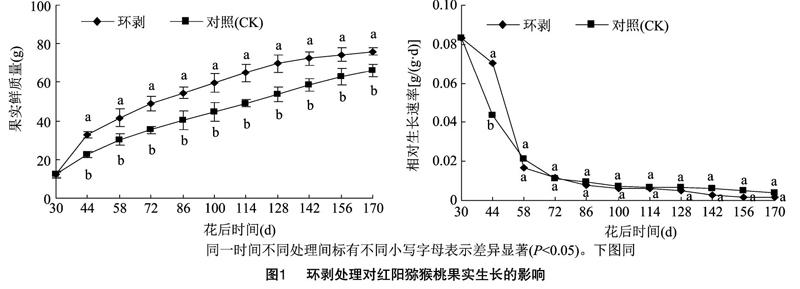
由图1可知,环剥处理和对照果实发育过程中果实鲜质量呈上升趋势。自花后44 d起,环剥处理果实单果质量均显著高于对照(P<0.05),至果实采收(花后170 d),环剥处理果实鲜质量达76.0 g,较对照增加14.8%。2个处理果实的相对生长速率随果实发育逐步下降,花后44 d,环剥处理果实的相对生长速率为0.071 g/(g·d),为对照果实的1.65倍;自花后58 d起,果实生长变缓,环剥处理和对照果实相对生长速率无显著差异。
2.3环剥处理对果形指数和果实硬度的影响
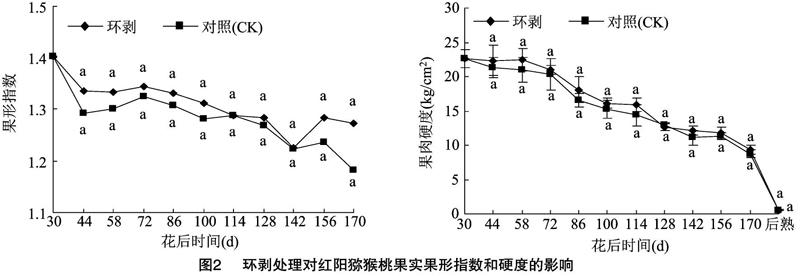
由图2可知,果形指数随红阳猕猴桃果实发育整体呈下降趋势,果形由长圆形逐步向椭圆形转变,横向逐渐膨大,在果实发育的不同时期,环剥处理和对照果实的果形指数均大于1.1,至果实采收(花后170 d),环剥处理果实果形指数为1.27,而对照果实小于1.2,但二者差异不显著。随着果实发育,果实硬度不断下降,环剥处理和对照果实硬度无显著差异,至果实成熟,两者均降至1 kg/cm2以下。
2.4环剥对果实可溶性固形物含量和维生素C含量的影响
由图3可知,环剥处理和对照果实的可溶性固形物含量有相同的变化趋势。花后30~142 d,可溶性固形物含量缓慢增加,自花后142 d开始迅速上升,果实软熟后,环剥处理果实的可溶性固形物达19.2%,较对照果实高1百分点。维生素C含量在果实发育进程中整体呈下降趋势,对照果实降幅较大,自花后86 d起,环剥处理果实的维生素C含量显著高于对照,至花后170 d及果实软熟,环剥处理果实的维生素C含量分别为87.40、84.03 mg/100 g,与对照相比增加47.1%、28.6%。
2.5环剥处理对红阳猕猴桃果实淀粉含量和可溶性糖含量的影响
由图4可知,对照果实发育进程中淀粉含量呈先上升后下降趋势,至果实接近成熟,保持稳定水平,自花后58~156 d,环剥处理果实的淀粉含量均显著高于对照。果实发育前中期,无蔗糖生成或生成极少量的蔗糖,自142 d开始,蔗糖含量迅速增加,至果实采收(花后170 d),环剥处理和对照果实蔗糖含量分别上升至18.79 mg/g和15.75 mg/g;果實软熟后,环剥处理果实蔗糖含量高达47.48 mg/g,为对照果实的1.3倍。环剥处理和对照果实的葡萄糖和果糖含量变化趋势相似,即前期维持在较低水平,发育后期开始快速积累直到果实软熟,这2种可溶性糖含量均明显提高。
2.6环剥处理对红阳猕猴桃果实有机酸含量的影响
由图5可知,环剥处理和对照果实的奎尼酸含量随果实发育不断下降,至果实采收(花后170 d),两者奎尼酸含量分别为3.52 mg/g和3.37 mg/g,无显著差异,果实软熟后,环剥处理果实的奎尼酸含量略高于对照。花后30~58 d,环剥处理和对照果实的苹果酸含量迅速上升到峰值,二者无显著差异,随后开始下降,至果实接近成熟保持稳定水平,不同的是,自花后86~170 d,对照果实的苹果酸含量高于环剥处理。柠檬酸含量在环剥处理和对照果实中整体呈先升后降的趋势,至果实软熟,柠檬
酸含量再次增加,環剥处理显著降低了果实发育进程中柠檬酸含量的峰值水平。
2.7环剥处理对红阳猕猴桃果实糖代谢相关酶活性的影响
由图6可知,对照果实AI的活性在整个发育进程中稳定保持在较低水平,花后30 d起,环剥处理AI活性迅速升高,至花后58 d到达峰值,随即保持稳定水平,花后86 d 开始快速下降,至果实采收(花后170 d),环剥处理果实的AI活性显著低于对照;环剥处理和对照果实的NI活性均较低,且变化幅度不大,不同的是,自花后114~170 d,环剥处理果实的NI酶活水平显著低于对照。
环剥处理显著提高了果实SS活性的峰值水平,且果实发育后期,环剥处理果实SS活性显著高于对照,至果实采收(花后170 d)及软熟后,二者SS活性无显著差异。对照果实SPS活性自花后30 d开始下降,至花后86 d,达活性最低水平,随后开始上升,至果实软熟再次下降;环剥处理果实SPS活性经过短暂下降后迅速上升,至花后156 d,到达峰值,随后再次迅速下降,自花后58~156 d,环剥处理果实SPS活性均显著高于对照果实。
幼果期,对照果实的AGPase活性缓慢下降,自花后86 d开始迅速上升,于花后142 d到达峰值后下降,至果实接近成熟,再次上升;环剥处理果实AGPase活性自花后86 d起迅速上升,并于花后 114 d 达到峰值,随后缓慢下降,花后58 d至果实采收期(花后170 d),环剥处理果实AGPase酶活性强度均显著高于对照处理,且环剥处理提高了AGpase
活性峰值水平,缩短了峰值出现的时间,至果实软熟,二者AGpase活性无显著差异。
3结论与讨论
环剥是目前果树生产上常用的技术手段,可以有效控制植物营养生长、促进花芽分化、提高产量和改善品质,效果良好[22-23]。然而,环剥时期和程度的不同,对果树的影响也不尽相同,故选择合适的环剥方式,对植株果实的生长发育、提高果实品质有重要作用。目前,国内外对于不同环剥条件对猕猴桃植株的影响研究鲜见报道,且观点不一。方金豹等研究发现,花后10、14 d对猕猴桃进行环剥处理均会导致猕猴桃单果质量下降[24-25],而Murakami等研究表明,花后20 d内进行环剥处理能有效提高猕猴桃果实品质[26-27],由此可见,不同猕猴桃品种对环剥时期的响应也不同。本研究发现,花后 30 d 对结果枝进行不同宽度的环剥处理,均能够显著提高猕猴桃果实的单果质量,这可能是由于花后30 d左右是红阳猕猴桃的果实膨大关键时期,此时进行环剥,切断韧皮部,阻止光合作用产生的同化物向下运输,致使环剥口上部果实营养物质积累,细胞分裂素含量水平增加,幼果期果实的相对生长速率显著上升,有效提高了细胞数量和体积,从而影响果实体积和单果质量[28-29]。维生素C具有抗氧化能力,对防治贫血、提高免疫力具有重要作用[30],但人体本身不能合成维生素C,只能从食物中摄取[31],猕猴桃被称为“维生素C之王”,维生素C含量是猕猴桃的一项重要品质指标。本研究发现,环剥处理对果实维生素C含量有诱导提高的作用。Arakawa 等在苹果上也取得相似结果[32-33],但环剥时期和环剥宽度的不同对果实品质产生的影响也不同,花后10 d和花后30 d处理果实的维生素C含量均显著高于对照,其中又以宽度/结果枝直径为1的环剥处理效果更佳,这可能是由于早期进行环剥处理能够有效缓解维生素C含量的降解。Yang 等研究发现,环剥虽然增加了果实维生素C含量,却没有上调维生素C合成途径相关基因的表达水平[34],维生素C含量受环剥处理刺激增长的机制至今仍不清楚,有待后续研究。关于环剥影响可溶性糖含量和可溶性固形物含量变化的报道不一,Parrott等对苹果树进行环剥试验研究发现,苹果果肉的可溶性糖和可溶性蛋白含量较对照降低[35],但也有研究表明,环剥处理诱导显著提升了可溶性糖和可溶性固形物含量[36-37]。在本研究中,不同处理果实软熟后,仅花后30 d,环剥宽度/结果枝直径为1的处理可溶性固形物和可溶性糖含量水平均较对照显著上调,这可能是由于该环剥处理方案有效刺激淀粉含量在果实发育期的积累增加,果实软熟,更多的淀粉转变为可溶性糖。
糖代谢途径相关酶酶活水平的变化是调节果实库强(衡量果实获取同化物能力的重要指标)大小的关键要素,同时果实发育过程中糖分的转化也和糖代谢酶活强度紧密相关[38-39]。果实蔗糖代谢途径相应酶活水平的变化调控可溶性糖的变化和积累。其中,转化酶(AI、NI)具有蔗糖专一性[40-41],不可逆地将蔗糖分解为己糖,是蔗糖积累的限速步骤。本研究发现,环剥处理显著降低了发育后期果实AI、NI的活性,进一步证实转化酶活水平的下调是蔗糖含量增加的重要因素[42-44]。蔗糖磷酸合成酶、蔗糖合成酶是蔗糖代谢途径的关键酶[45]。前人研究表明,果实蔗糖积累伴随着SPS活性上升[46-48]。本研究发现,果实发育中后期,环剥处理显著提高了SS活性,花后58~156 d,对照果实的SPS酶活性强度显著低于环剥处理,转化酶(AI、NI)活性的降低以及合成酶(SS、SPS)活性的上升,是环剥处理果实蔗糖含量显著高于对照的主要原因。果实糖的积累类型分为糖直接积累型、淀粉转化型和中间转化型3类。猕猴桃属于典型的淀粉转化型水果[49],叶片光合产生同化物输送到果实后,部分用于支撑果实相关新陈代谢活动,部分同化物以淀粉形式贮藏于果实。腺苷二磷酸葡萄糖焦磷酸化酶是调节淀粉生物合成的关键酶[50]。Müller-Rber等的研究表明,植物组织中淀粉含量与AGPase酶活性的变化趋势相似[51]。抑制AGPase活性将导致淀粉生物合成受阻,同时反义转化AGPase基因也将抑制淀粉的积累[52]。本研究发现,环剥处理诱导了AGpase活性的提高,这可能是环剥处理果实淀粉含量显著高于对照的重要原因之一。
本研究结果表明,花后30 d,环剥宽度/结果枝直径为1的结果枝环剥处理可明显提升猕猴桃果实鲜质量、可溶性固形物含量、维生素C含量,并通过调控糖代谢途径相关酶活水平,增加了红阳猕猴桃可溶性糖含量,且操作方便,是一种可行的、有效的农业物理技术手段。
参考文献:
[1]王仁才,熊兴耀,刘昆玉,等. 美味猕猴桃果实常温贮藏性能研究[J]. 湖南农学院学报(自科版),1993,19(6):558-563.
[2]王绍华,杨建东,段春芳,等. 猕猴桃果实采后成熟生理与保鲜技术研究进展[J]. 中国农学通报,2013,29(10):102-107.
[3]陈敏. 生长调节剂和叶果比对红阳猕猴桃果实生长发育和品质影响的研究[D]. 雅安:四川农业大学,2009.
[4]Takahashi S,Shudo K,Okamoto T,et al. Cytokinin activity of N-phenyl-N-(4-pyridyl)urea derivatives[J]. Phytochemistry,1978,17(8):1201-1207.
[5]Famiani F,Battistelli A,Moscatello S,et al. Thidiazuron affects fruit growth,ripening and quality of Actinidia deliciosa[J]. Journal of Horticultural Science and Biotechnology,1999,74(3):375-380.
[6]Famiani F,Battistelli A,Moscatello S,et al. Thidiazuron increases current-year fruit size and production in Actinidia deliciosa without decreasing return bloom[J]. Journal of Horticultural Science and Biotechnology,2002,77(1):116-119.
[7]Famiani F,Proietti P,Pilli M,et al. Effects of application of thidiazuron (TDZ),gibberellic acid (GA3 ),and 2,4-dichlorophenoxyacetic acid (2,4-D) on fruit size and quality of Actinidia deliciosa‘Hayward[J]. New Zealand Journal of Crop and Horticultural Science,2007,35(3):341-347.
[8]李圆圆,罗安伟,李琳,等. 采前氯吡脲处理对‘秦美猕猴桃贮藏期间果实硬度及细胞壁降解的影响[J]. 食品科学,2018,39(21):273-278.
[9]王玮,何宜恒,李桦,等. CPPU处理对‘华优猕猴桃品质及耐贮性的影响[J]. 食品科学,2016,37(6):261-266.
[10]郭琳琳,张桂兰,黄玉南,等. 采前CPPU处理对采后草莓品质及残留量的影响[J]. 北方园艺,2017(3):141-145.
[11]梁春辉,陈惠敏,李娟,等. 环割对柑橘叶片衰老的影响[J]. 园艺学报,2018,45(6):1204-1212.
[12]戴宏芬,邱燕萍,袁沛元,等. 螺旋环剥对幼龄‘桂味荔枝果期光合和蒸腾作用的影响[J]. 园艺学报,2010,37(8):1241-1246.
[13]任俊鵬,李小红,董瑞奇,等. 环剥和脱落酸处理对‘夏黑葡萄果实着色及相关基因表达的影响[J]. 果树学报,2013,30(6):968-974,1107.
[14]吴定尧,邱金淡,张海岚,等. 环割促进龙眼成花的研究[J]. 中国农业科学,2000,33(6):40-43.
[15]吴黎明,蒋迎春,周民生,等. 环割对金水柑树体生长、树体营养及果实品质的影响[J]. 湖北农业科学,2009,48(11):2762-2766.
[16]Rivas F,Erner Y,Alós E,et al. Girdling increases carbohydrate availability and fruit-set in citrus cultivars irrespective of parthenocarpic ability[J]. Journal of Horticultural Science & Biotechnology,2006,81(2):289-295.
[17]Moscatello S,Famiani F,Proietti S,et al. Sucrose synthase dominates carbohydrate metabolism and relative growth rate in growing kiwifruit (Actinidia deliciosa cv. Hayward) [J]. Scientia Horticulturae,2011,128(3):197-205.
[18]Kampfenkel K M,Vanmontagu M,Inzé D. Extraction and determination of ascorbate and dehydroascorbate from plant tissue[J]. Analytical Biochemistry,1995,225(1):165-167.
[19]徐昌杰,陈文峻,陈昆松,等. 淀粉含量测定的一种简便方法——碘显色法[J]. 生物技术,1998,8(2):41-43.
[20]沈志军,马瑞娟,俞明亮,等. 红肉桃与其他肉色类型桃糖酸组分的比较[J]. 江苏农业学报,2012,28(5):1119-1124.
[21]姚改芳,杨志军,张绍铃,等. 梨不同栽培种果实有机酸组分及含量特征分析[J]. 园艺学报,2014,41 (4):755-764.
[22]Olesen T,Menzel C M,McConchie C A,et al. Pruning to control tree size,flowering and production of Litchi[J]. Scientia Horticulturae,2013,156(3):93-98.
[23]Li C B,Xiao Y. Girdling increases yield of Nuomici litchi[J]. Acta Horticulturae,2001,558(34):233-235.
[24]方金豹,田莉莉,陈锦永,等. 猕猴桃源库关系的变化对果实特性的影响[J]. 园艺学报,2002,29(2):113-118.
[25]涂美艳,陈栋,李靖,等. 环割对“Hort 16A”猕猴桃枝叶营养和果实品质的影响[J]. 四川农业大学学报,2020,38 (1):79-86.
[26]Murakami S. Effect of girdling methods on fruit quality in ‘Rainbow Red kiwifruit (Actinidia chinensis) [J]. Horticultural Research,2012,11(2):281-287.
[27]黄春辉,汤佳乐,冷建华,等. 环剥处理对“金魁”猕猴桃果实品质的影响[J]. 中国南方果树,2013,42(5):24-27.
[28]Dannenmann M,Simon J,Gasche R,et al. Tree girdling provides insight on the role of labile carbon in nitrogen partitioning between soil microorganisms and adult European beech[J]. Soil Biology and Biochemistry,2009,41(8):1622-1631.
[29]李道高. 环割和GA对柑橘花芽分化和碳氮以及GA含量的影响[J]. 西南农学院学报,1984,6(3):31-37.
[30]Loewus F A,Loewus M W,Seib P A. Biosynthesis and metabolism of ascorbic acid in plants[J]. Critical Reviews in Plant Sciences,1987,5(1):101-119.
[31]Naidu K A. Vitamin C in human health and disease is still a mystery? An overview[J]. Nutrition Journal,2003,2:7.
[32]Arakawa O,Kanetsuka A,Kanno K,et al. Effects of five methods of bark inversion and girdling on the tree growth and fruit quality of ‘Megumi apple[J]. Engei Gakkai Zasshi,1998,67(5):721-727.
[33]Mostafa E A M,Saleh M M S. Response of balady mandarin trees to girdling and potassium spray sunder sandy soil conditions[J]. Rerearch Journal of Agriculture and Biological Science,2006,2(3):137-141.
[34]Yang X Y,Wang F F,Teixeira da Silva J A,et al. Branch girdling at fruit green mature stage affects fruit ascorbic acid contents and expression of genes involved in l-galactose pathway in Citrus[J]. New Zealand Journal of Crop & Horticultural Science,2013,41(1):23-31.
[35 ]Parrott D L,McInnerney K,Feller U,et al. Steam-girdling of barley (Hordeum vulgare) leaves leads to carbohydrate accumulation and accelerated leaf senescence,facilitating transcriptomic analysis of senescence-associated genes[J]. New Phytologist,2007,176(1):56-69.
[36]劉大顺,覃堂明,刘光明. 螺旋环割在琯溪蜜柚保果及产量上的效应[J]. 浙江柑橘,2005,22(2):28-29.
[37]Day K R,Dejong T M. Girdling of early season‘Mayfirenectarine trees[J]. Journal of Pomology & Horticultural Science,1990,65(5):529-534.
[38]Sun J D,Loboda T,Sung S J,et al. Sucrose synthase in wild tomato,Lycopersicon chemielelewskii,and tomato fruit sink strength[J]. Plant Physiology,1992,98(3):1163-1169.
[39]Lowell C A,Tomlinson P T,Koch K E. Sucrose-metabolizing enzymes in transport tissues and adjacent sink structures in developing citrus fruit[J]. Plant Physiology,1989,90(4):1394-1402.
[40]Gallagher J A,Pollock C J. Pollock Isolation and characterization of a cDNA clone from Lolium temulentum L. encoding for a sucrose hydrolytic enzyme which shows alkaline/neutral invertase activity[J]. Journal of Experimental Botany,1998,49(322):789-795.
[41]Vargas W,Cumino A,Salerno G L. Cyanobacterial alkaline/neutral invertases. Origin of sucrose hydrolysis in the plant cytosol? [J]. Planta,2003,216(6):951-960.
[42]Hubbard N L,Pharr D M,Huber S C. Sucrose phosphate synthase and other sucrose metabolizing enzymes in fruits of various species[J]. Physiologia Plantarum,1991,82(2):191-196.
[43]Rolland F,Moore B,Sheen J. Sugar sensing and signaling in plants[J]. Plant Cell,2002,14(suppl1):S185-S205.
[44]曾海琼,廖玲,熊博,等. 套袋对清见橘橙果实蔗糖代谢的影响[J]. 食品科学,2015,36(14):276-279.
[45]Basson C E,Groenewald J H,Kossmann J,et al. Sugar and acid-related quality attributes and enzyme activities in strawberry fruits:Invertase is the main sucrose hydrolysing enzyme[J]. Food Chemistry,2010,121(4):1156-1162.
[46]Komatsu A,Takanokura Y,Moriguchi T,et al. Differential expression of three sucrose-phosphate synthase isoforms during sucrose accumulation in citrus fruits (Citrus unshiu Marc. ) [J]. Plant Science,1999,140(2):169-178.
[47]Grof C P L,Albertson P L,Bursle J,et al. Sucrose-phosphate synthase,a biochemical marker of high sucrose accumulation in sugarcane [J]. Crop Science,2007,47(4):1530-1539.
[48]徐臣善,徐爱红,萧蓓蕾,等. 授粉品种对红富士苹果果实糖积累及其代谢相关酶活性的影响[J]. 江苏农业学报,2021,37(1):121-128.
[49]Wegrzyn T,Macrae E. Alpha-amylase and starch degradation in kiwifruit [J]. Journal of Plant Physiology,1995,147(1):19-28.
[50]Allicora M A,Iglesiasa A A,Preiss J. ADP-glucose pyrophosphorylase:A regulatory enzyme for plant starch synthesis[J]. Photosynthesis Research,2004,79(1):1-24.
[51]Müller-Rber B T,Kossmann J,Hannah L C,et al. One of two different ADP-glucose pyrophosphorylase genes from potato responds strongly to elevated levels of sucrose[J]. Molecular and General Genetics,1990,224(1):136-146.
[52]Munyikwa T R I,Kreuze J,Fregene M,et al. Isolation and characterisation of cDNAs encoding the large and small subunits of ADP-glucose pyrophosphorylase from cassava (Manihot esculenta Crantz)[J]. Euphytica,2001,120(1):71-83
基金項目:江苏省镇江市农业科技专项(编号:ZJNJ201801)。
作者简介:杨勇(1990—),男,安徽宁国人,硕士,助理研究员,主要从事果树栽培技术及品质研究。E-mail:yl0656@163.com。
通信作者:阎永齐,硕士,副研究员,主要从事果树栽培技术研究。E-mail:2834907240@qq.com。

