绣球属植物组织培养研究进展
秦紫艺 陈双双 王华娣 邓衍明
摘要:绣球属植物是园林和家庭园艺中重要的观赏植物,具有较高的生态和经济价值,开发应用前景广阔。开展绣球属植物繁育技术研究对其资源开发、保护与应用具有重要意义。与传统扦插、压条、分株等育苗技术相比,组织培养技术能够满足种苗周年、批量生产的要求,可有力地促进绣球属植物的产业化开发与利用。对国内外绣球属植物的组织培养技术进行了综述,包括外植体材料的选择、外植体的消毒方法、植物生长调节剂的影响、培养条件等,旨在通过总结前人经验和方法,为建立更多绣球属优良植物资源的高效再生体系和遗传转化体系提供参考。
关键词:绣球属;组织培养;再生;研究进展
中图分类号: S685.990.4+3文献标志码: A文章编号:1002-1302(2021)19-0045-06
繡球属(Hydrangea)又名八仙花属[1],为虎耳草科落叶灌木或小乔木。中国是绣球属植物的资源分布中心和起源中心之一,具有丰富的种质资源,共有46种10变种[2]。绣球属植物适应性强,具有耐寒、耐阴、抗性强和病虫害少等优点,种植范围和适应区域较广[3]。绣球属植物花型多样,花期较长,花色丰富,包含了白色系、红色系、蓝色系等,被广泛应用于园林景观及盆花、鲜切花等产业[4]。绣球属植物因萼片富含常山酚、绣球酚等物质而可作为抗疟疾、降血糖、治疗心悸烦躁的入药良材[5]。此外,很多绣球品种的花色可随土壤酸碱度的变化而变化,当土壤为强酸性时,花色呈蓝色,而当土壤为碱性时,花色为红色,使其可以作为土壤酸碱度的指示植物[6]。总之,绣球属植物具有较高的观赏、经济、药用及生态价值,产业化开发前景十分广阔。
绣球属植物的花多为不孕花,较难获得种子,故关于绣球有性繁殖的报道较少。目前,绣球属植物传统繁殖方式主要是无性繁殖,包括扦插、分株、压条等[7]。但无性繁殖方式因其繁殖系数低、速度慢、易受季节限制无法进行周年繁殖等缺点而不能大规模生产种苗。植物组织培养技术可以在保持母本优良性状的前提下实现周年、快速繁殖从而获得大量种苗,有效弥补传统无性繁殖方式的不足。此外,组培的环境条件可控,获得的组培苗在植物基因工程、分子育种等领域也具有重要作用。因此,本综述综合了国内外相关研究文献,对绣球属植物组织培养的现状进行了归纳和分析,并对下一步研究方向进行了建议,旨在为今后更多绣球属优良植物资源的组织培养和高效遗传转化体系的建立提供参考。
1无菌苗的获得
1.1外植体材料的选择
外植体的选择是植物组织培养的第一步,也是非常重要的一环,不同的外植体类型对植物组织培养的影响差异甚大。绣球属植物组织培养中常用的外植体材料有茎尖、茎段、叶片等。有学者用八仙花叶片、茎段和茎尖为外植体,探究组织培养中的污染率和死亡率,结果发现,利用叶片污染率较低,但是难以形成愈伤组织,而利用茎尖污染率和死亡率都较低,分别为21.4%、18.5%[8-9]。王红梅等比较了侧芽、基部侧芽、顶芽和带顶芽的侧芽后,发现基部侧芽的萌发率最高[10]。同时,以叶柄为外植体的研究发现,中部叶柄愈伤组织诱导率比上部叶柄高[11]。此外,也有很多学者以叶片作为外植体,通过愈伤组织诱导建立高效的再生体系[12-14]。研究发现,由于生理状态和年龄的不同,即使同一植株上的同一种器官,其诱导分化情况也不同,通常外植体越幼嫩、分生能力越强[15]。虽然绣球属植物结实率低,但也有以种子和花粉为外植体进行组织培养的研究。陈爽等以种子为外植体虽获得了无菌苗,但仅限于“蜡莲绣球”“莼兰绣球”等较易获得种子的品种[16]。周静伟以花药(花粉发育处于单核靠边期)为外植体,其愈伤组织诱导率仅有36.7%[17]。由此可见,绣球属植物组织培养宜以叶片、茎尖和带腋芽茎段作为外植体,污染率低、诱导率高。
1.2外植体消毒
外植体消毒常用试剂有75%乙醇、氯化汞(HgCl2)和次氯酸钠溶液。乙醇因其穿透力强,可以使菌体蛋白变性,还可以排除外植体表面的空气有利于其他消毒剂的进入,被广泛用于外植体消毒的第一步[18]。但乙醇消毒时间长易导致外植体死亡、时间短不能彻底消毒,因此要结合其他消毒剂共同处理外植体。不同的消毒剂处理不同的时间,外植体的污染率及存活率也不同。
对于茎尖、茎段的消毒,冯润东等[8]和邢合龙等[9]的研究中利用70%乙醇浸泡30~45 s,再用01%HgCl2对绣球花茎段和茎尖消毒 7 min,外植体污染率最低。也有学者在70%乙醇消毒30 s后用0.1%HgCl2溶液分别灭菌8、10 min,同样可以达到较好的消毒灭菌效果[19-20]。因此,利用70%乙醇和0.1% HgCl2溶液结合使用时,HgCl2灭菌时间一般可控制在7~10 min。HgCl2消毒易引起外植体的褐化,如王红梅等对圆锥绣球“北极熊”的茎段用HgCl2消毒4 min,外植体褐化率较低,但由于外植体表面密被表皮毛,会消毒不彻底导致外植体的污染率比较高,而用HgCl2不间断消毒 8 min,污染率降低,但是褐化率会增加,故选择采用(4+4)min的HgCl2二次灭菌法,即用HgCl2分2次进行消毒,首次消毒4 min后,无菌水冲洗并用滤纸吸干外植体表面的水分再进行第2次消毒[10]。对于绣球属植物花药和种子,利用HgCl2溶液可以得到较好的消毒效果[16-17]。
由于HgCl2溶液毒性较大,使用不当会对绣球外植体造成损伤,因此,也有研究采用多种消毒试剂结合的方法进行灭菌。如对“Preziosa”的茎段利用0.1% HgCl2灭菌7 min后,再用饱和漂白粉上清液消毒8 min[21],以及对“红宝石”的茎段利用01%HgCl2灭菌3 min后,再利用2%次氯酸钠(NaClO)灭菌6 min[22],都可以获得污染率较低的无菌外植体。Raffoni等利用2.5% NaClO溶液和0.2%~0.4% HgCl2溶液对“Snow Queen”的茎段消毒可以达到100%灭菌率,但考虑到HgCl2废液不环保,认为选用5% NaClO溶液浸泡15 min进行消毒是最佳方案[23]。Liu等也认为应避免使用HgCl2溶液,用活性氯浓度为1%的次氯酸钠并添加Tween 20润湿剂浸泡“Hyd1”茎段可以取得较好的消毒效果[24]。Tween 20是一种非离子型表面活性剂,在消毒剂中添加Tween 20可以增强消毒效果[25]。这些研究表明,除HgCl2溶液外,次氯酸钠溶液是使用最广泛的消毒剂。总之,对绣球属植物外植体的消毒,要结合不同类型的外植体选择合适的消毒试剂和消毒时间以达到理想的消毒效果。
2基本培养基的选择
对于植物组织培养来说,培养基的成分对外植体的生长发育具有直接的影响。近年来,国内大部分研究者都采用MS培养基(Murashige and Skoog medium)作为绣球属植物的基本培养基[20,21,26]。MS培养基最初被用于烟草的愈伤组织培养,后来逐渐被广泛用于其他植物的组织培养[27],但并不是所有植物都适用于MS培养基。王海娥比较了MS、1/2 MS、1/4 MS基本培养基在启动培养和增殖培养阶段的培养效果,发现对于朗姆系绣球不同品种最适宜的基本培养基并不一样:“绣球”以1/2 MS为宜,“柏林”和“蝴蝶戏珠”以1/4 MS为宜,而“蓝星”则以MS为宜[26]。陈爽比较了MS培养基和WPM培养基(woody plant medium)对“莼兰绣球”和“蜡莲绣球”增殖的影响,发现MS培养基更适合这2个品种绣球的增殖,分析认为可能是由于MS培养基中丰富的无机盐和氮源对促进生长有利[16]。李杨丽研究发现,MS培养基并不适合其研究的绣球品种“Hyd1”,而B5(Gamborgs B-5 medium)和WPM作为基础培养基,可促进增殖芽的伸长;采用B5培养基时,外植体生根率较高[28]。进一步研究发现,与MS和WPM相比,B5培养基的铵盐浓度较低,可促进“Hyd1”叶片外植体的不定芽形成[24,29]。但在蒋梦烟的研究中,1/2 MS、MS、B5这3种基本培养基对绣球品种“蓝尼康”的愈伤组织诱导并无明显差异[30]。比较MS、B5、WPM培养基的成分,可以发现几种培养基中的NH+4、NO-3、SO2-4的含量有明显差异,MS培养基和B5培养基中NH+4、NO-3含量較高,而WPM培养基中SO2-4含量较高[31]。因此,基本培养基的选择不仅受外植体的基因型影响,不同培养基中大量元素的差异也是需要考虑的重要因素。
3植物生长调节剂的影响
除了基本培养基的基础成分外,培养基中添加的植物生长调节剂种类和配比对于外植体的生长、增殖和分化也都具有不同的影响[32]。
3.1直接再生途径
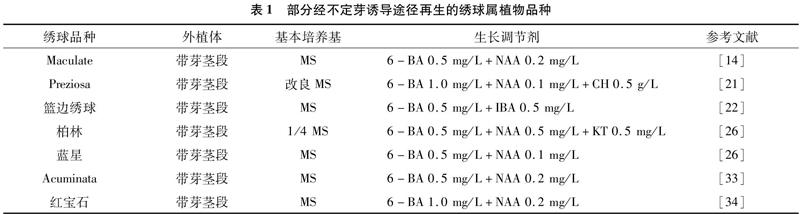
直接再生途径又叫不定芽诱导途径,是指外植体直接诱导分化产生器官的途径。截至目前,该途径已广泛用于绣球属植物以获得再生植株(表1)。绣球属植物不定芽诱导途径多以6-BA(6-苄氨基嘌呤)和NAA(α-萘乙酸)或IBA(3-吲哚丁酸)为外源植物生长调节剂。在Liu等的研究中,当6-BA/IBA值从1.0/0.05提高到3.5/0.05时,不定芽再生频率相应增加;而在2.25/0、2.25/005、2.25/0.1和2.25/0.2范围内变化时,器官发生频率呈抛物线形变化[24]。殷丽青在改良MS培养基[MS+Ca(NO3)2 556 mg/L]中添加不同比例 6-BA 和NAA处理绣球“Preziosa”发现,过高的 6-BA 会抑制芽的发生,而过高的NAA会出现芽细弱、基部产生愈伤组织等现象。这些结果表明,细胞分裂素/生长素的值与不定芽再生频率密切相关。但也有学者认为生长调节剂的有无、种类、浓度及配比对器官发生影响不显著,但对新稍伸长影响较大[22]。此外,培养基中添加GA3(赤霉素A3)也可以提高芽的诱导率、促进芽的伸长[19]。
3.2间接再生途径
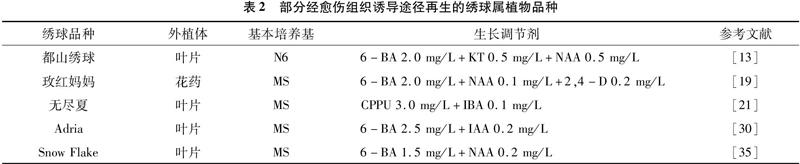
间接再生途径又被称为愈伤组织诱导途径,是先使外植体脱分化成愈伤组织、愈伤组织再分化成器官并最终形成完整植株的过程。近年来,国内外关于绣球属植物通过愈伤组织诱导途径进行组织培养的报道已有不少(表2)。在该途径中,最主要的影响因素是外源激素的类型和浓度。诱导愈伤常用的外源激素有6-BA、NAA、2,4-D(2,4-二氯苯氧乙酸)、KT(6-糠基氨基嘌呤)、CPPU[N-(2-氯-4-吡啶基)-N′-苯基脲]等;在细胞分裂素中,6-BA的使用率较高,通常以1.5~2.5 mg/L 为宜[11,14,35]。杨宝明等认为,在相同浓度的6-BA条件下,配合2,4-D和NAA均能诱导出愈伤组织,且2,4-D的诱导效果要比NAA好;但是2,4-D浓度过高则会造成愈伤组织结构松散而不易分化成不定芽[11]。CPPU是一种人工合成的细胞分裂素,其活性高且价格低廉,被广泛应用于植物组织培养中[36]。孙晓波等发现,大花绣球“无尽夏”叶片在CPPU+IBA(或NAA)激素组合培养基上的愈伤诱导率高达95%[20]。通常情况下,选择较高浓度的细胞分裂素和较低浓度的生长素,有利于愈伤组织的分化[25]。
3.3增殖培养
增殖培养又叫继代培养,是组织培养中实现快速繁殖的重要步骤。细胞分裂素和生长素是增殖培养中常用的生长调节剂组合。雷亚灵等认为,适合芽增殖的培养基为MS+3.0 mg/L 6-BA+0.1 mg/L IBA,增殖系数为9. 2[22]。有的研究在增殖培养基中添加赤霉素,如王海娥发现以1/4 MS+3.0 mg/L 6-BA+0.2 mg/L NAA+0.1 mg/L CA3为增殖培养基时,增殖系数可达14.32[26]。李杨丽等以B5+1.5 mg/L 6-BA+0.6 mg/L CA3为增殖培养基时,增殖系数最高,但只有3.7[28]。除6-BA外,KT(细胞分裂素)也被用于增殖培养,如用MS+1.5 mg/L 6-BA+0.5 mg/L KT+0.5 mg/L IBA培养“都山绣球”,增殖率可达2.85倍[14]。也有研究发现,增殖培养基(MS+0.5 mg/L 6-BA+0.04 mg/L NAA)中添加腺嘌呤可促进增殖,提高增殖系数[19]。虽然增殖培养基以细胞分裂素和生长素组合作为外源激素的研究居多,但也有报道认为增殖培养基中添加任意浓度的6-BA都可以得到较高的不定芽增殖率和鲜质量,而且不定芽长度与细胞分裂素浓度无关[24-25]。根据以上研究可见,绣球属植物增殖培养使用的植物生长调节剂种类较多,但常用的只有6-BA、NAA、IBA等。
3.4生根培养
绣球属植物生根相对容易,组织培养中较常用的方法是瓶内生根。生根培养一般选择大量元素减半的培养基,这是因为在生根过程中,植物对大量元素的需求已明显降低[37]。不同类型不同浓度的植物生长调节剂对绣球生根诱导的效果存在差异。龚伟等在1/2 MS培养基上添加0.1 mg/L的NAA,绣球生根率达82.5%[38],添加0.2 mg/L或 0.3 mg/L IBA时,生根率也较高[9,35]。也有研究表明,NAA和IBA配合使用比单独使用效果好,如利用1/2 MS+0.25 mg/L NAA+0.25 mg/L IBA为生根培养基时,圆锥绣球生根率可达95%,且生根快、根数多[11]。赵盈盈等认为最适宜绣球品种“Adria”的生根培养基为1/2 MS+蛭石 ∶珍珠岩(1 ∶1),即使不添加激素,生根率也可达100%,且根系发达、生长健壮[13]。Liu等在含有珍珠岩的1/2 B5培养基上添加0.5 mg/L NAA,绣球“Hyd1”的生根数达每株7.1条,远高于在琼脂中培养的生根数[24]。分析认为,不仅是因为珍珠岩基质相对于琼脂更透气,而且琼脂中的不定芽只在培养基以外的茎段处生细小的根,这些根不接触培养基,无法吸收营养,导致不定芽生长缓慢[39]。也有文献报道在生根培养基中添加3 g/L活性炭可以促进生根,生根率达100%[19]。活性炭可为组培苗提供生根暗环境,吸附植物生长调节剂等有利于生根的物质[40],但活性炭的浓度不宜过高,否则将会抑制生根[41]。除了瓶内生根方法外,还有瓶外生根法。龚伟等将组培苗转移到经过福尔马林消毒的基质(珍珠岩 ∶蛭石=1 ∶1)中,在湿度大于85%的条件下培养,生根率可达100%[38]。
4炼苗移栽
组培苗叶绿素含量少,光合自养能力弱,根毛细软,适应能力较差,需要经过驯化炼苗逐渐改变生长条件以提高其对外界环境的适应能力[42]。影响绣球属植物组培苗移栽成活率的重要因素有组培苗的质量、空气湿度、移栽基质等[22]。在移栽之前,需将诱导获得的生根苗在室温散射光下培养 3 d,再打开封口膜于温室大棚预炼苗3 d,并于移栽时洗去根部培养基[33]。气温低时,炼苗时间可适当延长;气温高时因培养基易污染,需缩短炼苗时间[43]。另外,绣球属植物组培苗通常在高湿、恒温、弱光条件下培养,若移出培养基后水分不足,将直接导致幼苗失水死亡,所以除了每天向植株叶面喷雾外,初期还应用薄膜覆盖保湿一段时间[22]。
移栽时,应选择根系发达、茎秆粗壮、叶片深绿和木质化程度较高的组培苗[14]。有研究表明,绣球“蓝尼康”已生根的健壮苗移栽成活率可达到92%,且根系生长快、根数量多,而无根苗的移栽成活率仅为14%,很难成活[30]。绣球属植物组培苗移栽的基质通常用泥炭土、珍珠岩、蛭石、腐殖土等,移栽所用基质应先高温灭菌再使用。Thomas等为了使栎叶绣球离体生根的植物适应温室条件,将栎叶绣球组培苗移栽到泥炭土 ∶蛭石 ∶珍珠岩=3 ∶1 ∶1的基质中,然后覆盖塑料薄膜,放回培养室4周后,再转移到温室中[44]。也有研究表明,将绣球组培苗移栽到珍珠岩 ∶蛭石=1 ∶1的基质中,成活率为896%[38];移栽到蛭石 ∶腐殖土=1 ∶2的基质中,成活率达92%[14];栽入珍珠岩 ∶腐殖土=1 ∶2的培养钵中,成活率达90%以上[33]。但Preece等认为组培苗的移栽成活率与移栽基质比例无关,只要移栽到泥炭+蛭石+珍珠岩的培养基质中,其适应能力都很好且生长旺盛[45]。此外,炉灰渣也是一种优良的移栽基质,有学者比较用于移栽绣球的炉灰渣和珍珠岩 ∶蛭石=1 ∶1的基质,发现炉灰渣的移栽成活率达97.5%,且组培苗长势良好[46]。炉灰渣取材方便,透气性好,不仅是组培苗移栽的优良基质,也是其他育苗方式的优良基质[47]。
5培养条件
除了上述因素外,组织培养所处的温度、湿度、光照等培养条件也是保证整个培养过程顺利进行的重要因素[48]。组培瓶内的湿度一般能达饱和状态,通常不予考虑[49]。在已有的绣球组织培养研究中,培养温度基本保持在(25 ± 2) ℃[13,17,50]。光照条件对于绣球属植物的不定芽诱导、愈伤组织的诱导和分化都有着显著的影响。Liu等将“Hyd1”外植体经暗培养之后,再置于光—暗周期14 h—10 h下孵育,冷白光照射,光照度为3 300 lx,芽诱导率高达100%[24]。周静伟等将“玫红妈妈”的花药接种到培养基后,先在弱光条件下培养30 d,待诱导出愈伤组织后转入光照1 800~2 500 lx下培养,每天光照培养12 h,愈伤诱导率为37.6%[17]。还有学者将“Hyd1”叶片置于红光和蓝光下,发现不定芽被提前诱导产生,且不定芽较白光下生长更健壮[51]。由此可见,绣球属植物组织培养中光照度、光—暗周期及光质等都发挥着重要作用。因此,在绣球组织培养过程中,应研究并优化培养所需的温度、光照等培养条件。
6展望
绣球属植物的组织培养技术对于优质种苗生产、新品种选育、遗传转化和种质资源保护利用等都具有重要意义。目前,国内外研究人员围绕大花绣球“无尽夏”、圆锥绣球“北极熊”等开展了大量的组织培养相关研究,取得了较大的进展。但是,在此过程中还有一些问题需要进一步深入研究:(1)部分基因型建立无菌体系困难,污染率高;(2)增殖培养过程中玻璃化和褐化严重,影响增殖芽生长和分化,甚至导致死亡;(3)外植體类型较单一,以茎段为主,其他器官高效再生体系尚不成熟;(4)不定芽分化率仍较低等。此外,目前的绣球组织培养研究主要集中在无菌体系、再生体系的建立,而关于绣球属植物遗传转化体系、原生质体培养与再生等方面的研究报道较少。因此,未来针对绣球属植物组织培养方面的研究应重点聚焦于高效再生体系和遗传转化体系的建立,为培育优良新品种、开展基础研究等奠定理论和技术基础。
参考文献:
[1]乔谦,王江勇,陶吉寒. 绣球属植物研究进展[J]. 农学学报,2020,10(4):60-64.
[2]中国科学院中国植物志编辑委员会. 中国植物志:第三十五卷第一分册[M]. 北京:科学出版社,1995:201-257.
[3]任倩倩,郑建鹏,张京伟,等. 绣球属抗逆性研究进展[J]. 安徽农业科学,2020,48(11):26-28.
[4]闵祥凤,姜卫兵,魏家星. “绣球”类观赏植物资源探究及应用开发[J]. 中国城市林业,2017,15(1):60-63.
[5]冯卫生,张艳丽,郑晓珂,等. 绣球花的化学成分研究[J]. 中国药学杂志,2011,46(8):576-579.
[6]邓衍明,韩勇,齐香玉,等. 绣球属植物种质资源分析及其花色可调性和叶斑病抗性比较[J]. 植物资源与环境学报,2018,27(4):90-100.
[7]曾奕,杨伟权,郁书君. 绣球花的育种研究进展[J]. 广东农业科学,2018,45(6):36-43.
[8]冯润东,孙宏刚. 八仙花组织培养繁殖技术[J]. 北华大学学报(自然科学版),2011,12(3):350-352.
[9]邢合龙,原会营,马开,等. 八仙花组织培养技术的研究[J]. 防护林科技,2010(5):48-49,55.
[10]王红梅,刘春风,孟紫莲,等. 圆锥绣球‘北极熊组培快繁体系的建立[J]. 分子植物育种,2021(7):2305-2311.
[11]杨宝明,苏艳,黄玉玲,等. 八仙花叶柄离体培养和植株再生技术研究[J]. 山西农业科学,2018,46(2):159-162.
[12]Boccon-Gibod J,Billard C,Maltete S. In vitro regeneration system of Hydrangea macrophylla plantlets from leaves and internodes[J]. Acta Horticulturae,2000,508(32):229-231.
[13]赵盈盈,彭尽晖,陈小超,等. 八仙花叶片诱导再生技术[J]. 湖南农业科学,2015(4):81-84,87.
[14]池景存,黄守印,杨福林. 都山绣球的愈伤组织培养与植株再生[J]. 植物生理学通讯,2009,45(8):801-802.
[15]朱大保. 国外杨树组培微繁技术的进展[J]. 北京林业大学学报,1990,12(1):84-91.
[16]陈爽,李叶华,赵冰. 2种野生绣球花组培及快繁技术研究[J]. 种子,2020,39(4):60-63,70.
[17]周静伟,吴晓梦,陈海霞. 八仙花花药培养诱导愈伤组织[J/OL]. 分子植物育种:1-11(2020-09-16)[2021-06-09]. http://kns.cnki.net/kcms/detail/46.1068.S.20200915.1851.010.html.
[18]黄作喜,邱超,曾桢迦,等. 植物组织培养中消毒剂的应用研究进展[J]. 内江师范学院学报,2013,28(6):26-30.
[19]王忠武,建德鋒. 八仙花茎尖离体培养技术研究[J]. 北方园艺,2012(9):129-130.
[20]孙晓波,苏家乐,陈双双,等. 大花绣球‘无尽夏组培苗叶片再生植株的研究[J]. 中国农学通报,2020,36(16):67-72.
[21]殷丽青,胡永红,汤桂钧,等. 优良八仙花品种(Hydrangea serrata ‘Preziosa)的离体培养与快速繁殖[J]. 上海农业学报,2010,26(1):38-41.
[22]雷亚灵. 八仙花组织培养技术研究[D]. 杨凌:西北农林科技大学,2008.
[23]Ruffoni B,Sacco E,Savona M. In vitro propagation of Hydrangea spp.[J]. Methods in Molecular Biology (Clifton,N.J.),2013,11013(13):231-244.
[24]Liu F,Huang L,Li Y L,et al. Shoot organogenesis in leaf explants of Hydrangea macrophylla ‘Hyd1 and assessing genetic stability of regenerants using ISSR markers[J]. Plant Cell,Tissue and Organ Culture (PCTOC),2011,104(1):111-117.
[25]Khaing M T,Jung H J,Han T H. Effect of plant growth regulators on regeneration and proliferation of Hydrangea macrophylla cultivars[J]. Flower Research Journal,2018,26(3):84-89.
[26]王海娥. 朗姆系绣球的组织培养及植株再生体系研究[D]. 雅安:四川农业大学,2005.
[27]Murashige T,Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue culture[J]. Physiologia Plantarum,1962,15(3):473-497.
[28]李杨丽. 八仙花离体快繁及盆栽生产相关技术研究[D]. 武汉:华中农业大学,2010.
[29]Doil A,Zhang R,Schum,et al. In vitro regeneration and propagation of Hydrangea macrophylla thunb. Nachtigall[J]. Zoological Ence,2012,10(1):439-447.
[30]蒋梦烟. 绣球品种‘蓝尼康快繁技术研究[D]. 长沙:中南林业科技大学,2017.
[31]刘会超,贾文庆. 基本培养基及植物生长调节剂对牡丹组培苗生根的影响[J]. 河南科技学院学报(自然科学版),2010,38(2):32-34.
[32]张瑞姿. 植物生长调节剂在观赏植物组织培养中的应用[J]. 山西林业,2012(5):39-40.
[33]金桂芳,苏荣存. 优良绣球Acuminata (H. serrata) 的组培快繁技术研究[J]. 江苏农业科学,2009(6):85-86.
[34]郭超. 6种绣球花新引进品种的快繁技术研究[D]. 长沙:中南林业科技大学,2015.
[35]聂绍虎,刘江淼,张鑫静,等. 栎叶绣球‘雪花再生体系的建立[J]. 分子植物育种,2020,18(5):1593-1599.
[36]高金山,边庆华,张永忠,等. 细胞分裂素CPPU的研究进展[J]. 农药,2006,45(3):151-154.
[37]赵飞燕,王景燕,龚伟,等. 花椒属植物组织培养研究进展[J]. 世界林业研究,2021(3):32-37.
[38]龚伟,王米力,石大兴. 八仙花离体培养和植株再生[J]. 植物生理学通讯,2003,39(6):624.
[39]Mills D,Zhou Y Q,Benzioni A. Effect of substrate,medium composition,irradiance and ventilation on jojoba plantlets at the rooting stage of micropropagation[J]. Scientia Horticulturae,2009,121(1):113-118.
[40]孙占育,孙志强,曹斌. 活性炭在促进组培苗植物生根中的作用[J]. 湖南农业科学,2010(7):3-5.
[41]金香花,郎贤波,李美兰,等. 活性炭、MS浓度及生长素对树莓试管苗生根及生长的影响[J]. 延边大学农学学报,2015,37(1):31-34.
[42]Desjardins Y. Photosynthesis in vitro-On the factors regulating CO2 assimilation in micropropagation systems[J]. Acta Horticulturae,1995,393:45-61.
[43]孟维娜,岳东杰,程艳荣,等. 观赏植物无糖组培苗炼苗技术的可行性分析[J]. 上海农业科技,2020(4):101-102.
[44]Sebastian T K,Heuser C W. In vitro propagation of Hydrangea quercifolia Bartr[J]. Scientia Horticulturae,1987,31(3/4):303-309.
[45]Preece J E,Ledbetter D I. The influence of thidiazuron on in vitro shoot proliferation of oakleaf hydrangea (Hydrangea quercifolia Bartr.)[J]. Acta Horticulturae,2003,625(25):233-236.
[46]姜巍,張巍巍,潭幸,等. 变异绣球无性系建立的研究[J]. 内蒙古农业科技,2007(5):39-41.
[47]田春英,张建文,卢阳,等. 日光温室草莓基质栽培新技术[J]. 特种经济动植物,2020,23(2):34-36.
[48]曲继松,张丽娟,朱倩楠,等. 水分胁迫对柠条基质栽培黄瓜幼苗生长及光合特性的影响[J]. 江苏农业学报,2019,35(2):384-390.
[49]张倩,王华芳. 牡丹试管苗生根与移栽技术研究进展[J]. 园艺学报,2012,39(9):1819-1828.
[50]陆乙卜,龚记熠,肖松,等. 圆锥绣球种子离体萌发的培养条件[J]. 贵州农业科学,2015,43(11):34-37.
[51]赵盈盈. 八仙花叶片高效再生体系的建立及暗培养下生理变化的研究[D]. 长沙:湖南农业大学,2015.
基金项目:国家自然科学基金(编号:31901359);苏州市科技计划项目(编号:SNG201923)。
作者简介:秦紫艺(1998―),女,内蒙古鄂尔多斯人,硕士研究生,主要从事观赏园艺学研究。E-mail:qinziyi0213@163.com。
通信作者:邓衍明,博士,研究员,主要从事观赏园艺学研究。E-mail:nksdym@163.com。

