不同氮素添加量对大兴安岭冻土区泥炭地植物细根形态的影响模拟研究
高晋丽,宋艳宇,宋长春,张 豪,谭稳稳,杜 宇
中国科学院东北地理与农业生态研究所,湿地生态与环境重点实验室,长春 130102
大兴安岭冻土区位于欧亚大陆多年冻土带南缘,地温高、热稳定性差,对气候变化响应极其敏感[1]。大兴安岭冻土区泥炭地是我国泥炭地的主要分布区之一,在低温、淹水、厌氧环境下,有机物生产和贮存速率远大于分解速率,氮主要以有机形态储存在冻土中,是典型的氮限制性生态系统[2]。气候变暖以及人类活动影响导致冻土区冻融循环加剧,释放出大量可被植物吸收利用的无机氮,提高根系氮吸收动力[3-6]。大兴安岭冻土区泥炭地是研究全球变暖对泥炭地生态系统影响的理想区域。
氮素是植物生长最重要的营养元素,植物可以通过改变功能性状来适应土壤氮素营养环境变化[7-9]。当土壤氮素营养水平升高后,地下部能量分配比例会提高,以提高植物养分吸收效率[10-12]。植物细根(直径≤2 mm)是植物吸收水分和养分的重要器官,对土壤环境变化较为敏感[13-14]。已有研究发现,土壤氮素营养环境变化能够改变细根形态,具体表现为细根数目、总根长、表面积、体积、根尖数等指标的变化[15-17]。因此,可以通过细根形态对氮添加的响应,研究土壤氮素营养环境变化对植物地下过程的影响。
目前关于土壤氮素营养环境变化对植物功能性状影响的研究集中在地上部,对于地下部分(尤其是根系)的研究发展缓慢[18]。因此,本研究重点关注冻土区泥炭地植物根系对土壤氮素营养环境变化的响应。传统的根系研究方法包括挖掘法、剖面法和土钻法等,破坏性较大,不能直接观察根系的动态变化[19]。本实验采取的微根管观测法(minirhizotron)基本不干扰细根的生长环境,能对同一细根生长动态进行连续监测[20-22],应用WinRHIZO图像分析软件分析泥炭地不同深度(0—20 cm、20—40 cm)土壤中的植物根系形态,选取的参数包括细根根长、表面积、体积、根长密度,用来反映植物根系的生长发育状况和代谢能力,以探究氮素营养环境变化对冻土区泥炭地植物根系形态的影响。
1 材料和方法
1.1 试验地概况
研究地点位于大兴安岭连续多年冻土区泥炭地(52°94′N,122°86′E),该区气候属寒温带季风气候,年冻结期长达7个月,8月下旬活动层深度可达80—100 cm,其下为永冻层。
2020年5、6、7、8、9月份平均气温分别为8.26 ℃、13.59 ℃、19.54 ℃、13.96 ℃、9.91 ℃,降水量分别为25.9 mm、81.8 mm、41.6 mm、132.0 mm、73.7 mm。植物群落的垂直结构比较简单,灌木层的主要代表为柴桦(Betulafruticosa)、狭叶杜香(Ledumpalustrevar.angustum)和笃斯越桔(Vacciniumuliginosum)等;草本层的主要代表为白毛羊胡子草(Eriophorumvaginatum)等;地被层的主要代表为毛梳藓(Ptiliumcrista-castrensis)、锈色泥炭藓(Sphagnumfuscum)和桧叶金发藓(Polytrichumjuniperinum)等[23]。
1.2 试验设计
在大兴安岭连续多年冻土区选取典型泥炭地,设置0 g N m-2a-1(CK)、6 g N m-2a-1(N1)、12 g N m-2a-1(N2)和24 g N m-2a-1(N3)4个处理,每个处理3次重复,小区面积2 m×2 m,试验小区四周安装隔离板(2 m× 2 m,0.8 m深)以防止氮横向流失,各小区间设置1 m的隔离带。2011年秋季布设实验样地,从2012年开始在生长季内(5—9月份)对氮添加处理施加NH4NO3,每月初以溶液的形式对小区喷洒,全年共喷洒5次。按照处理水平要求,将每个小区每次所需要喷洒的NH4NO3溶解在1 L地表水中,同时,对照小区仅喷洒等量的地表水[24]。
1.3 观测方法
本实验采用BTC- 100微根窗根系观测系统,在每个实验样地中安装直径5 cm、长100 cm的底部密封的透明有机玻璃管(简称微根管),安装微根管时,微根管与地面角为45°,插入长度约为70—75 cm,换算成垂直深度达50—55 cm,管子露出地面10 cm左右,露出地面部分用黑色胶布缠绕,以防光线进入,再用浅色胶布覆盖,并在顶端加盖密封,避免灰尘和水分进入管中。于2020年8月2日和9月8日进行根系观测。数据采用WinRHIZO图像分析软件(WinRHIZO TRON 2008,Regent Instruments,Canada),统计分析根长、根表面积和根体积等指标。
1.4 数据处理
试验数据用Excel 2007软件整理后,采用SPSS 24软件进行单因素方差分析(ANOVA),显著性水平P<0.05。
以微根管观测窗内得到的根系长度,计算单位土体的根长密度(root length density, RLD, mm/cm3),其计算公式如下(1):
RLD=RL/(A×DOF)
(1)
其中,RL(mm)为观测窗中观测到的细根根长,A(cm2)为观测窗面积,A取值为1.8 cm×1.4 cm,DOF(cm)为微根管到周围土壤的距离,DOF一般在0.2—0.3 cm,由于本研究中的植物细根直径较小,计算中DOF取0.2 cm[25]。
2 结果与分析
2.1 氮素添加对8月份细根形态的影响
在表层土壤(0—20 cm)中,随施氮量增加,植物总根长、总表面积、总体积和根长密度均呈增加趋势,其中N3处理下细根总根长、总表面积、总体积和根长密度显著高于其他处理(P<0.05),N2处理下细根总表面积和总体积显著高于对照组和N1处理。N1、N2、N3处理下植物细根总根长分别为对照组的1.36、2.16、4.97倍,总表面积分别为对照组的1.32、2.92、5.61倍,总体积分别为对照组的1.17、3.45、6.54倍。在亚表层土壤(20—40 cm)中,施氮对细根总根长、总表面积、总体积和根长密度均无显著影响(P>0.05)。各处理下表层土壤(0—20 cm)中的根长密度占总根长密度的较大部分,亚表层土壤仅占极小的一部分,表层土壤中的根长密度分别比亚表层土壤(20—40 cm)高24%(CK)、74%(N1)、154%(N2)、487%(N3)(图1)。

图1 不同浓度氮素添加对8月份植物细根总根长、总表面积、总体积和根长密度的影响Fig.1 Effects of different concentrations of nitrogen additions on total root length, total surface area, total volume and root length density in August不同小写字母表示同一土壤深度不同处理间根系特征存在显著差异(P<0.05),CK、N1、N2、N3氮素添加量分别为0 g N m-2 a-1、6 g N m-2 a-1、12 g N m-2 a-1、24 g N m-2 a-1
2.2 氮素添加对9月份细根形态的影响
在表层土壤(0—20 cm)中,随施氮量增加,总根长、总表面积、总体积和根长密度均呈增加趋势,其中N3处理下细根总根长和根长密度显著高于对照组,总表面积和总体积显著高于对照组和N1处理(P<0.05)。N1、N2、N3处理下植物细根总根长分别为对照组的1.47、2.85、3.42倍,总表面积分别为对照组的1.15、3.37、4.86倍,总体积分别为对照组的0.97、3.72、6.29倍。在亚表层土壤(20—40 cm)中,施氮对细根总根长、总表面积、总体积和根长密度均无显著影响(P>0.05)。各处理下表层土壤中的根长密度占总根长密度的较大部分,亚表层土壤仅占极小的一部分,表层土壤中的根长密度分别比亚表层土壤高110%(CK)、158%(N1)、366%(N2)、467%(N3)(图2)。
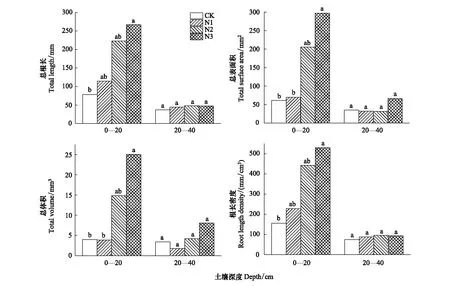
图2 不同浓度氮素添加对9月份植物细根总根长、总表面积、总体积和根长密度的影响Fig.2 Effects of different concentrations of nitrogen additions on total root length, total surface area, total volume and root length density in September不同小写字母表示同一土壤深度不同处理间根系特征存在显著差异(P<0.05)
3 讨论
3.1 氮素添加对植物细根根长的影响
根长是根系生长发育的重要特征之一,通常用来指示根系对环境变化的响应[26]。本研究中,施氮处理增加了植物细根的总根长,在表层土壤中(0—20 cm),植物细根的总根长随施氮量增加而增加,但对亚表层土壤(20—40 cm)的细根生长影响较小,可能由于本研究地点位于大兴安岭连续多年冻土区,亚表层土壤温度较低、有效养分不足和通气条件不适于植物生长。说明在氮限制环境中,土壤氮素营养水平升高后,植物的生长策略发生改变,倾向于促进根系发育,来获取更多的氮素,为植物地上部提供更多能量。
在对樟树幼苗的观测中也发现,施氮处理可以显著促进幼苗细根长度的增加,由于幼苗处于生长旺盛期,对营养元素的需求较大[17]。但也有研究提出相反的结论,土壤氮素营养水平升高会抑制根系生长,可能由于植物光合作用固定的碳化合物有限,不足以为根系生长提供额外的能量[27]。也可能是长期氮添加导致土壤酸化,降低表层土壤(0—20 cm)pH值,抑制细根根尖分生组织细胞分裂,进而影响细根长度[28]。根系长度对土壤环境变化的响应十分复杂,这可能与植物种类、土壤pH值、土壤氮含量不同等因素有关,所以不同生存环境中的植物根系对氮添加的响应具有较大差异。
3.2 氮素添加对植物细根表面积的影响
根表面积作为反映细根形态变化的一个重要指标,能够影响植物的吸收功能[29],并且相对于根长而言,根表面积能够更好的量化细根吸收功能[30]。根表面积与参与氮代谢的关键酶有显著正相关性,对氮代谢具有积极的促进作用[31]。本研究发现,在表层土壤中(0—20 cm),施氮处理显著增加了植物细根的总表面积,其中8月份N2、N3处理均与对照组有显著差异(P<0.05),9月份N3处理与对照组有显著差异。说明在氮限制的环境中,植物细根对表层土壤有效氮含量增加响应较敏感,可通过提高在土壤中的分布面积,增强细根吸收养分的能力。植物根系对土壤氮素营养水平变化的响应十分复杂,氮营养增加可能使细根表面积增加[32],也可能降低细根表面积或没有显著影响。研究表明短期施加氮肥可增加细根表面积,提高细根的养分吸收能力与养分吸收效率[33]。在森林生态系统的研究中发现,施氮显著降低了表层土壤(0—20 cm)中乔木植物的细根表面积,这可能由于土壤有效氮含量增加后,较少的活根就可以满足植物的营养需求,因此减少根系的能量分配比例[34]。目前一些新的研究发现,植物根系的形态不仅受外界环境的影响,还受自身遗传机制的限制[35]。
3.3 氮素添加对植物细根体积的影响
根系体积可以反映根系的发达程度。本研究区域为典型的氮限制性环境,植物对土壤氮素营养水平变化响应比较敏感,研究结果表明,在表层土壤中(0—20 cm),施氮处理显著增加了植物细根的总体积,其中8月份N2、N3处理均与对照组有显著差异(P<0.05),9月份N3处理与对照组有显著差异(P<0.05)。氮素营养环境变化可以改变细根的生存策略,通过增加根系体积,提高氮素吸收和利用效率,促进根系生物量的积累[36-37]。但也有研究提出相反观点,认为根系体积增大会使细根周转速率减慢,对于草本植物而言,当细根直径为1.6 mm时根系周转率最高[38]。在本研究区域,草本植物根系相对较细,即使体积增大依然具有较高的根系周转速率,能够从土壤快速吸收养分。当然,细根功能的变化应与细根结构特征相结合,例如,细根体积的变化,可能为皮层厚度的变化,也可能为中柱直径的变化,需要在未来研究中深入探讨[16]。总体而言,在氮限制性环境中,土壤氮素营养水平增加可以促进细根生长,提高植物细根体积以此来增强植物吸收氮元素的能力。
3.4 氮素添加对植物细根根长密度的影响
本研究发现,0—20 cm土层中根长密度与施氮量呈正相关,且随施氮量的增加表层土壤(0—20 cm)中根系分布比例增加,说明一定程度的氮素胁迫可诱导植物根系向土壤深处延伸。张微微等人的研究也有相同结论,施氮可以使小麦根系在表层土壤(0—20 cm)中的生物量增加,分布比例增加[39-40]。
植物根系的垂直分布与土层的深度有关,随着土层加深,细根生物量呈逐渐下降的变化规律。本研究中根长密度也表现出同样的变化规律,根系主要在0—20 cm,与周本智、傅懋毅和何永涛等的研究结果相似[41-42],可能由于表层土壤更靠近施氮部位,土壤氮素营养水平更高。而在其他研究中发现不同的根系垂直分布规律,如王健健等研究显示,植物细根生物量随土壤层深度的增加呈现先增加后降低的变化趋势,10—20 cm土壤层细根生物量最大,在50—60 cm土壤层细根生物量最小[43];又如在新疆干旱区,植物细根生物量表现为表层细根生物量少,20—30 cm土壤层最大[44]。由此可见,在连续多年冻土区泥炭地,土壤表层是根系对养分吸收的主要土层,储存大量植物可利用的有效成分,能促进细根生物量的积累。
4 结论
本研究在大兴安岭冻土区泥炭地开展氮添加模拟试验,研究结果表明表层土壤(0—20 cm)中植物细根的总根长、总表面积、总体积和根长密度随施氮量增加而增加,其中N3处理与对照组有显著差异,施氮也增加了根系在表层土壤中的分布比例;但对亚表层土壤(20—40 cm)中的细根生长影响幅度小于表层土壤,由于本研究地点为冻土区泥炭地,亚表层土壤温度较低、有效养分不足和通气条件不适于植物生长。说明氮素添加在一定程度上减缓了植物的氮限制,能够显著促进泥炭地表层土壤中植物细根的生长,但对亚表层土壤中细根的生长影响幅度小于表层土壤。

