非洲猪瘟病毒检测技术研究进展
刘 涛李永秀康亚男郭 禹刘朋朋柳 珊
(1河北农业大学动物医学院,河北保定 071001;2瑞普 (保定)生物药业有限公司,河北保定 071000;3河北科医生物技术有限公司,河北保定 072750;4天津瑞普生物技术股份有限公司,天津 300308)
非洲猪瘟是由非洲猪瘟病毒(African swine fever virus,ASFV)感染引起猪的一种急性、热性、高度接触性传染病,该病临床上以高热、皮肤和内脏广泛性出血、腹泻、死亡为主要特征,其是目前已知的唯一的1个DNA虫媒病毒[1]。ASFV成熟病毒粒子共编码54种结构蛋白[2],其中p30、p54和p72在抗原检测中应用较为广泛,研究表明,p30蛋白在非洲猪瘟病毒感染早期表达,适用于ASF疫病的早期诊断;而p54蛋白的免疫原性较好,结构保守,在机体中产生抗体时间早且持续时间长久;p72蛋白在病毒感染后的晚期进行表达,保守性较强且免疫原性好,是目前研究最多的用于诊断的结构蛋白[3]。核酸检测PCR技术通常根据ASFV的B646L基因的高度保守区来设计引物和探针,对疑似病例进行检测,在此方法中,PCR的扩增效率会因引物的位置和碱基组成不同而存在一定差异[4],本文将对非洲猪瘟的实验室检测技术进行综述,以期为非洲猪瘟防控提供参考。
1 非洲猪瘟传播概况
20世纪初,非洲猪瘟病毒最早发现于东非地区,1957年在伊比利亚半岛流行;20世纪中期,扩散至西非、加勒比、西欧、东欧等多个国家和地区[5]。2007年非洲猪瘟疫情首次传入高加索地区,2009年进入俄罗斯,2012年从俄罗斯转向乌克兰,2013年传入白俄罗斯[6]。2018年8月,在我国辽宁沈阳首次发生了非洲猪瘟疫情,随后在我国的31个省份陆续点状散发。非洲猪瘟的高传播速度和高致死率一度导致我国生猪、猪肉及相关产品供给紧张、价格高涨。非洲猪瘟对全球养猪业都造成了严重的影响,仅2020年全球就有27个国家和地区发生了2 538起家猪疫情和8 188起野猪疫情,共计10 726起。
目前,全球还没有商品化大量生产的ASF疫苗。中国农业科学院哈尔滨兽医研究所正在研发的疫苗有2种,分别是非洲猪瘟病毒基因缺失活疫苗(HLJ/18-7G D株)和非洲猪瘟弱毒活疫苗(HLJ/18-7GD株),这2种疫苗均获得了2020年的临床试验批件。其中,非洲猪瘟弱毒疫苗于2020年底完成了其实验室创制、中间试制、生物安全环境释放试验及第一阶段临床试验等,且该弱毒疫苗的生物安全生产试验和第二阶段临床试验也在推进中。其实当前仍没可以商业化生产的非洲猪瘟疫苗,因此在非洲猪瘟疫苗上市之前,病原的及时检测和严格的生物安全措施仍是防控非洲猪瘟的主要手段。
2 非洲猪瘟病毒的检测技术
随着非洲猪瘟疫情在全球的不断发展,抗原、抗体快速诊断技术、方法层出不穷,国内外科研人员建立了多项抗原和抗体检测技术,并在检测实验室临床应用。国内标准方面,2020年12月14日国家标准化管理委员会发布了《非洲猪瘟诊断技术》(GB/T 18648-2020)[7],分别从非洲猪瘟病毒核酸检测、病毒完整颗粒检测和非洲猪瘟病毒抗体检测等3方面规定了非洲猪瘟病毒的实验室诊断技术和方法。其中,非洲猪瘟病毒核酸检测技术包括普通PCR检测法、荧光定量PCR检测法、环介导等温扩增技术、重组酶介导等温核酸扩增技术、微流控芯片检测法5种。非洲猪瘟病毒完整颗粒检测方法包括病毒的分离培养技术、夹心ELISA抗原检测法和高敏荧光分析法3种。非洲猪瘟病毒抗体检测方法包括胶体金免疫层析技术和ELISA抗体检测方法2种。
2.1 非洲猪瘟病毒核酸检测技术
2.1.1 普通PCR检测法
世界动物卫生组织(OIE)推荐的PCR检测法是针对ASFV的vp73基因设计引物后扩增出257 bp基因片段,来确诊该病的[8]。Giammarioli等[9]则通过研究建立了非洲猪瘟病毒、猪瘟病毒、圆环病毒2型、猪繁殖与呼吸障碍综合征病毒、猪伪狂犬病毒等5种病毒的多重PCR检测,多重PCR检测法缓解了实验人员检测多个病毒需要多次检测才能实现的压力。目前,PCR技术以其快速、灵敏的检测特点,广泛应用于ASFV的实验室诊断,但PCR技术在对扩增产物进行分析时也存在一定的缺陷,即PCR扩增时需要开盖二次加引物,容易造成样品的交叉污染而出现假阳性。此外,待检样品中可能存在的酶也会抑制病毒核酸的检出,从而出现假阴性的结果[10]。
2.1.2 荧光定量PCR检测法
荧光定量PCR检测法是检测核酸样品由定性到定量的转变,同时提高了核酸检测的敏感性、特异性及检测效率等。OIE推荐的荧光定量PCR检测法是依据ASFV的B646L基因保守序列设计的探针[11]进行病毒基因扩增。王彩霞等[12]则根据非洲猪瘟病毒CD2v基因序列,设计了TaqMan荧光PCR引物和探针,建立了ASFV的TaqMan实时荧光PCR检测法,且其最低检测下限可达到10 copies/L。史喜菊等[13]建立了猪瘟、非洲猪瘟和猪水泡病毒等多重荧光RT-PCR同步检测和鉴别诊断方法,三重荧光PCR可以达到与单重荧光PCR相等的指标参数,实现同时检测和鉴别3种病毒的目的。
2019年中国动物疫病预防控制中心等单位合作研发的荧光PCR检测ASFV试剂盒获得二类新兽药注册,后续国内又有4项同类产品注册成功。2020年12月新发行的《非洲猪瘟诊断技术》[7]将国内检测非洲猪瘟病毒的主要方法定为以ASFV的vp72基因保守序列为靶标建立的荧光定量PCR检测法。
2.1.3 环介导等温扩增技术
2000年,环介导等温扩增技术(LAMP)作为一种由BST酶介导的且反应温度单一的恒温核酸扩增新技术出现并广泛应用[14]。随后,王林等[15]根据p72基因设计引物,建立了基于SYTO9荧光染料的实时荧光LAMP快速法检测非洲猪瘟病毒,该方法最低可检测基因片段的量为10 copies/μL,与农业农村部推荐的荧光定量PCR法检测结果的符合率为100%,具有反应速度快(40 min)、灵敏度高、操作简便、不易污染、适用仪器广等优势。2019年,北京森康生物技术开发有限公司利用环介导等温扩增技术研发了检测非洲猪瘟病毒的试剂盒,并成功注册成为第一个利用环介导等温扩增技术检测非洲猪瘟病毒的检测试剂盒。
2.1.4 重组酶介导等温核酸扩增技术
近年来,重组酶介导等温核酸扩增法(RAA)检测基因技术日益兴起,重组酶介导等温核酸扩增法运用的酶主要是细菌或真菌的重组酶。细菌和真菌的重组酶与噬菌体的重组酶相比其来源广泛、对温度的适应性强[16]。赵凯颖等[17]运用重组酶介导等温核酸扩增法扩增了非洲猪瘟病毒的p72基因序列,在扩增过程中,该方法表现出灵敏度高和用时短的特点,其灵敏度可达10 copies/μL,且检测时长仅需10 min。目前,我国在运用重组酶介导等温核酸扩增法检测非洲猪瘟病毒时,推荐以病毒B646L基因的保守序列为检测靶标,利用荧光标记的探针追踪目的片段进行检测[7]。重组酶介导等温核酸扩增检测法在灵敏度和反应用时方面都有一定的优势,且具有广阔的发展前景。
2.1.5 微流控芯片检测法
微流控芯片技术(microfluidic chip technology)是20世纪90年代提出的一种借助微米级通道操控微液滴流动的新型技术,近年来有研发人员将该方法与光学传感技术相结合,使其在生物医学诊断领域得到了全新的应用与发展。微流控芯片法作为被推荐的即时检验检测ASFV的方法被列入我国2021年7月份实施的出入境检验检疫行业标准中[18],该方法针对ASFV的p72基因序列设计特异性引物,并将其固定于芯片反应室后对芯片进行封装,随后把提取的核酸模板与含有SYBR Green荧光染料的反应液混合后加入到封装好的芯片内,借助带有离心功能、恒温功能及实时荧光检测一体化的微流控芯片检测仪对产生的荧光信号进行收集与分析,从而达到对ASFV检测的目的。该方法将样品制备、反应、分离、检测等基本单元集成到微米级尺寸的芯片上,然后自动完成分析全过程,不受试验场地及条件限制,可实现“样本进,结果出”的便捷检测,适合现场快速检测。
2.2 非洲猪瘟病毒完整颗粒检测方法
2.2.1 非洲猪瘟病毒的分离培养
非洲猪瘟病毒的分离与培养是OIE推荐的诊断非洲猪瘟病毒的黄金标准,一般采用红细胞吸附试验(HAD)进行ASFV的分离确诊。首先将可能携带病毒的组织分离,如猪的血液、淋巴结、脾脏等,然后取病料样品进行细胞培养,分离病毒粒子,再将病料培养的病毒粒子接种在原代白细胞中,观察细胞病变效应(cytopathic effect,CPE),最后取健康猪的血液与接种的白细胞共同孵育,显微镜下观察白细胞的变化,如果白细胞表面有大量猪红细胞附着,则判定为阳性[19]。该方法试验周期较长,且直接接触病原可能会增加病原体扩散污染的风险,此外,应用该方法时,如果待检样品中病毒载量较低,则白细胞表面附着红细胞的现象不明显,易出现假阴性结果,因此不适用于现场大量检测。
2.2.2 夹心ELISA抗原检测法
双抗体夹心ELISA抗原检测方法主要是将特异性反应抗体的固相载体包被在96孔板中,然后向96孔中加入待检样品(抗原)及酶标记抗体共同孵育,使抗原、抗体和酶标记抗体结合后,根据反应液的颜色反应来判断抗原含量,从而达到对待检样品进行定性或定量分析的方法。Vidal和Aydin等[21,22]利用夹心ELISA抗原检测法检测了非洲猪瘟病毒p72基因的单克隆抗体。当前,我国制定的检测非洲猪瘟病毒的标准是将ASFV p30蛋白单克隆抗体作为包被抗体,将辣根过氧化物酶标记的p30蛋白单抗(针对p30蛋白不同表位)作为酶标抗体对待检样品进行检测[8]。此法操作较简便,可降低假阳性风险。
2.2.3 高敏荧光免疫分析法
高敏荧光免疫分析法是将镧系元素与免疫层析技术结合的一种分析方法。该方法是针对目的基因片段设计引物或探针时,在引物或探针上标记或包埋镧系螯合物作为荧光信号,最后参照荧光标准信号的浓度曲线对待测样品的目的基因片段浓度进行定量检测[20],我国新实行的非洲猪瘟检测标准中以镧系元素螯合物为追踪信号,结合抗原抗体免疫层析技术,达到检测ASFV抗原的目的[8]。
2.3 非洲猪瘟病毒抗体检测方法
2.3.1 胶体金免疫层析技术
免疫胶体金技术(Immune Colloidal Gold Technique)是一种以胶体金为示踪标志物的抗原抗体免疫标记技术。张鑫宇等[23]运用此方法建立了ASFV的p54抗体检测胶体金免疫分析试纸条,该试纸条的临床检测样品的准确率高于OIE推荐的ELISA检测法。吴海涛等[24]以原核表达的PET-30A-P72蛋白作为抗原免疫兔子制备阳性血清,以杂交瘤细胞株接种小鼠获得ASFV的单克隆抗体,建立了ASFV胶体金免疫层析法试纸条,该试纸条的特异性、灵敏性和稳定性均较好。胶体金免疫层析法操作简单、快速,不需要仪器,适用于对国内大型猪场的疫病监测及大规模排查。
2.3.2 ELISA抗体检测方法
ELISA抗体检测是目前血清学检测中最常用的方法。Pastor等[25]利用非洲猪瘟病毒感染的细胞培养物中高特异胞质可溶性抗原(CS-P)作为包被抗原建立的间接ELISA抗体检测法适用于ASFV感染的早期检测。曹琛福等[26]基于非洲猪瘟病毒的p54蛋白建立了阻断ELISA抗体检测法,该法成为深圳市地方检测非洲猪瘟病毒的标准。目前,我国有2种检测非洲猪瘟病毒的ELISA抗体检测标准,分别是以包被抗原杆状病毒表达的P30重组蛋白建立的间接和阻断ELISA抗体检测法、和以包被抗原P54重组蛋白建立夹心ELISA抗体检测法[7]。ELISA检测法适用于ASFV抗体检测,主要用于ASF流行区域的低毒力ASFV感染的猪只,随着基因缺失弱毒疫苗的研发,未来还需要配套区分野毒感染和疫苗免疫的抗体检测技术。
3 国内非洲猪瘟病毒诊断制品的注册情况
中国动物疫病预防控制中心于2018年12月和2019年4月分别组织了2次非洲猪瘟病毒现场快速检测试剂评价工作。2019年6月11日公布第二批通过评价的34项检测试剂名单,包括28项荧光定量PCR类和6项等温扩增类检测试剂产品,试纸条类产品全部未通过评价。
2020年8月27 日,农业农村部办公厅发布《关于非洲猪瘟病毒诊断制品生产经营使用有关事宜的通知》,要求自2020年9月1日起,未在通过评价的34项检测试剂名单中,以及名单中目前未申请注册的ASFV诊断制品,一律停止生产经营;自2021年1月1日起,全部使用已取得批准文号的ASFV诊断制品。
截至2021年9月中旬,全国有5项非洲猪瘟检测试剂通过新兽药注册评审,获得农业农村部颁发的《新兽药注册证书》 (见表1);有13家企业、10项不同产品(12项荧光PCR法、1项等温扩增法)获得农业农村部颁发的兽药产品批准文号(见表2),其中3项同表1列出的《新兽药注册证书》产品、3项为改良型兽医诊断制品,直接核发兽药产品批准文号。
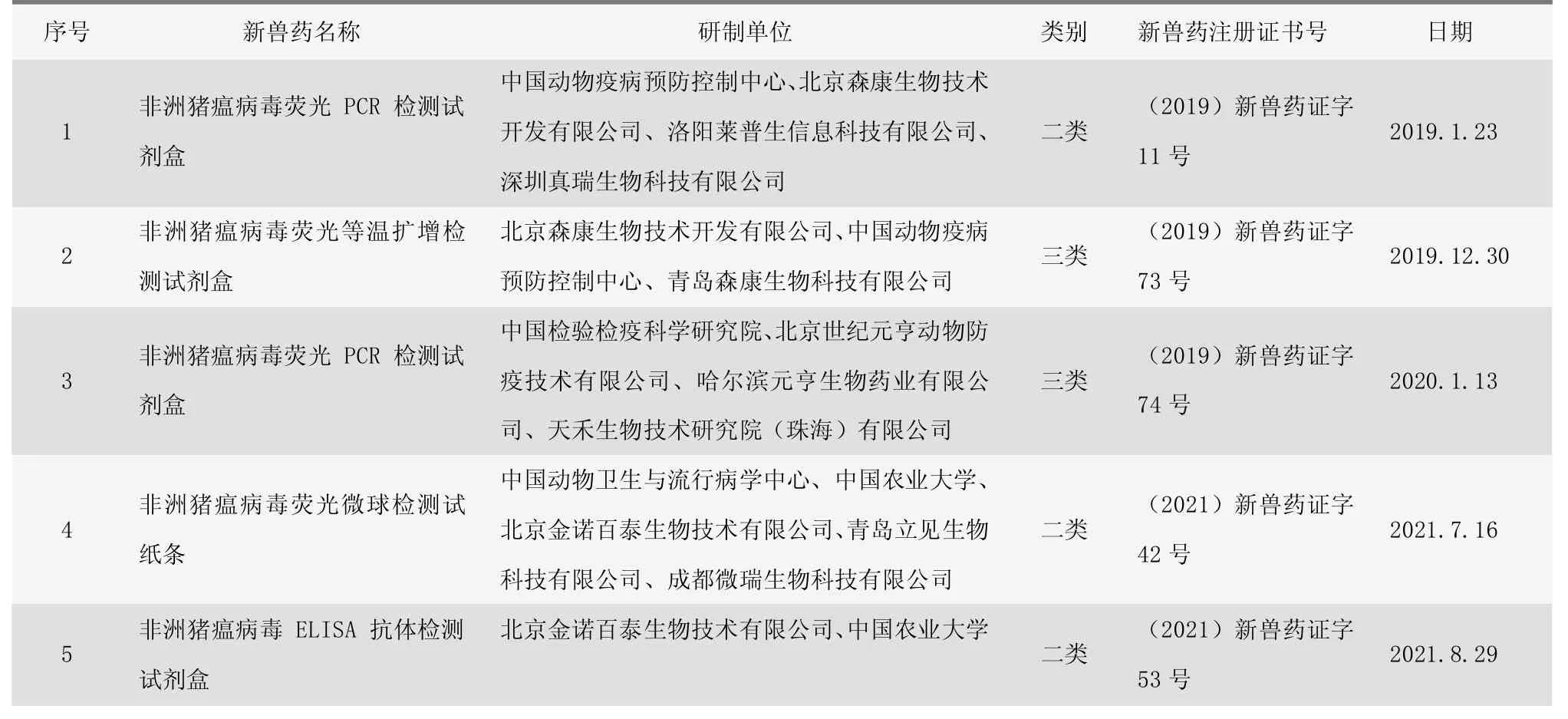
表1 非洲猪瘟检测试剂新兽药注册证书列表

表2 非洲猪瘟检测试剂批准文号列表
4 小结
自2018年非洲猪瘟疫情在我国发生以来,ASFV抗原、抗体检测技术飞速发展,为应对非洲猪瘟疫情,中国动物疫病预防控制中心通过3次非洲猪瘟病毒现场快速检测试剂评价,选出了几十种可用于非洲猪病病毒检测的试剂,供检测机构应急使用。通过新兽药注册诊断制品的批准上市和新版《非洲猪瘟诊断技术》国家标准出台,为非洲猪瘟疫情监测提供了技术保障。随着疫情的蔓延,ASFV的防控和净化是长期的过程,对ASFV的早期诊断以及免疫后抗体水平检测的需求也不断提升,快速、准确、便捷的诊断技术是控制和预防非洲猪瘟的重要手段。

