miR-21对缺血/再灌注后血脑屏障的保护作用与机制
陈志强,邵 帅,王 建,李 利
(哈尔滨医科大学附属第四医院神经外科,黑龙江 哈尔滨 150001)
血脑屏障(Blood Brain Barrier,B.B.B.)是由血管内皮和星形细胞的足突构成,通过调节活性物质来维持脑部功能,当脑血流中断超过1h,其通透性增加,进而引发梗死区域的水肿,而再灌注过程中可引起血脑屏障持续的开放,大量液体进入组织间隙,加重脑水肿[1-2]。在脑梗塞过程中,会引起血管病变、细胞结构破坏和无法逆转的细胞凋亡[3-4]。最新研究表明,在大鼠模型中,坏死中心区域miR21表达比周边明显低,表明其在脑血管疾病中发挥着重要作用[5]。另外证实miR-21可保护神经元免受缺血导致的损伤,通过PTEN-MMP-2抑制基质降解和炎症反应[6]。因此,本文拟探究miR-21对缺血/再灌注后血脑屏障的保护作用和机制,为miR-21应用于血脑屏障的治疗奠定理论基础和实验基础。
1 材料与方法
1.1 实验动物健康成年雄性SD大鼠,60只,体重220~250 g,2.5月龄,由上海西普尔必凯实验动物有限公司提供,许可证号:SCXK(沪)2008-0016。饲养环境为湿度45%~65%,温度22~25 ℃,光照周期12 h开/12 h。
1.2 主要试剂与材料超纯水系统(德国Millipore公司);低温离心机(美国Thermal公司);蛋白电泳仪(美国Bio-RAD公司);anti-Bax(Abcam公司);LC3抗体(Cell signaling);GAPDH抗体(康成公司);Alexa Fluor 800 二抗(Jackson公司)。
1.3 大鼠脑缺血再灌注模型的构建大鼠经1周适应性饲养后开始实验。参照Zea-Longa法制作大鼠大脑中动脉缺血再灌注模型[7],大鼠经过麻醉(10%水合氯醛,0.35 mL/100 g,腹腔注射)后,颈部常规消毒,取颈部正中切口剪开皮肤,分离皮肤下软组织并暴露颈动脉鞘。仔细分离右侧颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA),后于枕动脉以上结扎ECA,ECA靠近分叉处放置一备用线,动脉夹分别夹闭ICA、CCA。电凝刀离断枕动脉及ECA远心端,用显微剪在ECA上剪一缺口,将备好的栓线经ECA插入ICA至栓线头部达到MCA起始处,备用线打结固定栓线。栓线固定1 h后,将栓线拔出颈内动脉,对其进行再灌注。4 h后进行神经功能缺损评分,评分在1~3分为建模成功,排除死亡和不符合标准的模型。
1.4 神经功能缺损评分再灌注4 h后进行评分,温和对待大鼠,避免其他因素对实验结果产生的影响。采用Zea-longa5分制法,评分标准:0分:无明显的神经损伤症状;1分:前爪不能完全伸展;2分:行走时向对侧侧转圈;3分:行走时向对侧倾倒;4分:不能自发行走,无自主意识。
1.5 TTC染色大鼠缺血再灌注模型24 h后,大鼠经过麻醉(10%水合氯醛,380 mg/kg,腹腔注射)。待麻醉后,取俯卧位,妥善固定于实验台上。用剪刀分离大鼠头部,将大鼠头部单独固定于实验台上,用剪刀剪开头部皮肤,用弯钳去除骨瓣,充分暴露并完整取出大鼠脑组织,后将小脑、部分脑干及嗅球部去除。分离过程中应避免损伤大脑皮层组织。将脑组织放入-20 ℃冰箱冷冻20 min。取出后使用薄刀片将大鼠脑组织均匀切为6片,厚度约为2 mm。将切开后脑片置于盛有2% TTC溶液中,在37 ℃恒温环境下避光保存15 min,期间将脑片组织翻面2~3次,使脑片组织染色均匀。将染色后的脑片组织摆放于一次性医用蓝色中单上,拍照备用。
1.6 大鼠立体定位颅内注射将建模成功的大鼠按照随机数字表发分三组:即miR-con组、miR-21-mimic组和miR-21 inhibitor组,每组6只。过量麻醉(5 mL的3.6%水合氯醛)后固定,头部备皮、用碘伏彻底消毒、剪开皮肤,剥离骨膜,根据《大鼠立体定位图谱》在右侧大脑中线右1 mm、矢状线后0.5 mm处,颅钻开颅,利用微量注射器从颅骨进入4 mm,分别取5 μL空质粒,miR-2l-mimic和miR-21inhibitor,5 min注射完毕,静置5 min,取出注射器,碘伏消毒,缝合皮肤,待清醒后,放回鼠笼饲养,24 h后进行实验。
1.7 脑梗死体积测定上述1.6大鼠饲养24 h,采用9.4T磁共振(布鲁克)获取MRI数据。使用优化的参数获取三维梯度回波,二维多层自旋回波和T2序列,以实现解剖学细节以及高T1和T2/T2*对比度。使用MRI断面的T1图,并将T2*图像与同一坐标系配准用于感兴趣区域分析,分别于不同层面圈脑梗死的区域,由软件计算出脑梗死的体积。
1.8 Western Blot检测上述1.6大鼠饲养24 h,腹腔注射10%水合氯醛320 mg/kg对大鼠进行麻醉后快速断头,在提前预冷的培养皿中取大脑皮层组织蛋白上样质量50 μg,10% SDS-聚丙烯酰胺凝胶进行电泳,然后将蛋白转移到PVDF膜上,用5%脱脂牛奶(博士德)封闭处理,孵育一抗anti-Bax抗体(Abcam 公司),以GAPDH为内参。
1.9 免疫荧光检测标本准备:4%多聚甲醛心脏灌注后,取大鼠大脑皮层,以4%多聚甲醛固定过夜,依次用15%、30%蔗糖脱水24 h。OCT包埋后液氮冷冻1 min后,-80 ℃冰箱保存。染色步骤:8 μm冰冻切片,室温干燥30 min,0.01M PBS洗涤5 min,1X(蒸馏水稀释)碧云天抗原修复液,室温孵育10 min,洗涤3 次/5 min,0.1% tritonX-100室温通透15 min,0.01 MPBS染缸中洗涤3次/5 min,放入湿盒,10%山羊血清(PBS稀释)37 ℃封闭1 h,孵一抗,浓度1:200,用PBS稀释,4 ℃过夜。室温放置30 min,0.01 M PBS染缸中洗涤3次/10 min,孵二抗,操作步骤同上。避光染核,0.1% DAPI室温染核1 min后洗涤5次/3 min,封片,抗荧光淬灭剂封片,加盖玻片,荧光显微镜观察。
1.10 统计学分析计量数据用“均数±标准差”表示。用方差分析(ANOVA)进行组间数据的比较。如果ANOVA分析有差异,再通过Bonferroni修正的t检验或Dunnett检验进行事后两两比较。Western免疫条带的灰度通过Odyssey 3.0软件分析。P<0.05为差异具有统计学意义。
2 结果及分析
2.1 大鼠脑缺血再灌注模型构建的分析大鼠于再灌注4 h进行行为学观察,其中Longa评分为2的模型表现为行走时向左侧转圈,见图1。

图1 大鼠脑缺血再灌注行为学观察
2.2 大鼠脑缺血再灌注模型构建的TTC染色分析经TCC染色,正常脑组织部位染色显红色,脑梗死部位显白色。随机选取6只大鼠,通过TTC染色对脑梗死部位进行观察分析,可见白色区域为梗死部位,表明已完成大鼠脑缺血再灌注模型的构建,见图2。
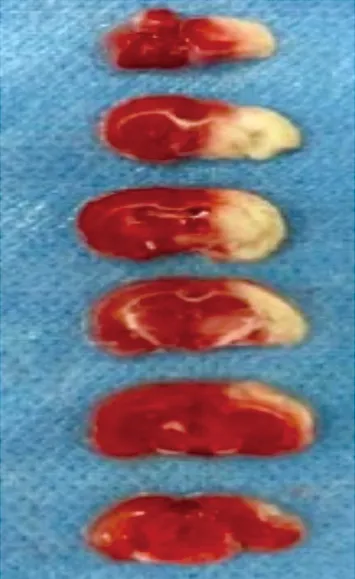
图2 TTC染色大鼠脑缺血再灌注脑组织切片
2.3 miR-21 对脑缺血/再灌注后大鼠大脑皮层组织中Bax蛋白表达的影响Western Blot实验结果表明,与空白质粒组比较,miR-21-inhibitor组大脑皮层组织中Bax蛋白的表达显著升高(P<0.05),miR-21-mimic组大脑皮层组织中Bax蛋白表达显著下降(P<0.05),说明miR-21能够有效抑制Bax的表达,见图3。
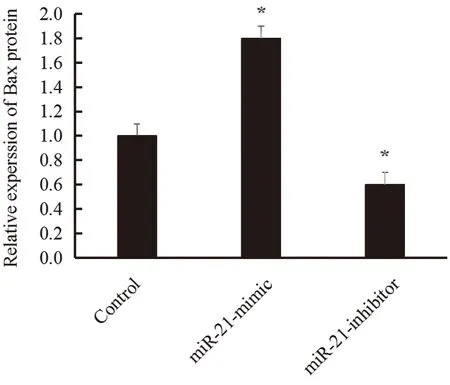
图3 miR-21对大脑皮层组织中 Bax 蛋白的表达的影响
2.4 miR-21对脑缺血/再灌注后大鼠大脑皮层细胞自噬的影响与空白质粒组相比较,miR-21 inhibitor组中LC3的分布明显升高,而miR-21-mimic组中LC3的分布情况明显降低,提示miR-21能够抑制自噬蛋白LC3的表达,起到保护缺血/再灌注后血脑屏障的作用。进一步说明了miR-21可能通过抑制细胞自噬来保护I/R后的血脑屏障,见图4。

图4 LC-3 在脑缺血/再灌注模型中的分布情况
2.5 miR-21对大脑皮层组织中 Bax 蛋白的表达的影响与对照组相比,miR-21组脑皮质中miR-21表达水平降低[(0.51±0.17)vs(1.06±0.27)],经t检验分析,t=3.013,P=0.039,差异具有统计学意义(P<0.05)。MR检查结果进行比较,经方差分析,miR-21组和对照组的脑梗死体积有差别(F=15.71,P=0.000),见图5。

图5 miR-21对大脑皮层组织中 Bax 蛋白表达的影响
2.6 miR-21对脑缺血/再灌注后脑梗死体积的影响核磁共振检查是利用核磁共振原理,依据所释放的能量在物质内部不用结构环境中不同的衰减,通过外加梯度磁场检测所发射出的电磁波,构成物体原子核的位置和种类,据此绘制物体内部的结构图像,MR结果进行比较,采用重复测量数据的方差分析,miR-21-mimic组和Control组的脑梗死体积有差别(F=15.71,P=0.000),miR-21-inhibitor组脑梗死体积小于NC组,见图6。

图6 脑缺血/再灌注大鼠脑梗死体积测定
3 讨论
血脑屏障对维持脑组织内环境的基本稳定、维持中枢神经系统正常生理状态具有重要的生物学意义[8]。本实验成功构建大鼠脑缺血/再灌注模型,研究显示miR-21能够显著抑制大脑皮层组织中Bax蛋白的表达,说明了miR-21可以通过抑制细胞凋亡,起到保护脑缺血/再灌注损伤过程血脑屏障的作用。
抑制自噬能够明显减轻神经元细胞死亡,具有保护神经的作用[9]。因此,抑制自噬也可能减轻血脑屏障的破坏,并减轻脑水肿[10-11]。LC3蛋白在自噬的调节过程中起重要作用,是细胞自噬的标志性蛋白。研究表明:缺血再灌注后,活性氧含量上升,会引起细胞自噬的增加,从而引发一系列的病理生理改变。因此,采取手段干预血管内皮细胞和星形胶质细胞在缺血/再灌注后的自噬和凋亡,可能阻止血脑屏障的破坏和持续开放,防止脑水肿的进一步发展[12-13]。本实验免疫荧光检测结果显示在大鼠脑缺血/再灌注模型中,miR-21组中LC3蛋白的分布较空白质粒组明显减少,表明miR-21能够显著抑制细胞自噬,保护脑缺血/再灌注后血脑屏障。脑水肿的重要原因之一是血脑屏障破坏引起的血管通透性的增加[14]。在细胞因子的介导下,血脑屏障的完整性和通透性会持续被破坏,加重脑水肿[15]。我们研究发现,抑制miR-21表达后会减小脑梗死的体积。
我们建立脑缺血/再灌注模型,检测Bax 蛋白的表达、LC3蛋白的分布等,旨在探讨miR-2l对缺血/再灌注后血脑屏障保护作用与机制。结果显示,miR-2l可能通过下调Bax蛋白的表达抑制凋亡或通过抑制自噬保护血脑屏障。另外miR-2l的表达水平在保护血脑屏障的作用中具有较好的敏感性和特异性,减少脑梗死体积。本研究为miR-2l在诊断和治疗脑缺血/再灌注后血脑屏障中的应用提供了理论基础。

