ERβ对膀胱癌细胞生物活性及MAPK信号通路的影响
于汝通,王 磊,孙国良,蒋 泉,李 洋(河北省承德市中心医院泌尿外科,承德 067000;通讯作者,E-mail:nsgiz0@163.com)
膀胱癌是起源于膀胱黏膜上的一种泌尿系恶性病变。近些年膀胱癌患者发病数量逐渐增多,对人类的健康发展极为不利[1]。膀胱癌早期病症较为隐匿,缺乏特异性,患者通常无明显症状,往往容易被忽视。伴随着病情的发展,患者机体发生间断性血尿、病灶处刺激等症状时才逐渐引起注意,但此时大多患者病情已经处于较为严重阶段,预后效果不理想[2]。有研究表示早期确诊并积极配合治疗的膀胱癌患者的预后更佳[3,4]。研究发现雌激素受体(strogen receptor,ER)可能是引起膀胱癌发生概率更高的重要因素之一[5]。ER来自核受体超家族,是由配体激活的转录因子。有报道显示ER信号途径在多种类型的恶性肿瘤疾病的发生、发展中发挥重要作用,这受到广大学者的关注[6]。其亚型之一的ERβ在膀胱癌组织中的表达上调且与膀胱癌的病理分级以及患者生存期密切相关,可作为该病的预后指标之一[7]。但目前有研究表明抑制ERβ表达对膀胱癌细胞的增殖、迁移等过程发挥抑制作用,但其作用机制尚不明确。因此本研究中我们通过降低ERβ在膀胱癌细胞中的表达水平探讨其对膀胱癌细胞生物活性的影响机制,以期为膀胱癌的诊疗开辟出新的途径。
1 材料和方法
1.1 一般资料
选取2018年2月至2019年8月于我院治疗的30例膀胱癌患者的手术病例标本以及癌旁2 cm的组织作为研究样本,样本经石蜡包埋,存于-80 ℃液氮,且经过本院伦理委员会本次研究审核批准。BIU-87细胞购买自青岛奥科生物开发有限公司。
1.2 纳入标准
①已确诊为膀胱癌;②患者及家属对本次研究知情同意;③首次接受膀胱癌手术治疗。
1.3 排除标准
①经过放化疗冶疗的患者;②患者资料不完整;③患者拒绝配合相关研究等。
1.4 实验仪器与试剂
免疫组化SP试剂盒(上海沪震生物科技有限公司);RT-PCR试剂盒(上海谷研);ERβ及阴性对照siRNA(浙江百奥迈科);流式细胞仪(江苏海博生物);电泳仪、PCR仪(北京由莱普特科学仪器);PVDF膜(北京环宇金鹰);恒温摇床(上海沉汇仪器Co.,Ltd)等。胎牛血清(滁州仕诺达生物科技);P38 MAPK、p-P38 MAPK抗体购自上海雷浩信息科技);二甲基亚砜(DMSO)购自金克隆(北京)生物技术;Transwell小室购自北京明阳科华生物科技。
1.5 细胞培养及处理
1.5.1 细胞培养 在DMEM培育液(有胎牛血清)中培养BIU-87细胞株。细胞数到80%-90%时进行胰蛋白酶消化,然后采取1 600 r/min离心5 min,收集、重悬并培养细胞。
1.5.2 分组 将膀胱癌细胞分为膀胱癌组(无转染BIU-87细胞)、ERβ-NC组(转染ERβ空载体)、ERβ-siRNA组(转染ERβ siRNA)。
1.5.3 细胞转染 将数量为1×104个的BIU-87细胞株接种到96孔中,15 h后,待BIU-87细胞重复融合,在EP管中放入200 μl转染液体(Lipofectamine 2000转染试剂)和4 μl脂质体,然后分别加入5 μg的ERβ siRNA和5 μg ERβ空载体,充分混合后,转染9 h后,用含血清双抗的培养液继续培养。
1.6 实验方法
1.6.1 细胞免疫组化检测ERβ在膀胱癌组织及其癌旁组织中的表达 采用SP法,步骤参照说明书。取样本脱蜡水化,H2O2失活,低火加热1 min修复抗原加血清封闭,加一抗P38 MAPK及ERK1/2(1 ∶1 000),PBS冲洗,再加入IgG(1 ∶2 000),最后加入DAB显色剂染色。染色时,以PBS代替一抗。显微镜观察结果。膀胱癌组织中的阳性信号为淡黄色至棕褐色,位于细胞核。计分采用4级记分评价方法,标准如下:无染色,分值A为0分,染色细胞占比为0-5%,分值B为0分;浅黄色染色,分值A为1分,染色细胞占比为6%-25%,分值B为1分;棕黄色染色,分值A为2分,染色细胞占比为26%-49%,分值B为2分;棕色染色,分值A为3分,染色细胞占比为50%-100%,分值B为3分。分值A与B之和为0分或者1分表示细胞为阴性,A与B之和为≥2分为阳性。
1.6.2 RT-PCR检测ERβ、P38 MAPK mRNA表达 把保存在-80 ℃环境中的BIU-87细胞取出研磨,用Trizol进行总RNA的提取,逆转录参照说明书执行,将逆转后所得的cDNA进行荧光反应实验。所有反应严格按照反应的条件进行扩增,内参采用GAPDH,变性95 ℃ 3 min变性95 ℃ 5 s退火60 ℃ 1 min共40个循环。取平均值计算Ct值,计算方法用2-ΔΔCt法。序列见表1。
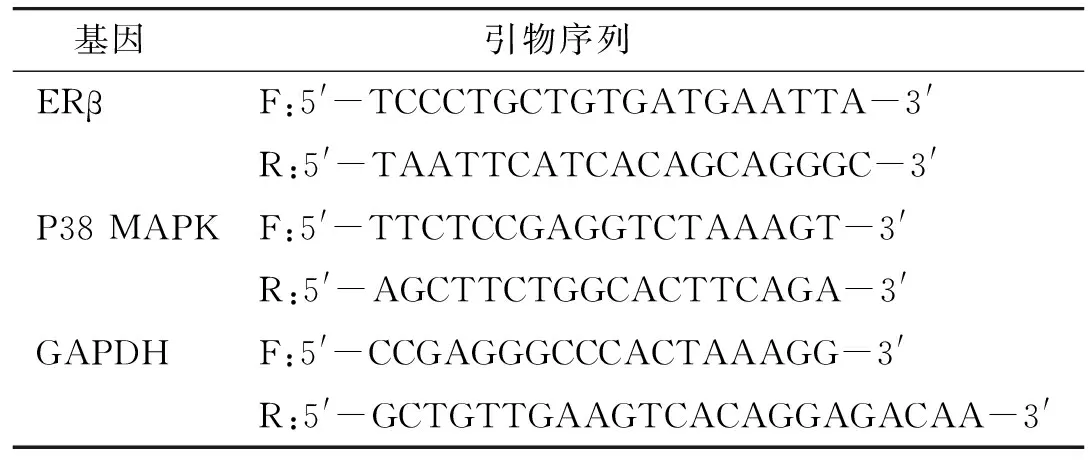
表1 ERβ、P38 MAPK基因引物序列Table 1 Primer sequences of ERβ and P38 MAPK
1.6.3 MTT细胞活力检测 细胞数量、接种同1.5.1细胞培养方法,然后将细胞置于5%CO2、37 ℃培养12 h,转染24 h,然后换液(此时即为0 h)。继续培养0-96 h,每24 h记录,吸弃培养液,加新培养液100 μl和5 mg/ml的MTT溶液20 μl,孵育4 h,吸弃培养液,每孔加入150 μl DMSO,振荡孵育10 min。酶联免疫检测仪492 nm测定光吸收值。
1.6.4 Hoechst33258荧光染色法检测细胞凋亡 膀胱癌组、ERβ-NC组和ERβ-siRNA组BIU-87细胞接种、数量同1.5.1细胞培养方法后,采用40 g/L的多聚甲醛固定0.5 h,采用TrintonX-100透明处理,加入Hoechst荧光材料染色,常温下0.5 h后,检测细胞凋亡(SW480细胞核固缩,呈现碎片状),凋亡率=凋亡细胞/细胞总数×100%。
1.6.5 Transwell小室检测细胞侵袭能力 膀胱癌组、ERβ-NC组和ERβ-siRNA组BIU-87细胞接种、数量同1.5.1,将50 mg/L的基质胶稀释后加入小室上层,37 ℃下呈凝胶状态,细胞数目为1×105/ml,上室中加入细胞悬液,下室中加入少量胎牛血清培养基,37.5 ℃,培养2 d,取出培养基,拭去残留细胞,现配结晶紫,每孔500 μl,将小室放入,25 ℃染色30 min,PBS清洗1次,稍晾干。显微镜观察每个样本连续选5清晰视野进行数量统计,然后计算器平均数。
1.6.6 Transwell实验检测膀胱癌BIU-87细胞迁移 膀胱癌组、ERβ-NC组和ERβ-siRNA组BIU-87细胞放于6孔板内,细胞充分生长长满底部时,每隔0.5 cm利用Mark画一条垂直线,穿过孔,PBS清洗3次,加入培养基24 h取样,显微镜拍照,用Leica图形分析系统测量植块边缘至迁移出膀胱癌细胞的最远相对距离,用显微测量尺校正并计算迁移的最远距离。
1.6.7 Westernblot检测蛋白表达 将BIU-87细胞进行裂解并提取核蛋白,并对核蛋白的浓度进行测量,分装后,保存在-20 ℃的环境中。将提取出的蛋白溶液和缓冲溶液进行混匀,按照4 ∶1的比例进行,为了让蛋白质变性需将蛋白溶液全部进行煮沸处置。50 μg蛋白样品电泳后转移到PVDF膜上,加脱脂奶粉封闭1 h。加入一抗P38 MAPK及ERK1/2(1 ∶1 000)后TTBS3次漂洗(间隔10 min),最后加入IgG(1 ∶2 000)对溶液稀释,25 ℃封闭1 h。取出PVDF膜TTBS漂洗3次(间隔10 min),DAB显色后照相。
1.7 统计学分析
采用SPSS23.0软件分析膀胱癌组、ERβ-NC组、ERβ-siRNA组BIU-87细胞侵袭、凋亡等数据,多组比较采用单因素方差分析,多个时间点比较重复测量方差分析,事后检验采用Bonferroni法进行组间两两比较,以P<0.05为差异有统计学意义。
2 结果
2.1 免疫组化法检测ERβ在膀胱癌组织和癌旁组织阳性表达率
结果显示ERβ阳性细胞呈淡黄色或棕黄色颗粒,位于细胞核中(见图1),ERβ在膀胱癌组织中的阳性率为46.67%,在癌旁组织中阳性率为6.67%,差异有统计学意义(P<0.05,见表2)。

箭头所指为ERβ阳性表达,主要存在于细胞核中图1 膀胱癌及癌旁组织中ERβ阳性表达 (×200)Figure 1 Positive expression of ERβ in bladder cancer tissues and adjacent tissues (×200)
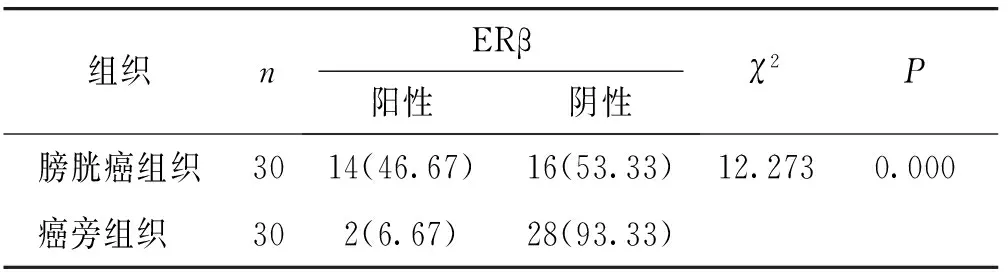
表2 ERβ在不同组织中的表达 例(%)Table 2 The expression of ERβ in different tissues cases(%)
2.2 RT-PCR检测BIU-87细胞中ERβ、P38 MAPK mRNA相对表达量
三组比较,ERβ-siRNA组BIU-87细胞中ERβ的表达量最低(见图2),提示转染成功。ERβ-siRNA组ERβ及P38 MAPK mRNA表达量低于其他两组(P<0.01),膀胱癌组和ERβ-NC组ERβ及P38 MAPK mRNA相对表达量相似,差异无统计学意义(P>0.05,见图2)。

与膀胱癌组相比,*P<0.05,**P<0.01;与ERβ-NC组相比,#P<0.05,##P<0.01图2 ERβ-siRNA对三组细胞ERβ、P38 MAPK mRNA表达量的影响Figure 2 Effects of ERβ-siRNA on mRNA expression of ERβ and P38 MAPK in three groups
2.3 MTT检测膀胱癌组、ERβ-NC组、ERβ-siRNA组BIU-87细胞活力
结果显示,BIU-87细胞活力呈时间依赖性增加,培养24 h时,三组间BIU-87细胞活力无统计学差异(P>0.05),培养48,72,96 h时,ERβ-siRNA组BIU-87细胞活力较膀胱癌组和ERβ-NC组比较明显减弱(P<0.05),膀胱癌组BIU-87细胞活力与ERβ-NC组比较差异无统计学意义(P>0.05,见图3)。
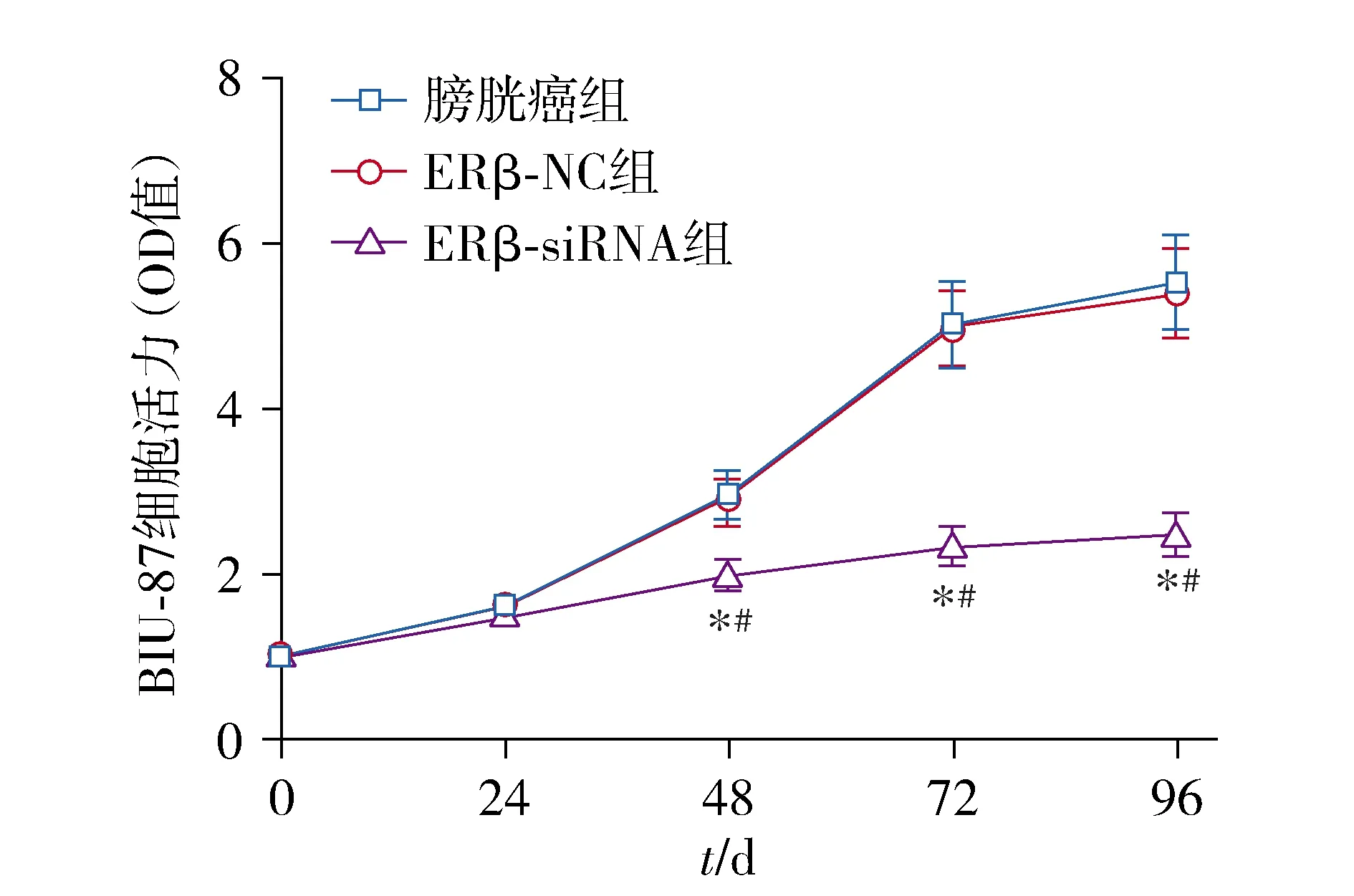
与膀胱癌组相比,*P<0.05;与ERβ-NC组相比,#P<0.05图3 ERβ-siRNA对三组细胞活力的影响Figure 3 Effects of ERβ-siRNA on the viability of three groups of cells
2.4 Hoechst33258荧光染色检测膀胱癌细胞凋亡
结果显示ERβ-siRNA组与膀胱癌组、ERβ-NC组比较BIU-87细胞凋亡数量最多(P<0.05);膀胱癌组BIU-87细胞荧光强度最弱,细胞凋亡率最低,膀胱癌组与ERβ-NC组比较差异无统计学意义(P>0.05,见图4,5)。
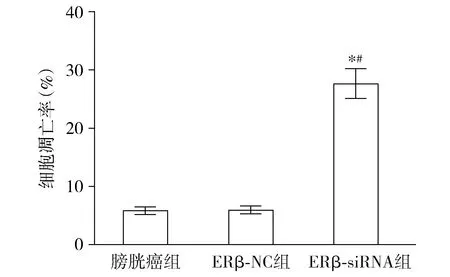
与膀胱癌组相比,*P<0.05;与ERβ-NC组相比,#P<0.05图4 ERβ-siRNA对三组细胞凋亡率的影响Figure 4 Effects of ERβ-siRNA on apoptosis rate of BIU-87 cells in three groups

图5 Hoechst 33258荧光染色观察ERβ-siRNA对膀胱癌细胞凋亡的影响 (×400)Figure 5 Effects of ERβ-siRNA on apoptosis rate of BIU-87 cells by Hoechst 33258 fluoresence staining (×400)
2.5 Transwell小室检测BIU-87细胞侵袭情况
膀胱癌组、ERβ-NC组和ERβ-siRNA组BIU-87细胞侵袭数量比较有显著差异(F=1857,P<0.001),其中ERβ-siRNA组侵袭数量明显少于其他两组(均P<0.05),ERβ-NC组细胞侵袭数量与膀胱癌组相比差异无统计学意义(P>0.05,见图6,7)。
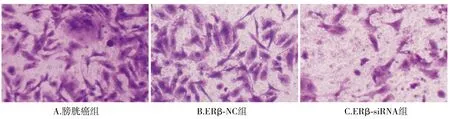
图6 Transwell小室检测观察ERβ-siRNA对细胞侵袭的影响 (×400)Figure 6 Effect of ERβ-siRNA on the cell invasion by Transwell chamber assay (×400)
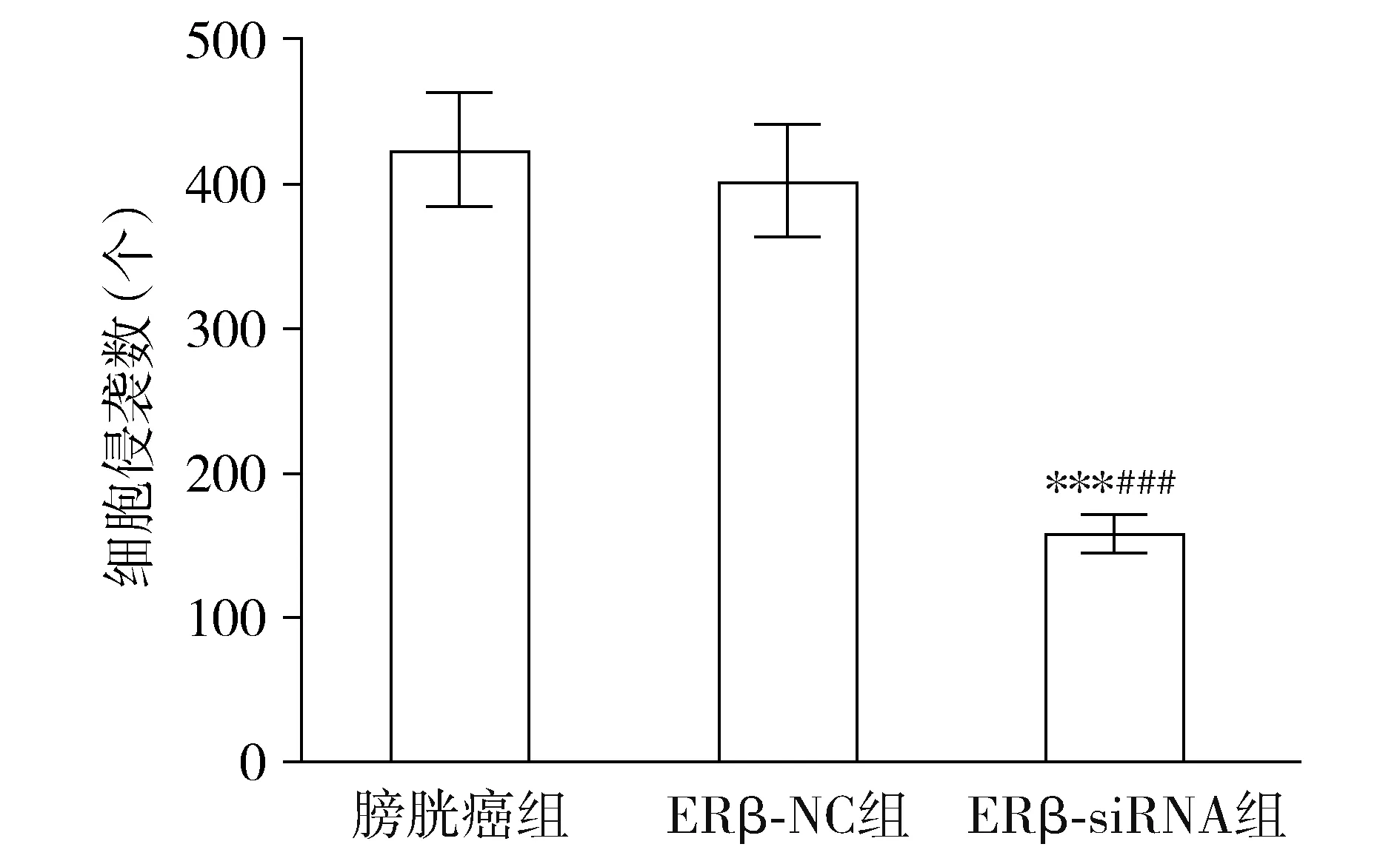
与膀胱癌组相比,***P<0.001;与ERβ-NC组相比,###P<0.001图7 ERβ-siRNA对膀胱癌细胞侵袭数量的影响Figure 7 Effect of ERβ-siRNA on the number of cell invasion in three groups
2.6 细胞划痕实验检测细胞迁移
培养0 h时,各组BIU-87细胞无迁移;培养24 h时,ERβ-siRNA组BIU-87细胞迁移距离与ERβ-NC组及膀胱癌组比较明显增加(均P<0.05),ERβ-NC组BIU-87细胞迁移距离与膀胱癌组比较差异无统计学意义(P>0.05,见图8,9)。

与膀胱癌组相比,*P<0.05;与ERβ-NC组相比,#P<0.05图8 ERβ-siRNA对三组细胞迁移的影响Figure 8 Effects of ERβ-siRNA on cell migration in three groups
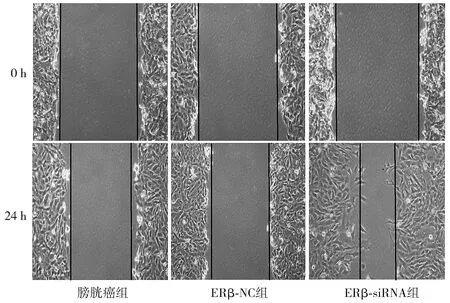
图9 Transwell小室检测ERβ-siRNA对三组细胞迁移的影响 (×400)Figure 9 Effects of ERβ-siRNA on cell migration in three groups by Transwell assay (×400)
2.7 Westernblot法检测细胞中蛋白相对表达量
ERβ-siRNA组BIU-87细胞中P38 MAPK、p-P38 MAPK及ERK1/2蛋白表达与膀胱癌组、ERβ-NC组比较明显降低(P<0.01),膀胱癌组P38 MAPK、p-P38 MAPK及ERK1/2蛋白表达量与ERβ-NC组比较差异无统计学意义(P>0.05,见图10)。
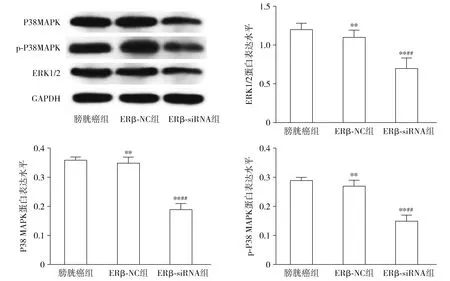
与膀胱癌组相比,*P<0.05,**P<0.01;与ERβ-NC组相比,#P<0.05,##P<0.01图10 ERβ-siRNA对细胞中P38 MAPK、p-P38 MAPK及ERK1/2的蛋白表达水平的影响Figure 10 Effect of ERβ-siRNA on the protein expression levels of P38 MAPK, p-P38 MAPK and ERK1/2 in three groups
3 讨论
目前在膀胱癌的治疗中主要依靠手术切除配合化疗来缓解患者的病痛,但是该治疗方式被证实也存在局限性,多类并发症的发生以及手术对医生经验技术的依赖都给手术结果造成了不确定性[8]。近些年大量研究证实雌激素受体能够通过ERβ调节尿路上皮癌细胞的生长参与膀胱癌的发生发展进程,因此有学者推测可将ERβ作为膀胱癌治疗的重要靶点,该发现为该病的治疗提供了新的方向[9]。ERβ定位于染色体14q22-24,近些年关于其与各类肿瘤疾病的研究较为常见,但其在肿瘤疾病中的机制尚未完全阐明[10]。因此在本研究中我们通过抑制物转染膀胱癌细胞并进行实验检测,观察ERβ对膀胱癌细胞株侵袭、增殖等生物活性的影响。
在既往研究中关于雄性激素受体与膀胱癌关系的研究较为常见,大量报道证实雄性激素参与膀胱癌的发生、发展并在其中发挥重要作用[11]。ERβ是ER的亚型之一,主要分布于卵巢、甲状腺、膀胱等组织中,近些年其在膀胱癌的发展研究中受到关注。舒筠然等[12]学者在研究中表示ERβ在膀胱癌中过表达与膀胱癌的严重程度正相关,在膀胱癌的发生过程中发挥主导作用,其机制可能与调控P2RY2e的表达相关。有研究表明[13],ERβ可作为评估非肌肉浸润型膀胱癌预后的指标,可抑制钙黏蛋白转换,并可能成为膀胱癌治疗的潜在靶点。以上研究结果皆提示ERβ在膀胱癌细胞中表达失调。本研究中我们采用免疫组法检测发现ERβ在膀胱癌组织中的表达较癌旁组织明显提升,本文通过对膀胱癌细胞株转染抑制物ERβ-siRNA,结果显示转染ERβ-siRNA的细胞活性降低,细胞的迁移、侵袭能力较其他两组明显弱化,细胞的凋亡数量升高,提示减少ERβ的表达能够降低膀胱癌细胞的生物活性,促进癌细胞凋亡。丁梦婷[14]研究结果指出,肥大细胞的增加对膀胱癌细胞的侵袭发挥促进作用,加速了膀胱癌患者不良结局的发生概率,其机制与ERβ的活化相关,且实验中采用ERβ拮抗剂降低ERβ在膀胱癌细胞中的表达,结果发现肥大细胞对膀胱癌细胞活性的促进作用得到有效逆转,为膀胱癌的治疗提供了新的靶标,这与本文研究结果相似。有学者的研究[15]显示,miR-451能够通过增加E-cadherin的表达抑制膀胱癌细胞的侵袭、增殖等生物进程。姚佳沛等[16]在研究中收集了60例膀胱癌根治手术患者的病理组织进行检测发现ERβ在膀胱癌组织中的表达升高。
MAPK信号通路一旦被激活进入细胞核内可以调控重要的细胞活动,其磷酸化后激活转录分子调节基因表达,在细胞的迁移、凋亡等过程中具有重要作用。p-P38 MAPK、ERK1/2是MAPK的重要组成部分,有文献表明ERK1及MAPK磷酸化p-P38 MAPK信号通路参与肿瘤的发生发展,其信号通路被活化后可提高肿瘤细胞的生物活性[17]。于洋等[18]研究发现,敲除ERβ表达可降低前列腺癌PC3细胞增殖、侵袭,其作用机制与抑制ERK1/2信号通路有关。潘国凤等[19]通过体外细胞实验建立乳腺癌大鼠模型,结果表明雌激素受体可通过抑制p38-MAPK及ERK磷酸化水平来降低肿瘤增殖,提高其凋亡率。国外研究表明雌激素受体可诱导肿瘤的发生发展,通过诱导17β-雌二醇调节p38/MAPK水平,从而改善结肠癌肿瘤[20]。
综上所述,下调ERβ的表达对抑制膀胱癌细胞迁移、侵袭等生物活性发挥积极作用,分析原因可能与靶向调控p-P38 MAPK及ERK1/2信号相关。本实验在研究的过程中有一定的不足,由于成本等问题,本文仅对我院收集的30例患者膀胱癌样本进行实验,样本量较小,不能排除细胞种类对实验所带来的影响。另外,本组实验只采用ERβ抑制物进行试验,具有局限性,在今后的研究中应加入更多的实验方法为膀胱癌诊疗方案的研究贡献更有利的科学依据。

