胃息肉与幽门螺杆菌感染的关系
周 政
(宣城市人民医院消化内科,安徽 宣城 242000)
随着消化道内镜检查的普及和应用,胃息肉的检出率逐年升高。胃息肉的病理组织学分型主要分为增生性、炎性、腺瘤性、胃底腺息肉等[1]。胃底腺息肉多发于胃体,其次是胃底,还有少部分发生于贲门、胃窦、胃角等部位[2]。增生性息肉可发生于胃的任何部位,如胃体、胃底、胃窦、胃角、贲门,直径大小不等,多不超过1 cm,主要是广基性息肉,较大的增生性息肉可有蒂或亚蒂。腺瘤性息肉分为管状腺瘤、绒毛管状腺瘤、绒毛状腺瘤。炎性息肉是胃粘膜组织的良性增生,大多无蒂,体积较小,形状似黄豆或绿豆大小,表面光滑,部分可伴有糜烂溃疡[3]。多见于胃部长期慢性炎症的人群。目前幽门螺杆菌是引起慢性胃炎、胃溃疡、十二指肠球部溃疡的重要致病原因。幽门螺杆菌感染(Hp)感染与部分胃息肉有着一定的关系;研究表明[4-6],部分病理类型的胃息肉发生可能与幽门螺杆菌感染有关,特别是增生性息肉及胃底腺息肉。本研究通过分析胃息肉患者的幽门螺杆菌感染及治疗情况,探讨胃息肉与幽门螺杆菌感染的关系,分析不同治疗方法对胃息肉复发率的影响。
1 资料与方法
1.1 一般资料 收集2018 年10 月-2019 年10 月宣城市人民医院收治的胃息肉患者520例。所有患者均进行内镜下胃息肉切除术,方法为氩离子凝固术(APC)、内镜下黏膜切除术(EMR)、内镜下黏膜剥离术(ESD)。所有病例随访6 个月。依据幽门螺杆菌是否感染及治疗分为Hp 根治组110例、非Hp 根治组100例、非Hp 感染组310例。纳入标准:①经胃镜检查提示胃息肉;②有病理化验或碳14 呼气实验检查。排除标准:①家族性息肉病、Gardner 综合征、Peutz-Jegher 综合征患者;②消化道肿瘤患者;③不能配合检查或随访的患者。
1.2 方法 收集符合纳入标准的患者姓名、性别、年龄、电子胃镜下胃息肉的部位、数目、病理结果、微创治疗方法。仪器包括电子胃镜(日本奥林巴司公司Olympus GIF 260、GIF290)、高频电发生器、注射针、圈套器、活检钳、异物钳、金属钛夹、麻醉机等设备。镜检前禁食8 h,禁水4 h,有严重心脏病、上消化道大出血体征不平稳、精神不正常不能配合检查者、腐蚀性食管炎、动脉瘤患者、怀疑胃肠道穿孔者、传染病为相对禁忌。常规内镜检查食管、贲门、胃体、胃窦、胃角、十二指肠球部、十二指肠降部。发现胃息肉病变处至少取一块组织进行病理检查,评估胃息肉的组织学分型及幽门螺杆菌感染情况,详细记录胃息肉数量、大小、部位。
1.3 观察指标 比较各组年龄、性别、息肉部位、个数、直径大小、不同治疗方法和病理类型,进行Hp 感染情况分析,分析胃息肉的病理类型、不同部位、单发及多发、不同息肉大小与Hp 感染的关系及抗Hp 治疗和不同治疗方法与胃息肉复发之间的关系。
1.4 统计学方法 采用SPSS 17.0 软件进行统计分析,计数资料使用(n)表示,采用χ2检验,以α=0.05为检验水准,P<0.05 为差异有统计学意义。
2 结果
2.1 患者临床特征分析 本研究共纳入胃息肉患者520例,其中男250例,女270例;Hp 阳性210例,占40.38%;抗Hp 治疗110例,非抗Hp 治疗100例,其中12例抗Hp 治疗后复查仍阳性,抗Hp 成功率89.09%;所有病例随访6 个月,其中失访18例;三组不同年龄、性别、息肉部位、息肉个数及大小比较,差异无统计学意义(P>0.05);三组不同病理类型及治疗方法比较,差异有统计学意义(P<0.05),见表1。
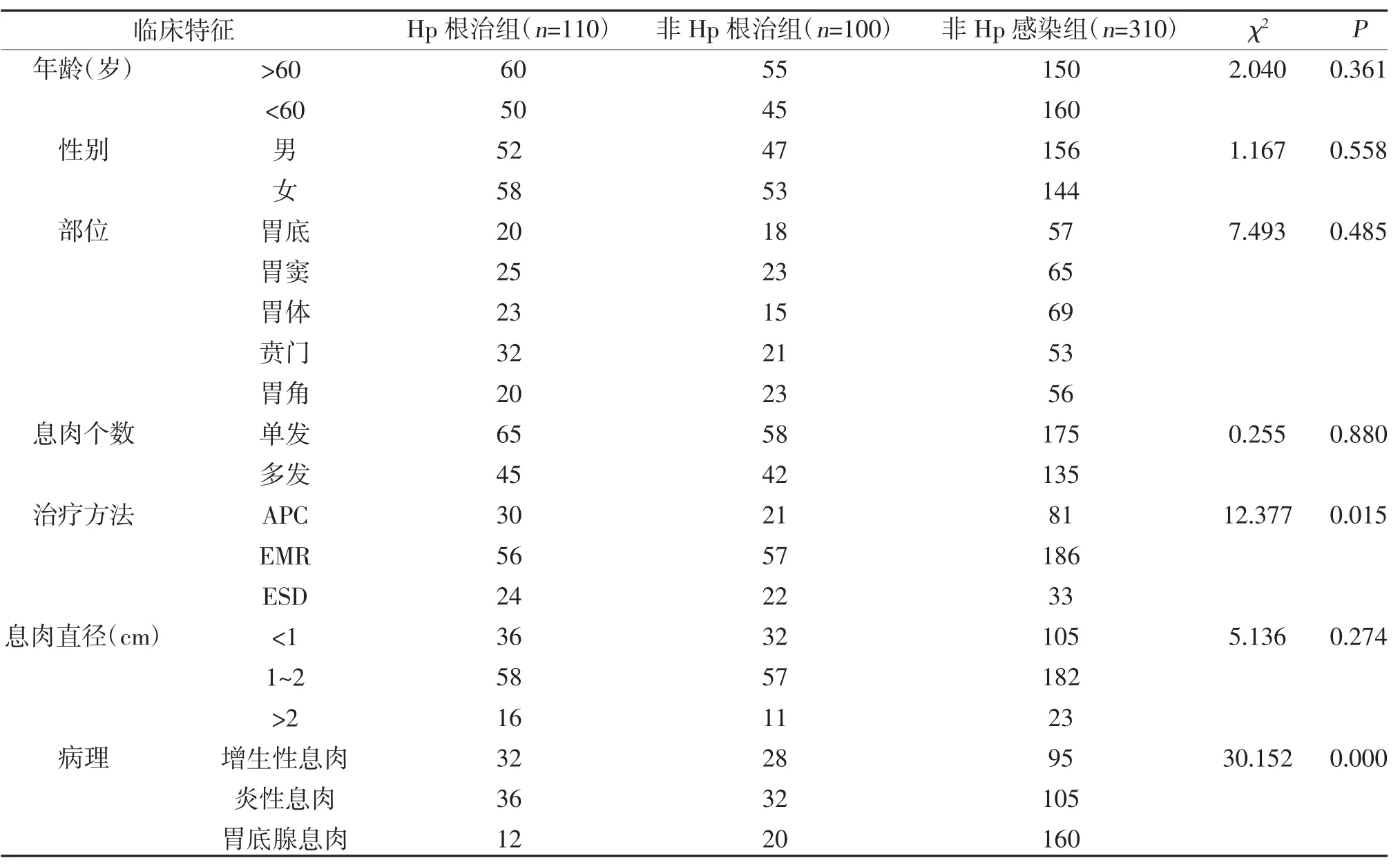
表1 胃息肉患者的临床特征(n)
2.2 胃息肉相关临床特征与Hp 感染的关系 胃息肉病例中,以胃底腺息肉为主,增生性息肉和炎性息肉Hp 感染率较高。不同病理类型胃息肉HP 感染率比较,差异有统计学意义(P<0.05);不同部位、个数及大小胃息肉Hp 感染率比较,差异无统计学意义(P>0.05),见表2。
2.3 抗Hp 治疗和不同内镜方法治疗后胃息肉复发情况分析 随访6 个月,抗Hp 治疗组、采用EMR 和ESD 方法的胃息肉复发率较低,差异有统计学意义(P<0.05),见表3。

表3 不同治疗方法胃息肉复发情况分析(n,%)
3 讨论
胃息肉是一组起源于胃粘膜上皮或粘膜下的胃内局限性隆起病变,临床表现缺乏特异性。随着内镜技术的发展,胃息肉的检出率逐渐升高,因部分息肉可发生癌变,常被称为胃癌前病变,且Hp 感染可能在胃息肉癌变过程中起着重要的作用[7,8]。本研究中女性为270例,多余男性的250例;大部分胃息肉直径在1~2 cm;好发于胃窦、胃体部位;常见病理类型为增生性息肉、炎性息肉。
本研究病例在年龄、性别、部位、息肉个数、息肉大小方面均无明显差异,在病理类型、治疗方法方面存在明显差异。大部位息肉病例治疗以APC 和EMR为主,可能与这些息肉直径在1~2 cm 有关。Hp 不仅能促进炎症的发展,而且可以促进胃粘膜增生,Hp可以释放肝细胞生长因子及白介素-1 可以刺激胃上皮细胞增生,导致增生性息肉[9-11]。本研究显示,病理类型中以胃底腺息肉和炎性息肉居多,在增生性息肉和炎性息肉中Hp 感染率较高,其中炎性息肉、增生性息肉Hp 感染率分别为39.31%、38.71%,说明增生性息肉、炎性息肉与Hp 感染有一定的关系。与非抗Hp 组和非Hp 感染组比较,抗Hp 组的胃息肉的复发率降低。目前大部分增生性息肉、炎性息肉在根除Hp 治疗后体积变小或消失,进一步说明增生性息肉、炎性息肉与Hp 感染有一定的关系。对于增生性息肉和炎性息肉,建议内镜下切除,存在Hp 感染给予抗Hp 治疗。胃底腺息肉数量多,可能与质子泵抑制剂的大量应用有关,由于长期使用PPI 导致血浆高胃泌素状态,促进胃腺体代偿性囊状扩张,形成息肉[12],部分患者停用PPI 后息肉可逐渐消退。
APC 存在局部烧灼不全,病变残留可能,EMR存在一部分不完全切除和残留切除可能,ESD 将病灶完整剥离,术后不完全切除和残留切除可能性小[13,14]。在胃息肉的不同治疗方法中,APC 治疗组胃息肉复发率高于EMR 组(P<0.05),可能与胃息肉的不完全切除率较高有关。
综上所述,Hp 感染与增生性息肉和炎性息肉有一定的关系,与息肉的大小、部位、数量无明显关系,抗Hp 治疗后胃息肉的复发率降低,APC 治疗复发率较高,EMR 和ESD 治疗复发率较低,可能与胃息肉的不完全切除和残留切除率较高有关,因此对于对于胃息肉的内镜下治疗,以ESD 和EMR 为主,提高病灶的完全切除率,合并Hp 感染的患者,给予抗Hp 治疗,进一步减少复发率。

