脂多糖对大黄鱼原代头肾巨噬细胞的激活作用
程安怡, 赵金鹏, 黄小红, 张伟妮,
(1.福建农林大学中西兽医结合与动物保健福建省高校重点实验室,福建 福州 350002;2.福建农林大学海洋研究院福建省海洋生物技术重点实验室,福建 福州 350002)
大黄鱼(Larimichthyscrocea)俗称黄花鱼,属鲈形目石首鱼科黄鱼属,是我国养殖产量最高的海水鱼种.据《2021中国渔业统计年鉴》,2020年我国大黄鱼产量为25.4万t.大黄鱼因其体色金黄、寓意吉祥、肉质细嫩、味道鲜美、营养丰富,深受我国等东南亚各国人民的喜爱.然而,随着集约化养殖规模的扩大,疾病问题日益突出,已成为制约大黄鱼养殖产业发展的瓶颈[1].其中,细菌性疾病造成的死亡率占养殖大黄鱼总死亡率的40%[2].革兰氏阴性菌是导致大黄鱼细菌病的主要致病菌,如引起内脏白点病的假单胞菌[3]、引起体表溃疡症的弧菌[4-5]、引起细菌性肠炎病的气单胞菌[6]等.
脂多糖(lipopolysaccharide, LPS)是革兰氏阴性菌细胞壁的成分之一,是脂质和多糖的复合物,也称内毒素.作为革兰氏阴性菌的主要致病成分之一,LPS可以刺激机体产生免疫应答反应,作为免疫激活剂广泛用于免疫学相关研究[7].
头肾是鱼类的主要免疫器官之一,是巨噬细胞增殖和分化的主要场所.头肾巨噬细胞在鱼类免疫应答的过程中发挥重要作用,参与了对外来病原微生物的识别与吞噬、抗原的处理和递呈、特异性免疫应答的启动等,其细胞活性是鱼体免疫功能的重要评价指标[8].研究表明,LPS具有强免疫原性,能促进鱼类巨噬细胞的活化[9-10].然而,LPS对鱼类巨噬细胞的激活作用机制尚不明确.本研究以大黄鱼原代头肾巨噬细胞(primary head kidney macrophages, PKM)为研究对象,检测LPS对细胞吞噬活性、氮呼吸爆发、促炎因子转录水平及受体[Toll样受体(TLR)、甘露糖受体(MR)、核苷酸结合寡聚化结构域(NOD)样受体]基因转录水平的影响,明确LPS对大黄鱼PKM的激活作用,有利于进一步研究LPS对大黄鱼PKM的调控机制.
1 材料与方法
1.1 材料
1.1.1 试验鱼 试验所用大黄鱼购于福建宁德富发大黄鱼养殖基地,体长(23±5) cm,体重(376±35) g.
1.1.2 主要试剂 LPS购于Sigma公司;Percoll购于GE Healthcare公司;GIBCO Leibovitz′s无酚红L-15培养基、GIBCO胰酶(0.25% EDTA)、PE-荧光微球购于Thermo公司;DAF-FM DA(NO荧光探针)购于碧云天公司;红细胞裂解液购于天根公司;细胞总RNA提取试剂盒、反转录试剂盒、Go Taq®qPCR Master Mix 购于Promega公司.
1.2 方法
1.2.1 大黄鱼PKM的分离和培养 大黄鱼PKM的分离和培养参考本课题组之前的方法[11].将健康的大黄鱼用丁香酚麻醉后剖取头肾,过70 μm细胞筛研磨,细胞悬液经34%/51% Percoll密度梯度离心、贴壁处理,得到大黄鱼PKM,用无酚红的L-15培养基于28 ℃培养备用.
1.2.2 吞噬活性的检测 PKM吞噬活性的检测参考本课题组之前的方法[11].细胞分别用含0、0.01、0.1、1、10和100 μg·mL-1LPS的L-15培养基培养24 h,每个含量设置3个重复.弃去培养基,加入1 μL PE-荧光微球,于28 ℃避光孵育3 h后收集细胞,用AccuriTMC6 Plus流式细胞仪检测.
1.2.3 氮呼吸爆发的检测 PKM氮呼吸爆发的检测参考本课题组之前的方法[11].细胞分别用含0、0.01、0.1、1、10和100 μg·mL-1LPS的L-15培养基培养24 h,每个含量设置3个重复.弃去培养基,加入10 μmol·L-1DAF-FM DA,于28 ℃孵育20 min后收集细胞,用AccuriTMC6 Plus流式细胞仪检测.
1.2.4 免疫相关基因mRNA表达的实时荧光定量PCR检测 PKM经10 μg·mL-1LPS分别处理3、6、12和24 h,同时设立空白对照,每组设3个平行.按照Promega细胞总RNA提取试剂盒的操作说明,在不同处理时间收集细胞提取RNA,用反转录试剂盒反转成cDNA第1链,用Go Taq®qPCR Master Mix 试剂盒进行实时荧光定量PCR反应,检测LPS对3种促炎因子(IL-1β、IL-6、IL-8)和7种受体基因(TLR1、TLR2、TLR21、MR1、MR2、NOD1、NOD2)mRNA表达量的影响.所用特异性引物如表1所示.以β-actin为内参基因,对实时荧光定量PCR得到各组样品的Ct值作均一化处理,通过2-△△Ct计算各组样品mRNA的相对表达量.
1.3 数据处理
采用SPSS软件对数据进行单因素方差分析,用LSD判定组间的差异性,P<0.01为差异极显著,P<0.05为差异显著.流式细胞仪所测数据用FlowJo软件进行处理.
2 结果与分析
2.1 LPS对大黄鱼PKM吞噬活性的影响
PKM具有吞噬荧光微球的能力.图1a显示,从左往右,第2个峰表示细胞吞噬一个微球,越往右表示其吞噬微球数量越多.用LPS(0.1、1、10、100 μg·mL-1)处理24 h后,与空白对照组相比,峰值明显升高且右移,说明细胞吞噬荧光微球的数量增多.对各组的平均荧光值进行差异性分析,结果(图1b)显示,1、10、100 μg·mL-1LPS处理24 h可以极显著地增强大黄鱼PKM的吞噬能力(P<0.01),0.1 μg·mL-1LPS处理24 h可以显著增强PKM的吞噬能力(P<0.05),0.01 μg·mL-1LPS处理24 h的吞噬能力与空白对照组的差异不显著.

表1 实时荧光定量PCR所用引物序列Table 1 Primer sequences for real-time PCR

*表示P<0.05,**表示P<0.01.图1 不同含量LPS对大黄鱼PKM吞噬活性的影响Fig.1 Effects of different concentrations of LPS on phagocytic activity of PKM from L.crocea
2.2 LPS对PKM氮呼吸爆发的影响
图2a显示,与空白对照组相比,经1、10、100 μg·mL-1LPS处理24 h后,荧光峰明显右移,说明细胞NO生成量增加.通过对各组的平均荧光值进行差异性分析,结果(图2b)显示:与空白对照组相比,1、10、100 μg·mL-1LPS处理组的平均荧光值极显著升高(P<0.01);而0.01、0.1 μg·mL-1LPS处理组的平均荧光值与空白对照组的差异不显著.

**表示P<0.01.图2 不同含量LPS对大黄鱼PKM氮呼吸爆发的影响Fig.2 Effects of different concentrations of LPS on nitrogen respiration burst of PKM from L.crocea
2.3 LPS对PKM 3种促炎因子mRNA表达水平的影响
LPS对大黄鱼PKM 3种促炎因子(IL-1β、IL-6、IL-8)mRNA表达水平的影响(图3)显示,用10 μg·mL-1LPS处理大黄鱼PKM后,IL-1β、IL-6和IL-8的表达水平在3、6、12和24 h均极显著上调(P<0.01).

**表示P<0.01.图3 LPS对大黄鱼PKM 3种促炎因子mRNA表达水平的影响Fig.3 Effects of LPS on mRNA expression of 3 pro-inflammatory cytokines in PKM from L.crocea
2.4 LPS对PKM 3种Toll样受体mRNA表达水平的影响
LPS对PKM 3种Toll样受体(TLR1、TLR2、TLR21)mRNA表达水平的影响(图4)显示:用10 μg·mL-1LPS处理后,大黄鱼PKMTLR1 mRNA的表达水平在24 h极显著上调(P<0.01),在12 h显著上调(P<0.05),在6 h无显著变化;TLR2 mRNA的表达水平在6、12和24 h极显著上调(P<0.01);TLR21的表达水平在3 h无显著变化,在6、12和24 h极显著上调(P<0.01).

*表示P<0.05,**表示P<0.01.图4 LPS对大黄鱼PKM 3种Toll样受体 mRNA表达水平的影响Fig.4 Effects of LPS on mRNA expression of 3 Toll-like receptors in PKM from L.crocea
2.5 LPS对PKM 2种甘露糖受体mRNA表达水平的影响
图5显示:用10 μg·mL-1LPS处理后,PKM甘露糖受体MR1 mRNA的表达水平在3、6、12和24 h均极显著下调(P<0.01);甘露糖受体MR2 mRNA的表达水平在3、6、12和24 h均极显著上调(P<0.01).
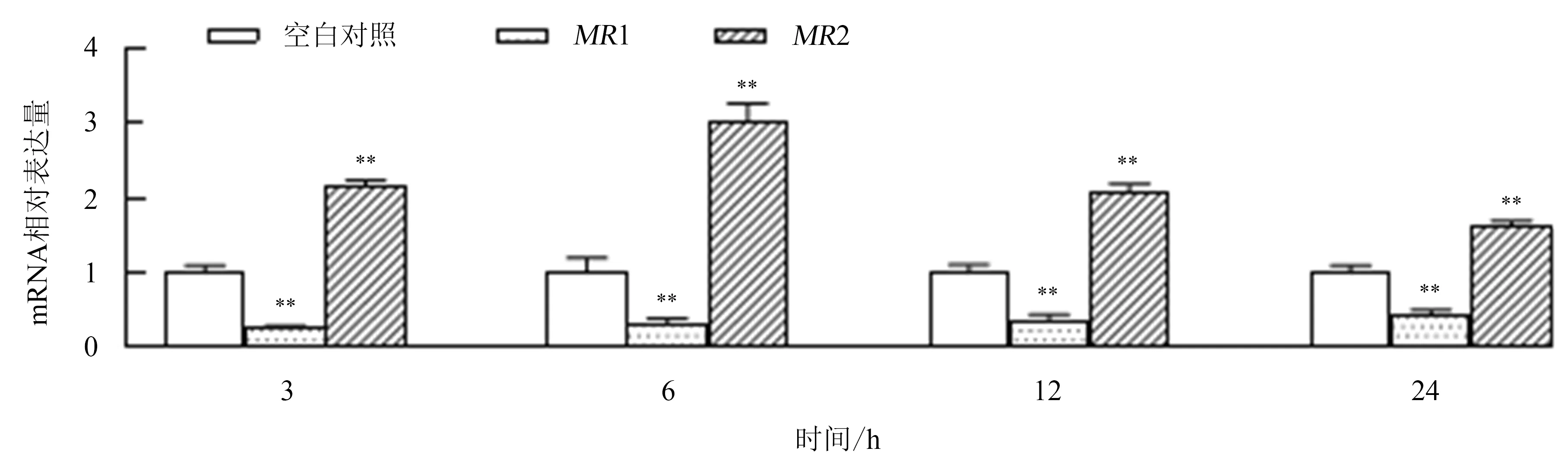
**表示P<0.01.图5 LPS对大黄鱼PKM 2种甘露糖受体mRNA表达水平的影响Fig.5 Effects of LPS on mRNA expression of 2 mannose receptors in PKM from L.crocea
2.6 LPS对PKM 2种NOD样受体mRNA表达水平的影响
图6显示,用10 μg·mL-1LPS处理大黄鱼PKM后,2种NOD样受体NOD1和NOD2 mRNA的表达水平在3、6、12和24 h均极显著上调(P<0.01).

**表示P<0.01.图6 LPS对大黄鱼PKM 2种NOD样受体mRNA表达水平的影响Fig.6 Effects of LPS on mRNA expression of 2 NOD receptors in PKM from L.crocea
3 讨论
巨噬细胞在鱼类免疫应答的过程中发挥着重要的功能.通常情况下,鱼体中的巨噬细胞处于相对静止的状态,吞噬活性和需氧代谢都很低,仅具有一定的非特异性吞噬和趋化能力.当巨噬细胞被激活后,通过经典或替代途径分化成M1或M2型巨噬细胞[12].M1型巨噬细胞的典型标志是吞噬能力增强、大量合成促炎因子、产生NO和O2-等反应氧族,主要参与病原的清除和炎症反应的启动[13];相反,M2型巨噬细胞能分泌抗炎因子和精氨酸酶等,减少NO生成,修复细胞因炎症反应带来的损伤,利于组织修复[14].本研究结果显示,LPS能够增强大黄鱼PKM的吞噬能力,提高NO的生成量,上调3种促炎因子基因(IL-1β、IL-6、IL-8)的表达水平,说明LPS可以激活大黄鱼PKM,并刺激其向M1型巨噬细胞分化.这与在人原代外周血巨噬细胞[15]、小鼠原代腹腔和肠道巨噬细胞[16]、小鼠腹腔巨噬细胞RAW264.7[17]及鸡巨噬细胞HD11[18]中的结果是一致的.IL-1β、IL-6和IL-8是巨噬细胞产生的3种主要促炎因子.在炎症反应中,IL-1β可以活化T细胞并促进其增殖分化,IL-6可以促进B细胞增殖分化、产生抗体,而IL-8主要起到趋化中性粒细胞和T细胞的作用[19].本研究中随着LPS刺激时间的延长,IL-8 mRNA表达量的升高最明显,说明其趋化作用逐渐增强,促使炎症反应加剧.
Toll样受体是机体天然免疫系统的重要组成部分,能识别多种病原体相关分子模式.位于革兰氏阴性菌外膜上的LPS,能够与宿主细胞表面Toll样受体结合从而诱导细胞产生免疫应答[20].在哺乳动物中,已证实TLR4是LPS的主要识别受体[21],LPS可被TLR4识别诱导腹腔巨噬细胞的活化,产生 IL-1β、IL-6、TNF-α和NO[22].然而在鱼类中,仅有少数鲤科鱼类存在TLR4,且已证实其对LPS刺激不响应[23].
TLR1和TLR2都属于TLR1亚家族,分布在细胞膜上,主要识别革兰氏阳性菌、革兰氏阴性菌和病毒;TLR21属于TLR11亚家族,也分布在细胞膜上,能够广泛识别RNA和DNA病毒以及侵染的细菌,在非特异性免疫中发挥重要作用[24].秦勤等[25]研究表明,LPS刺激48 h后可以提高人角膜上皮细胞中TLR1和TLR2基因的表达量;王梁华等[15]研究表明,TLR2抗体可以抑制LPS对巨噬细胞吞噬能力的激活,证明TLR2参与了细胞对LPS的识别;冯伟科等[26]研究表明,LPS能诱导鼠源巨噬细胞RAW264.7 TLR2 mRNA表达量的上调;盛金良等[20]研究表明,在LPS刺激后,绵羊肺泡巨噬细胞TLR2 mRNA在12 h的表达水平最高.在本研究中,LPS刺激6 h后开始能够极显著上调大黄鱼PKMTLR2和TLR21 mRNA的表达量,刺激12 h后能够显著上调TLR1 mRNA的表达量.不同的TLR成员识别不同的特异性配体,目前尚无鱼类TLR与LPS识别的直接证据.本研究结果显示,大黄鱼PKMTLR1、TLR2和TLR21对LPS刺激均有响应,其中,TLR21响应程度最强,然而其是否直接参与了细胞对LPS的识别还需要进一步证实.
甘露糖受体是一种跨膜糖蛋白,属于C型凝集素家族,在巨噬细胞和树突状细胞等多种免疫细胞上均存在[27-28].甘露糖受体是吞噬细胞重要的模式识别受体和内吞受体,可以识别多种内源性和外源性的糖分子[29].已有研究表明,巨噬细胞能通过甘露糖受体的C型凝集素样结构域(CTLD)识别LPS,从而介导对病原菌的清除[30].本研究结果显示:大黄鱼PKMMR1和MR2对LPS刺激均有响应,但变化趋势不同;LPS能够显著上调MR2的表达,下调MR1的表达,揭示了2种甘露糖受体在LPS识别过程中行使着不同的功能.
NOD1和NOD2都是NOD样受体家族的成员,在细菌识别和激活免疫反应中起着至关重要的作用[31].NOD2主要在骨髓细胞、单细胞、巨噬细胞和树突状细胞中表达;NOD1的分布更广泛,上皮细胞中也有表达[32].在鱼类中,NOD1能响应革兰氏阴性菌的感染,并可能在细菌成分的鉴定中发挥重要作用.NOD1可以识别LPS,通过受体相互作用丝氨酸苏氨酸激酶2(RIPK2)激活NF-κB信号通路,进而促进炎性细胞因子的表达,诱导机体对细菌感染的反应.LPS可以通过与鮸鱼(Miichthysmiiuy)巨噬细胞NOD1结合并激活NF-κB发挥调节巨噬细胞的功能,上调TNF-α、IL-1β、IL-6和IL-8的表达[33].本研究结果表明,大黄鱼PKMNOD1和NOD2均对LPS的刺激有响应.
4 结论
本研究结果表明,LPS可以显著提高大黄鱼PKM的吞噬活性和NO生成量,上调细胞IL-1β、IL-6和IL-8等3种促炎因子基因的表达,对大黄鱼PKM有明显的激活作用,并刺激其向M1型巨噬细胞分化.此外,TLR1、TLR2、TLR21、MR2、NOD1和NOD2对LPS刺激均有响应,鱼类巨噬细胞识别LPS的关键受体还有待进一步研究.

