苦荞FtERD家族糖转运基因的鉴定与分析
梁成刚, 韦春玉, 汪 燕, 关志秀, 邓 娇, 黄 娟, 石桃雄
(贵州师范大学生命科学学院荞麦产业技术研究中心,贵州 贵阳 550001)
植物早期脱水响应蛋白(early responsive to dehydration,ERD)包含糖转运蛋白[1]、泛素[2]、热激蛋白[2]、谷胱甘肽转移酶[3]、ATP依赖型蛋白酶调节亚基等[4].Kiyosue et al[2]通过水分胁迫,在拟南芥中筛选到26个AtERDs克隆,并利用southern杂交将其归为16组.刘松涛等[5]则基于干旱胁迫转录组数据,鉴定到5个ZmERD基因.植物ERD家族蛋白功能较为广泛,是逆境胁迫快速响应因子,具有调节逆境耐受性的重要作用.例如,ERD1为ClpA同源蛋白,受脱水快速诱导[4].ZmERD3蛋白在盐胁迫与干旱胁迫响应过程中起重要作用[6].同样,拟南芥AtERD4蛋白在盐胁迫和干旱胁迫中发挥重要作用[7-8].拟南芥AtERD6蛋白为糖转移载体,受脱水快速诱导,在干旱胁迫中发挥作用[1].大豆GmERD15为转录因子,可在渗透胁迫下激活NRP-B表达,进而在细胞死亡信号传导过程中发挥作用[9].玉米ZmERD16为泛素延伸蛋白,ZmERD16启动区域具有多个干旱、病害、光、激素等胁迫应答元件[10].
苦荞(Fagopyrumtararicum)是我国重要的杂粮作物,主要种植于中国西南的高寒山区[11].苦荞主产区土壤贫瘠,干旱频繁发生,在这种特殊的生长环境中,苦荞具备了较强的耐贫瘠、耐干旱、耐冷凉等优良特性[12].糖类对于植物生长发育乃至逆境响应与耐受性等具有至关重要的作用[13].近年来调控打破糖类运输与分配的瓶颈在作物改良中取得了重要进展[14].植物ERD蛋白中ERD6则通过调控糖的跨膜运输参与干旱等逆境胁迫的快速响应.目前,对作物ERD蛋白的研究工作开展相对较少,仅在少数模式作物中有报道[5,10].本试验首次对苦荞FtERD家族中糖转运基因进行筛选、鉴定与生物信息学分析,明确FtERD糖转运基因的分类、蛋白理化特性、系统发育关系,并结合转录组测序分析苦荞FtERD糖转运基因表达模式等,为苦荞FtERD基因功能研究提供依据.
1 材料与方法
1.1 材料与样品制备
登录拟南芥TAIR基因库网站(https://www.arabidopsis.org/about/datasources.jsp),下载AtERDs基因序列.利用苦荞基因组与转录组测序数据库,基于基因功能注释与AtERDs同源序列分析,筛选苦荞FtERDs基因.通过分析同源基因结构和蛋白结构进一步筛选鉴定苦荞糖转运FtERD基因.
试验选用苦荞品种晋荞麦2号为材料,在光照培养箱(20 ℃、25 ℃)中进行水培种植.出苗后10 d进行15% PEG模拟干旱处理,以不施PEG为对照,其余栽培管理措施保持一致.处理后8 h对PEG处理与对照中植株进行取样,迅速放于液氮中,然后置于-80 ℃超低温冰箱保存,供基因表达分析.
1.2 苦荞糖转运FtERDs基因序列分析
利用网站(https://www.ncbi.nlm.nih.gov/orffinder/)在线软件,进行苦荞糖转运FtERDs基因开放阅读框(open reading frame,ORF)及编码氨基酸序列查询.利用网站(http://smart.embl-heidelberg.de/)在线软件,进行ORF编码蛋白的跨膜结构域预测.利用网站(https://web.expasy.org/protparam/)在线软件,进行ORF编码蛋白相对分子质量、等电点、脂肪族氨基酸指数和疏水性预测.利用MEGA 5.0软件Cluster W进行多重序列分析,Neighbor-joining进行系统进化树构建,重复次数5 000次.
1.3 苦荞糖转运FtERDs基因的表达与相关性分析
基于苦荞出苗后5、10、15 d幼苗茎的转录组测序,筛选差异表达的糖转运FtERDs基因.利用MeV和SPSS 19.0软件进行基因的表达热图与相关性分析.参考RNA Easy Fast植物组织RNA快速提取试剂盒(DP452)和反转录试剂盒(KR116-02)的操作步骤进行总RNA提取和cDNA合成.利用表1中引物进行qRT-PCR基因定量表达检测.具体程序:95 ℃ 30 s,95 ℃ 5 s,55 ℃ 30 s,共40个循环.

表1 qRT-PCR基因表达的引物序列Table 1 Primer sequences for qRT-PCR of gene expression
2 结果与分析
2.1 苦荞糖转运FtERDs基因及其编码蛋白序列分析
基于苦荞基因组与转录组测序数据库,进行FtERDs基因的筛选,结果筛选出49个FtERDs基因,根据基因注释与拟南芥同源基因比对,鉴定出28个苦荞糖转运FtERDs基因(表2).苦荞糖转运FtERDs基因序长度为2 571~8 174 bp,其中,ORF编码蛋白FtERDs的氨基酸序列数为66~504个,分子质量为7 532.01~54 665.75 u,理论等电点为4.48~11.77,脂肪族氨基酸指数为36.67~143.46,疏水性为-1.425~1.292.蛋白结构预测发现19个糖转运FtERDs蛋白序列具有跨膜结构域,其中,FtPinG50564.01、FtPinG71941.01、FtPinG17078.01蛋白跨膜结构域达到6个,FtPinG00207.01、FtPinG50576.01、FtPinG50588.01、FtPinG63108.01、FtPinG85532.01蛋白跨膜结构域达到12个以上.
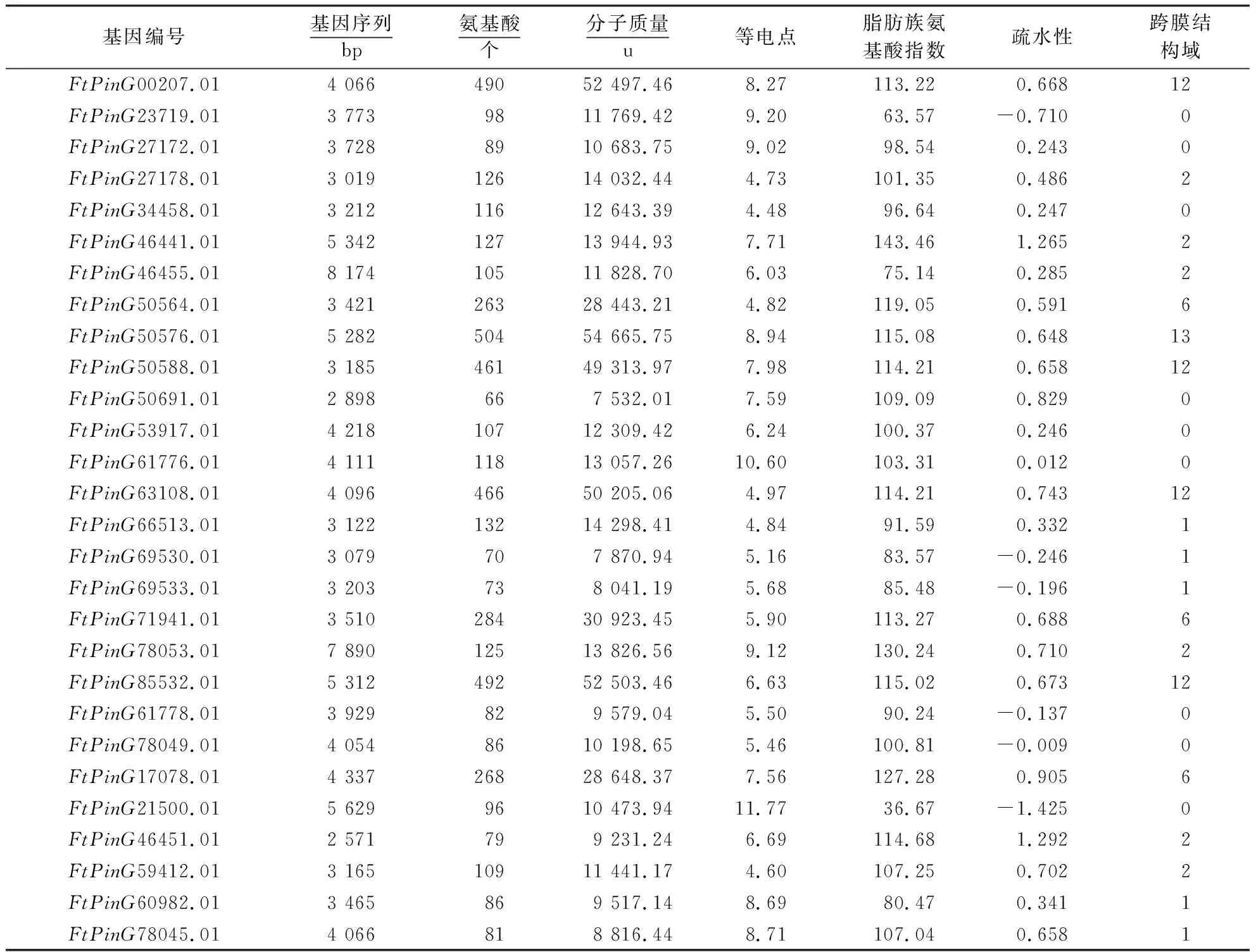
表2 苦荞糖转运FtERDs基因序列分析Table 2 Sequencing analysis of sugar transporter gene FtERDs in Tartary buckwheat
利用拟南芥AtERDs序列与FtERDs基因序列构建系统进化树.结果表明,28个苦荞FtERDs基因与拟南芥AtERDs基因可被聚为4类,类Ⅰ包括13个苦荞FtERDs基因,类Ⅱ包括9个苦荞FtERDs基因,类Ⅲ包括1个苦荞FtERD基因,类Ⅳ包括5个苦荞FtERDs基因.其中,FtPinG34458.01和FtPinG66513.01与拟南芥At5G18840聚为一类;FtPinG17078.01与拟南芥At3G54510聚为一类;FtPinG46455.01和FtPinG46451.01与拟南芥At1G54730聚为一类;FtPinG63108.01与拟南芥At4G35870聚为一类(图1).
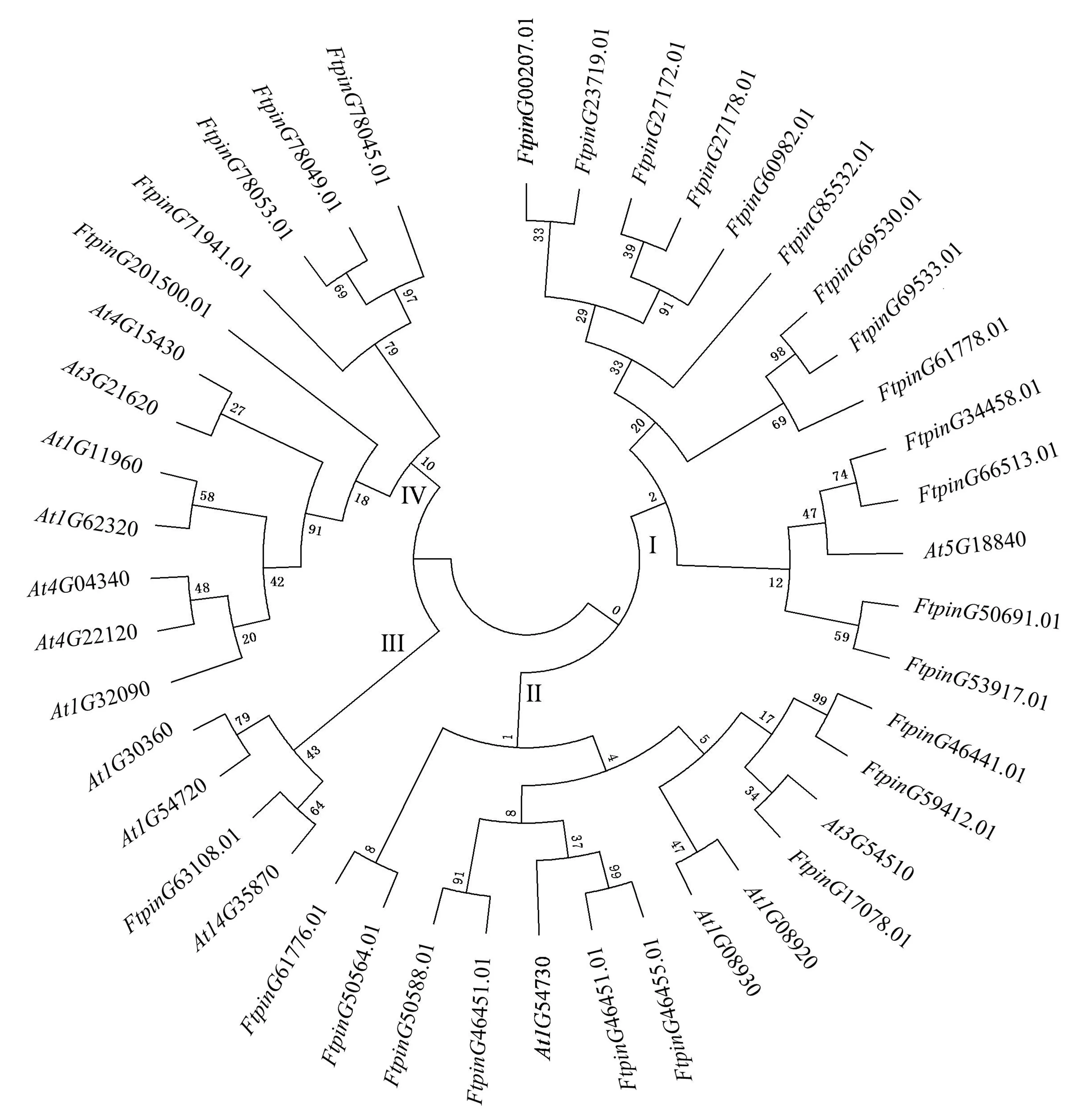
图1 苦荞FtERDs家族基因序列的聚类图Fig.1 Dendrogram of sequences of FtERD gene family in Tartary buckwheat
2.2 苦荞糖转运FtERDs基因的表达分析
基于出苗后5、10、15 d苦荞茎的转录组测序分析,共检测出22个FtERDs基因在苦荞幼苗茎中表达,包含17个差异表达基因(differentially expressed genes,DEGs),但其表达模式不尽一致(图2).其中,5个DEGs的表达量呈先升高后下降的趋势,6个DEGs的表达量呈先降低后升高的趋势,3个DEGs的表达量呈逐渐下降的趋势,3个DEGs的表达量呈逐渐上升趋势.对具有多个跨膜结构域的FtERDs蛋白的基因表达量进行分析,FtPinG00207.01、FtPinG71941.01、FtPinG50588.01、FtPinG63108.01均在苗期15 d高表达,FtPinG50564.01在苗期10和15 d高表达,而FtPinG85532.01在5 d高表达,而在15 d低表达,FtPinG17078.01和FtPinG50576.01则在3个时期均未检测到表达量.

图2 幼苗期苦荞FtERDs的表达热图Fig.2 Heatmap of expression levels of FtERDs in Tartary buckwheat in the seedling stage
2.3 苦荞糖转运FtERDs基因的相关性分析
对22个苦荞FtERDs基因的表达量进行相关性分析(图3),结果表明:FtPinG85532.01与FtPinG34458.01、FtPinG69530.01呈显著正相关,与FtPinG46441.01、FtPinG53917.01、FtPinG00207.01、FtPinG78053.01、FtPinG50564.01、FtPinG69533.01、FtPinG27172.01呈显著负相关;FtPinG34458.01与FtPinG69530.01呈显著正相关,与FtPinG46441.01、FtPinG71941.01、FtPinG50588.01、FtPinG61778.01、FtPinG53917.01、FtPinG63108.01、FtPinG78049.01、FtPinG00207.01、FtPinG78053.01、FtPinG50564.01呈显著负相关;FtPinG69530.01与FtPinG46441.01、FtPinG71941.01、FtPinG50588.01、FtPinG61778.01、FtPinG53917.01、FtPinG63108.01、FtPinG78049.01、FtPinG00207.01、FtPinG78053.01、FtPinG50564.01呈显著负相关;FtPinG23719.01与FtPinG66513.01、FtPinG27178.01呈显著正相关;FtPinG66513.01与FtPinG50691.01呈显著正相关,与FtPinG50588.01、FtPinG61778.01、FtPinG63108.01、FtPinG78049.01呈显著负相关;FtPinG46441.01与FtPinG71941.01、FtPinG50588.01、FtPinG53917.01、FtPinG63108.01、FtPinG78049.01、FtPinG00207.01、FtPinG78053.01呈显著正相关;FtPinG71941.01与FtPinG50588.01、FtPinG61778.01、FtPinG53917.01、FtPinG63108.01、FtPinG78049.01、FtPinG00207.01、FtPinG78053.01呈显著正相关;FtPinG50588.01与FtPinG61778.01、FtPinG53917.01、FtPinG63108.01、FtPinG78049.01、FtPinG00207.01、FtPinG78053.01呈显著正相关;FtPinG61778.01与FtPinG53917.01、FtPinG63108.01、FtPinG78049.01、FtPinG78053.01呈显著正相关;FtPinG53917.01与FtPinG63108.01、FtPinG78049.01、FtPinG00207.01、FtPinG78053.01呈显著正相关;FtPinG63108.01与FtPinG78049.01、FtPinG00207.01、FtPinG78053.01呈显著正相关;FtPinG78049.01与FtPinG00207.01、FtPinG78053.01呈显著正相关;FtPinG00207.01与FtPinG78053.01、FtPinG50564.01、FtPinG69533.01呈显著正相关;FtPinG50564.01与FtPinG50691.01呈显著正相关;FtPinG69533.01与FtPinG27172.01、FtPinG50691.01、FtPinG46455.01呈显著正相关;FtPinG27172.01与FtPinG50691.01、FtPinG46455.01呈显著正相关;FtPinG50691.01与FtPinG46455.01呈显著正相关;FtPinG27178.01与FtPinG27178.01呈显著正相关.
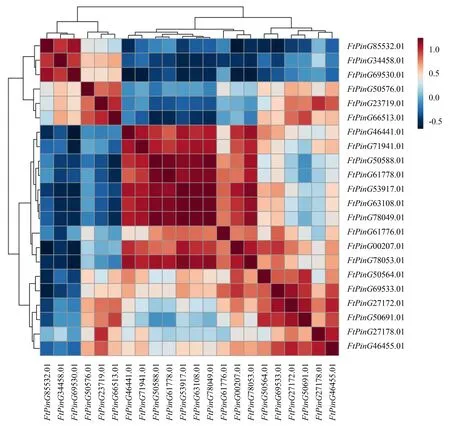
图3 苦荞FtERDs基因表达的相关性分析Fig.3 Correlation analysis of FtERDs expression in Tartary buckwheat
2.4 干旱胁迫下苦荞糖转运FtERDs基因的表达分析
苦荞苗期利用15% PEG进行模拟干旱处理,选择8个苦荞FtERDs基因进行qRT-PCR分析,结果表明,PEG处理8 h,5个FtERDs基因的表达量均上调,倍数3.10~11.31,这些基因可能在早期干旱胁迫响应中发挥重要作用.另外2个FtERDs与对照差异不显著,1个FtERD下调表达(图4).其中FtPinG34458.01、FtPinG85532.01、FtPinG00207.01、FtPinG50588.01表达量显著或极显著高于对照,FtPinG17078.01表达量显著低于对照.

*和**分别表示差异达到显著或极显著水平.图4 PEG胁迫下苦荞FtERDs基因表达的分析Fig.4 Analysis of FtERDs expression in Tartary buckwheat under PEG treatment
3 讨论
ERD受逆境胁迫快速诱导,参与调节逆境胁迫应答与耐受性[1-4].ERD6是家族中被鉴定的首个糖转运蛋白,通过介导糖的跨膜运输调控植物的逆境耐受能力[1].基于苦荞转录组数据库,在49个FtERDs基因中鉴定出28个糖转运FtERDs基因.通过氨基酸序列分析表明,19个苦荞FtERDs的ORF编码蛋白含有跨膜结构域,其中,3个FtERDs蛋白具有6个跨膜结构域,5个FtERDs蛋白具有12个以上的跨膜结构域,推测这些FtERDs编码蛋白均能参与跨膜运输.
ERD家族包括糖转运蛋白、泛素、热激蛋白、谷胱甘肽转移酶、ATP依赖型蛋白酶调节亚基等多种蛋白[1-5].利用拟南芥AtERDs与苦荞糖转运AtERDs序列进行系统进化树构建,结果表明,苦荞28个FtERDs与15个拟南芥AtERDs基因可归为4大类,不同类型中ERDs的亲缘关系较远,这可能与ERD家族基因来源的广泛性有关[2].
苦荞幼苗发育过程中共检测22个糖转运FtERDs基因的表达,其表达模式不尽相同,这些基因可能在幼苗不同发育时期发挥功能.例如,FtPinG85532.01、FtPinG34458.01、FtPinG69530.01在出苗后5 d高表达,随后逐渐下降,这些基因可能主要在种子出苗前期发挥功能;9个糖转运FtERDs基因,包括编码多跨膜结构功能域的FtPinG00207.01、FtPinG71941.01、FtPinG50588.01、FtPinG63108.01基因在苗期15 d高表达,3个糖转运FtERDs基因,包括FtPinG50564.01在苗期10和15 d高表达,这些基因可能在苗期的中后期发挥功能.另外,5个糖转运FtERDs基因在3个时期稳定表达,这些基因可能在幼苗发育过程中持续发挥作用.相关性分析表明,苦荞FtERDs基因间存在许多显著正相关与负相关关系,说明这些FtERDs基因间可能存在协同效应或功能互补效应.
Kiyosue et al[2]首次利用干旱胁迫鉴定出26个AtERDs基因,证实AtERDs在早期响应干旱胁迫中发挥重要作用.苦荞起源于中国的西南部,主要种植于高寒山区,具有较强的耐旱能力.本试验利用PEG模拟干旱胁迫,在8 h后发现5个FtERDs基因表达量上调明显,推测这些基因可能在响应早期干旱胁迫过程中发挥重要作用.其中,干旱胁迫下FtPinG34458.01、FtPinG85532.01表达量极显著高于对照组,达到10倍以上,猜测它们可能是苦荞早期响应干旱胁迫的关键基因.研究结果可为下一步深入探索FtERDs基因参与调控苦荞干旱逆境响应与抗旱机制提供依据.

