颈椎前路双节段椎间盘置换与椎间融合内固定的生物力学比较*
张玉坤 刘妍 李磊 任军
(新疆医科大学第六附属医院脊柱外科,乌鲁木齐 830002)
颈椎病的发生日趋严重,并呈现年轻化发病趋势,目前颈椎病已经成为临床诊疗中的常见病和多发病,给社会、家庭和患者造成巨大的危害[1]。经过将近60 年的发展和完善历程,颈椎前路减压融合术(anterior cervical discectomy and fusion,ACDF)已成为治疗颈椎退行性疾病最为有效的“金标准”[2]。但是经过对ACDF术后患者的长期随访,发现融合术后会发生植骨块塌陷、假关节形成、慢性疼痛、邻近节段退变等并发症,往往需要二次手术矫正[3]。颈椎人工椎间盘置换术(cervical disc replacement,CDR)不但可以保留手术节段的活动度,并且同时提供颈椎所需的稳定性,现已明确CDR 治疗单节段神经根型及脊髓型颈椎间盘病变效果较好,但对双节段及更多节段的颈椎病尚存在争议[4,5]。本研究在6 具新鲜尸体C1-T2 标本上对颈椎疾病好发节段C4-C6 分别进行双节段人工颈椎间盘Mobi-C 植入和ACDF 重建,并对各节段的活动度(range of motion,ROM)进行测量,比较两种术式对邻近节段活动度的影响,为临床手术选择提供生物力学依据。
1 资料与方法
1.1 试验材料
标本纳入标准:①年龄>18 岁;②X 线检查证实无明显脊柱外伤;③C1-T2正常状态各个方向的活动度均相同。排除标准:①患有脊柱肿瘤、结核等疾病的标本;②生前有脊柱侧凸、后凸等先天畸形;③双能X 线检查证实无颈椎内部结核、畸形、肿瘤及明显的骨质疏松。
6 具新鲜尸体男女各3 例,年龄20~60 岁,平均(42.1±6.3)岁。尸体均剔除脊柱旁肌肉组织,保留完整的椎间盘、韧带、关节囊等骨性组织,以双层保鲜膜和塑料袋密封,放置-20℃冰箱保存。
本研究经新疆医科大学第六附属医院医学伦理委员会批准。
1.2 研究方法
本研究采用自身对照的方法对6 具C1-T2 尸体标本的C4-C6 节段采取两种不同造模方式,测定造模后颈椎不同节段的ROM,并采用统计学方法进行比较。
1.2.1 模型构建
CDR模型:C4-C6节段椎间盘前方用尖刀“X”形切开完整组标本的纤维环后用去除髓核组织,将测宽器插入椎间隙,确定适当宽度后,将测宽器放置在椎体中央,放置中位针,使用X线确定后移去中位针,用Caspar针代替,连接牵引器,测量深度,进行X线下试模,直至试模轻松能固定于上下椎体的中心位置。试模后移去试模,用侧抓式植入器植入内置物Mobi-C,X线验证内植物位置后立即释放Caspar撑开力。经过X 线检查验证后,松开Caspar 撑开力,改为压缩力,使内植物固定齿压入椎体。压缩完成后,即可移去Caspar。
ACDF模型:以CDR模型相同的方法切除节段椎间盘及试模后,根据融合节段及融合长度不同选取合适的钛板与融合器,使用颈椎前路接骨板内固定专用手术器械进行定位、钻孔、测量深度、扎入螺钉,最后锁定接骨板。
1.2.2 分组
根据不同的模型构建方法分为对照组(未实施任何构建)、人工颈椎间盘组(对C4-C6 节段采取双节段人工颈椎间盘Mobi-C 置换,试验A 组)、颈椎前路减压融合术组(对C4-C6 节段采取颈椎前路减压融合,试验B组)。
1.2.3 试验仪器
采用国产百得脊柱弯曲主动驱动型专用夹具,测试设备为MTS810材料试验机(睿欧生物科技有限公司提供)及电阻应力应变仪、美国MTS 公司的Mo⁃bi-C人工颈椎间盘及酷套手术器械。
1.2.4 测量方法
建模前(对照组)在脊椎一端施加1.5 NM力矩加载力矩,测量正常状态各个方向的活动度,然后计算出C2-T1的ROM。在每段椎骨上安装定位支架和定位球,使用红外光学导航定位系统测量每段脊椎的位移。采用扭转试验机的扭转加载来测量左右旋转扭矩,并光学定位测量位移。测试完成后,改变运动控制模式为角位移加载,分别测量两种模型C2-T1的ROM 并计算各节段ROM 的分布情况。每次标本加载3次,计算平均值。
1.3 统计学方法
采用SPSS 24.0 进行统计学分析,采取GraphPad Prism 5 制图软件进行制图。正态性检验采取Kol⁃mogorov-Smirnov 检验,组间比较采用单因素方差分析,组内两两比较采用LSD-t检验,P<0.05为差异具有统计学意义。
2 结果
6例样本的各组数据的正态性检验结果显示,各组数据均为正态分布可以采用两组的t检验。
2.1 试验A组与对照组ROM比较
试验A组和对照组C4-C5的ROM在旋转时存在差异,A组显著增大(P<0.05),其他各节段ROM 均无显著性差异(P>0.05),见表1。
2.2 试验B组与对照组ROM比较
与对照组相比,试验B组手术融合节段(C4-C6)的ROM在三种运动情况下均显著减小(P<0.05,表1)。
2.3 试验A组与试验B组ROM比较
试验A组C4-C6节段ROM均显著大于试验B组(P<0.05),其他各节段ROM 均无显著性差异(P>0.05),见表1。
表1 三组在不同运动状态下颈椎关节活动度比较(,°)
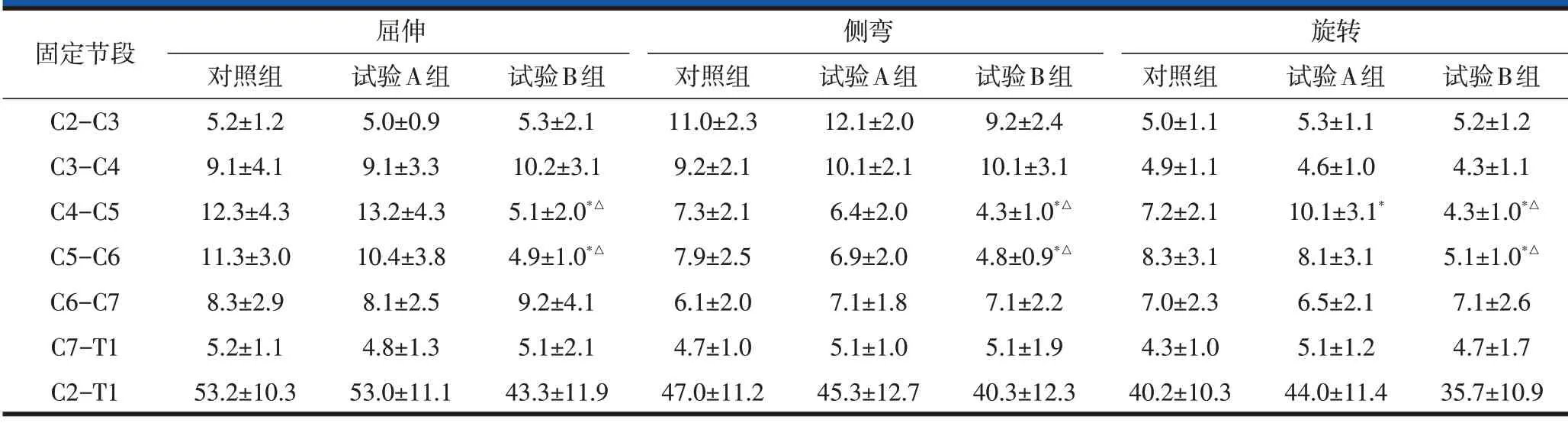
表1 三组在不同运动状态下颈椎关节活动度比较(,°)
注:与对照组相比,差异有统计学意义,*P<0.05;与试验A组相比,差异有统计学意义,△P<0.05
3 讨论
3.1 颈椎两种术式的优缺点
颈椎由椎体、椎弓、突起和椎间盘等基本结构组成的关节复合体。其中,椎间盘由外围质韧的纤维环和中央胶状软组织的髓核两部分组成,属于固相及液相复合材料物质,这样的生物力学特征使其具有压缩、拉力、张力和扭转力等特性[6]。椎间盘组织的解剖结构既可维持颈椎的正常生理活动,又限制其过度活动。因此,术中、术后维持病变和相邻节段颈椎的解剖结构的生物力学特征至关重要。ACDF作为治疗颈椎病的传统术式,能够解除病变节段椎间盘对神经、血管、脊髓的压迫,通过植骨融合内固定以维持颈椎稳定性和生理曲度,该术式使得术后患者的临床症状明显缓解。由于该术式采用刚性固定融合病变颈椎节段,其远期并发症引发国内外学者的争议[7-9]:病变节段的生物力学特性改变,相邻节段压力负荷及ROM 代偿性增加,长期应力集中导致邻近颈椎发生退行性变。近年来,随着医学技术水平的进步,为恢复病变节段椎间盘的解剖结构和生理功能,CDR 作为新的手术方法在临床得到应用。文献显示[10-12],采用融合或置换的手术方式需要考虑患者的个体因素、手术方法之间的技术差异、外科医生的倾向和经验等许多变量,ACDF与CDR术后短期效果无明显差异,但远期预后已成为研究的热点。
3.2 颈椎手术节段及邻近节段ROM分析
颈椎椎间隙ROM包括前屈后伸、左右侧弯、左右轴向旋转6 种运动形式。Bhashyam 等[13]比较患者术后30 天的三维运动分析发现,单节段CDR 置换组与ACDF 固定组手术节段与邻近节段活动度比较差异显著,人工颈椎间盘可减少相邻节段退变的发生率。目前,双节段甚至多节段CDR置换术对比ACDF手术相邻节段ROM变化差异尚无定论[14]。故本研究对颈椎疾病好发的C4-C6 双节段进行ACDF 与CDR造模,将正常颈椎和双节段ACDF、CDR 术后C1-T2椎体6 个椎间隙ROM 两两比较发现:通过与完整颈椎相比,ACDF 手术融合固定节段在轴向旋转和屈曲、伸展方面均受到限制。颈椎相邻节段术后运动变化复杂,Lin等[15,16]认为ACDF术后上下相邻节段运动均出现较大增幅,这是由于手术节段运动丢失严重。这与临床观点相符,主要是融合后椎体切除不再具备运动功能所致。本研究ACDF 组术后相邻节段ROM 未见差异,下一步将扩大样本量进一探讨双节段ACDF对相邻节段生物力学性质的影响。
本研究结果还显示,CDR 组与正常颈椎前屈后伸、左右侧弯工况基本一致,未见显著性差异(P>0.05);虽然假体置换限制了局部节段的轴向工况,但在一定程度可以降低相邻节段关节面间的剪切应力。ACDF和CDR两种术式相比,CDR术后邻近节段ROM 得以保留,但ACDF 显著减少,提示双节段CDR似乎都能在邻近功能性脊柱单位保持接近完整节段的运动。Katsuura 等[17]提出CDR 治疗方式所产生的旋转中心恢复到接近完整的状态,手术节段椎间ROM 与Zhang 等[18]报道的正常健康志愿者相似。这些基于旋转中心和运动反应的相邻节段运动的改变很可能是椎间盘旋转扩散中心的原因,可能是相邻节段退变的潜在原因[19,20]。
3.3 本研究不足
本研究对体外试验研究双节段(C4-C6)CDR 及ACDF术后C1-T2颈椎各个节段的生物力学变化,结果表明CDR 术后各节段基本保留前屈后伸、左右侧弯、左右轴向旋转工况,一定程度上保留了手术节段和相邻节段的生物力学特征。但这项研究有一些不足之处,例如样本量相对较小,体外标本测量指标与临床数据有差异。下一步将扩大研究样本,探讨两种手式在双节段甚至多节段的临床效果和对相邻节段的生物力学影响,为临床不同节段的手术方式选择标准提供一定的理论依据。

