川芎素对大鼠肾脏缺血再灌注损伤的作用及其机制
蒋欣 曲青山 梁韶峰 房军 孙东
[摘要] 目的 探讨川芎素对大鼠肾脏缺血再灌注损伤(I/R)保護作用及其机制。
方法 雄性SD大鼠随机分为假手术组、I/R组、川芎素组(10 μmol/kg腹腔注射,LC组)、LC+Notch1通路激活剂rhNF-κB组(LC+rhNF-κB组),每组15只。观察各组血尿素氮(BUN)和血清肌酐(Scr)水平,采用实时定量PCR(qRT-PCR)和蛋白免疫印迹(Western blot)方法检测肾组织肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)的mRNA和蛋白表达水平,免疫组化和Western blot检测肾组织Caspase3、Bax/Bcl-2、Notch1、Jagged1的表达水平。
结果 I/R组肾组织结构严重破坏,BUN、Scr、TNF-α、IL-6、Caspase3、Bax/Bcl-2、Notch1、Jagged1的表达均显著高于假手术组(P均<0.05),而LC组中上述蛋白的表达均显著低于I/R组(P均<0.05)。另外,LC+rhNF-κB组中BUN、Scr、TNF-α、IL-6、Caspase3、Bax/Bcl-2的表达与LC组相比均显著上调(P均<0.05)。
结论 川芎素通过抑制Notch1活化抑制肾组织的损伤和炎症反应。
[关键词] 再灌注损伤;急性肾损伤;川芎嗪;受体,Notch1;炎症;大鼠,Sprague-Dawley
[中图分类号] R619.9
[文献标志码] A
[文章编号] 2096-5532(2021)05-0725-06
doi:10.11712/jms.2096-5532.2021.57.172
[开放科学(资源服务)标识码(OSID)]
[网络出版] https://kns.cnki.net/kcms/detail/37.1517.R.20211101.0853.001.html;2021-11-01 11:51:01
ROLE OF SODIUM FERULATE IN ISCHEMIA-REPERFUSION INJURY IN RATS AND ITS MECHANISM
JIANG Xin, QU Qingshan, LIANG Shaofeng, FANG Jun, SUN Dong
(Department of Organ Transplantation, Zhengzhou Peoples Hospital, Zhengzhou 450000, China)
[ABSTRACT] Objective To investigate the protective effect of sodium ferulate against renal ischemia-reperfusion (I/R) injury in rats and its mechanism.
Methods Male Sprague-Dawley rats were randomly divided into sham-operation group, I/R group, sodium ferulate group (10 μmol/kg by intraperitoneal injection), and sodium ferulate+Notch1 pathway activator rhNF-κB group (sodium ferulate+rhNF-κB group), with 15 rats in each group. The levels of blood urea nitrogen (BUN) and serum creatinine (Scr) were observed for each group; quantitative real-time PCR and Western blot were used to measure the mRNA and protein expression levels of tumor necrosis factor-α (TNF-α) and interleukin-6 (IL-6) in renal tissue; immunohistochemistry and Western blot were used to measure the expression levels of Caspase3, Bax/Bcl-2, Notch1, and Jagged1 in renal tissue.
Results
Compared with the sham-operation group, the I/R group had severe structural damage of renal tissue and significantly higher expression levels of BUN, Scr, TNF-α, IL-6, Caspase3, Bax/Bcl-2, Notch1, and Jagged1 (all P<0.05), and the sodium ferulate group had significantly lower expression levels of the above proteins than the I/R group (all P<0.05). In addition, compared with the sodium ferulate group, the sodium ferulate+rhNF-κB group had significantly upregulated expression levels of BUN, Scr, TNF-α, IL-6, Caspase3, and Bax/Bcl-2 (all P<0.05).
Conclusion Sodium ferulate inhibits renal tissue injury and inflammation by inhibiting the activation of Notch1.
[KEY WORDS] reperfusion injury; acute kidney injury; Tetramethylpyrazine; receptor, Notch1; inflammation; rats, Sprague-Dawley
肾脏缺血再灌注损伤(I/R)是引起急性肾损伤(AKI)的主要病因[1]。AKI和肾I/R均导致肾功能迅速下降[2-3],但目前缺乏预防或治疗AKI的有效策略[3]。肾I/R发展过程涉及活性氧(ROS)的产生、促炎症反应和细胞死亡等[4-7],且导致肾小管上皮细胞的损伤[8-9]。细胞凋亡是肾脏I/R中肾小管上皮细胞死亡的主要类型[10]。长期以来川芎一直被应用于心血管疾病的治疗,如卒中[11]和冠心病[12],特別是在我国、日本和韩国应用广泛[13]。已有研究结果表明,川芎素(LC)可以保护急性缺血性肾损伤[14],而鲜见其对缺血后再灌注肾损伤保护作用的研究。因此,本研究的目的是探讨LC对大鼠肾I/R的保护作用,并探讨Notch通路对大鼠肾脏I/R中介导的炎症反应和细胞凋亡的作用及其可能机制,为LC作为治疗肾脏I/R的新策略提供数据支持。现将结果报告如下。
1 材料和方法
1.1 实验材料
1.1.1 实验动物 选择健康雄性、SPF级Sprague-Dawley(SD)大鼠60只,体质量211~248 g,购于我院实验动物中心,饲养于SPF级动物实验室,动物自由饮食、饮水。本研究严格遵守《实验动物护理和使用指南》的执行原则。
1.1.2 主要试剂及药物 LC购于中国河北安国神农中草药公司;兔抗大鼠的肿瘤坏死因子α(TNF-α)(ab6671)、白细胞介素-6(IL-6)(ab208113)、半胱天冬酶3(Caspase3)(ab13847)、B细胞淋巴瘤/白血病相关X的蛋白(BAX)(ab32503)、B细胞淋巴瘤/白血病-2(Bcl-2)(ab196495)、缺口蛋白1(Notch1)(ab52301)、锯齿状蛋白1(Jagged1)(ab233101)的第一抗体、辣根过氧化物酶(HRP)标记山羊抗兔第二抗体(ab6721)、甘油醛-3-磷酸脱氢酶(GAPDH,ab9485)等均购于美国Abcam公司;SYBR Green qPCR Master Mix试剂购于MedChemExpress公司;组织蛋白抽提试剂购自上海碧云天生物科技有限公司。血清肌酐(Scr)和尿素氮(BUN)试剂盒购于美国R&D Systems公司。
1.2 实验方法
1.2.1 实验分组 取雄性SD大鼠60只,适应性喂养1周后,随机分为假手术组(a组)、I/R组(b组)、LC组(c组)和LC+Notch1通路激活剂rhNF-κB组(LC+rhNF-κB组,d组),每组15只。
1.2.2 模型建立及标本采集 大鼠术前禁食8 h,不禁水,100 g/L水合氯醛(3.5 mL/kg)腹腔注射麻醉。常规固定、消毒、铺巾,腹正中切口,游离肾蒂,I/R组以无创小血管夹同时夹闭双侧肾蒂50 min,之后松开血管夹,让血流再通。假手术组、LC组、LC+rhNF-κB组大鼠手术方式与I/R组相同,但假手术组不用血管夹阻断血流,而LC组、LC+rhNF-κB组在松开血管夹时予LC(10 μmol/kg)腹腔注射,I/R组与假手术组则以等量生理盐水注射液腹腔注射。各组分别于再灌注6、12、24、48 h共4个时点取血标本(腹主动脉穿刺),在48 h取肾脏组织标本。右肾用冰生理盐水冲洗后置液氮保存,行实时定量PCR(qRT-PCR)和蛋白免疫印迹(Western blot)检测;左肾用40 g/L甲醛固定缓冲液固定,待制备石蜡切片。
1.2.3 酶联免疫吸附(ELISA)检测 将血清保存在-80 ℃冰箱,通过ELISA试剂盒检测血清肌酐(Scr)和血尿素氮(BUN)水平。
1.2.4 苏木精-伊红(HE)和免疫组织化学染色 按照HE染色试剂盒说明将5 μm肾组织石蜡切片进行HE染色。使用常规免疫组织化学法(IHC)检测Notch1在肾脏组织表达,Notch1抗体的稀释度为1∶100。使用GTVsionTM Ⅲ检测系统(GK5007,Gene Tech,中国)记录所有IHC图像。
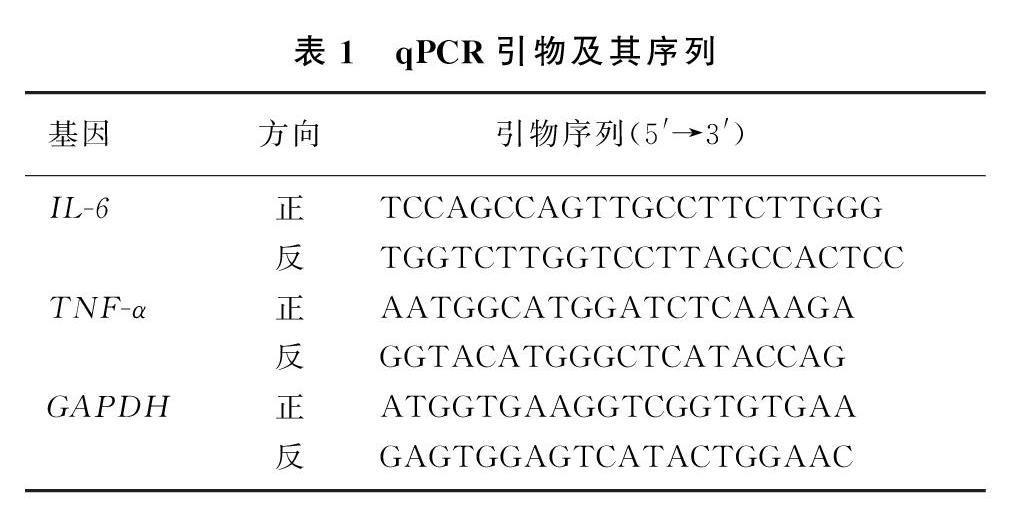
1.2.5 qRT-PCR检测 按照TianGen试剂盒说明书步骤提取大鼠肾组织总RNA,并按照TAKARA(RR047A)试剂盒说明进行反转录。参照SYBR Green Master Mix PCR试剂盒说明进行qPCR扩增,所用引物及其序列见表1。以人GAPDH基因作为内参照,采用2-ΔΔCT法计算IL-6和TNF-α的mRNA相对表达量。
1.2.6 Western blot检测 按照RIPA裂解缓冲液试剂盒说明书提取肾脏组织的总蛋白,并使用BCA试剂盒检测浓度。蛋白经过SDS-PAGE电泳和转膜操作后,分别孵育TNF-α(1∶600)、IL-6(1∶600)、Caspase3(1∶500)、Bax(1∶800)、Bcl-2(1∶400)、Notch1(1∶500)和Jagged1(1∶500)抗体和对应的二抗。蛋白条带显色后,用Image J软件分析比较目的条带/内参照(GAPDH)条带灰度值。
1.3 统计学处理
应用SPSS 20.0统计软件对数据进行处理分析。其中计量资料数据采用±s的形式表示,两组均数的比较采用两独立样本比较的t检验;多组间的均数比较采用单因素方差分析,均数两两之间的比较采用Bonferroni法。以P<0.05为差异有统计学意义。
2 结 果
2.1 I/R模型大鼠肾脏结构和功能变化
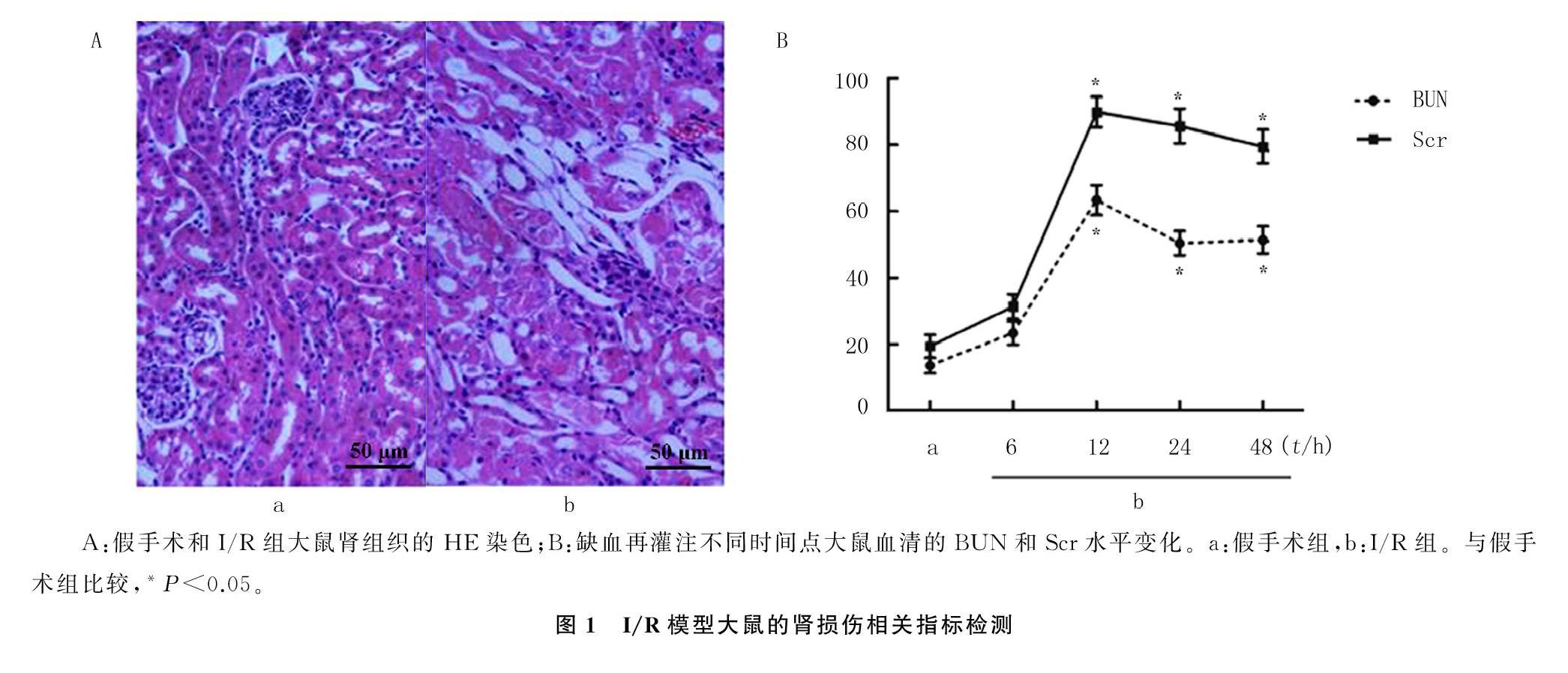
HE染色结果显示,假手术组大鼠肾脏结构无明显形态学改变;而与假手术组相比,I/R组的肾组织结构出现严重破坏,包括肾小管扩张、肾上皮细胞扁平、刷状缘丧失和核染色丧失等(图1A)。另外,I/R组大鼠血BUN和Scr水平在12、24和48 h等3个时间点均明显高于假手术组,差异均有显著性(t=10.532~17.693,P均<0.05)。见图1B。
2.2 LC对I/R大鼠肾组织结构和Notch1信号通路的影响
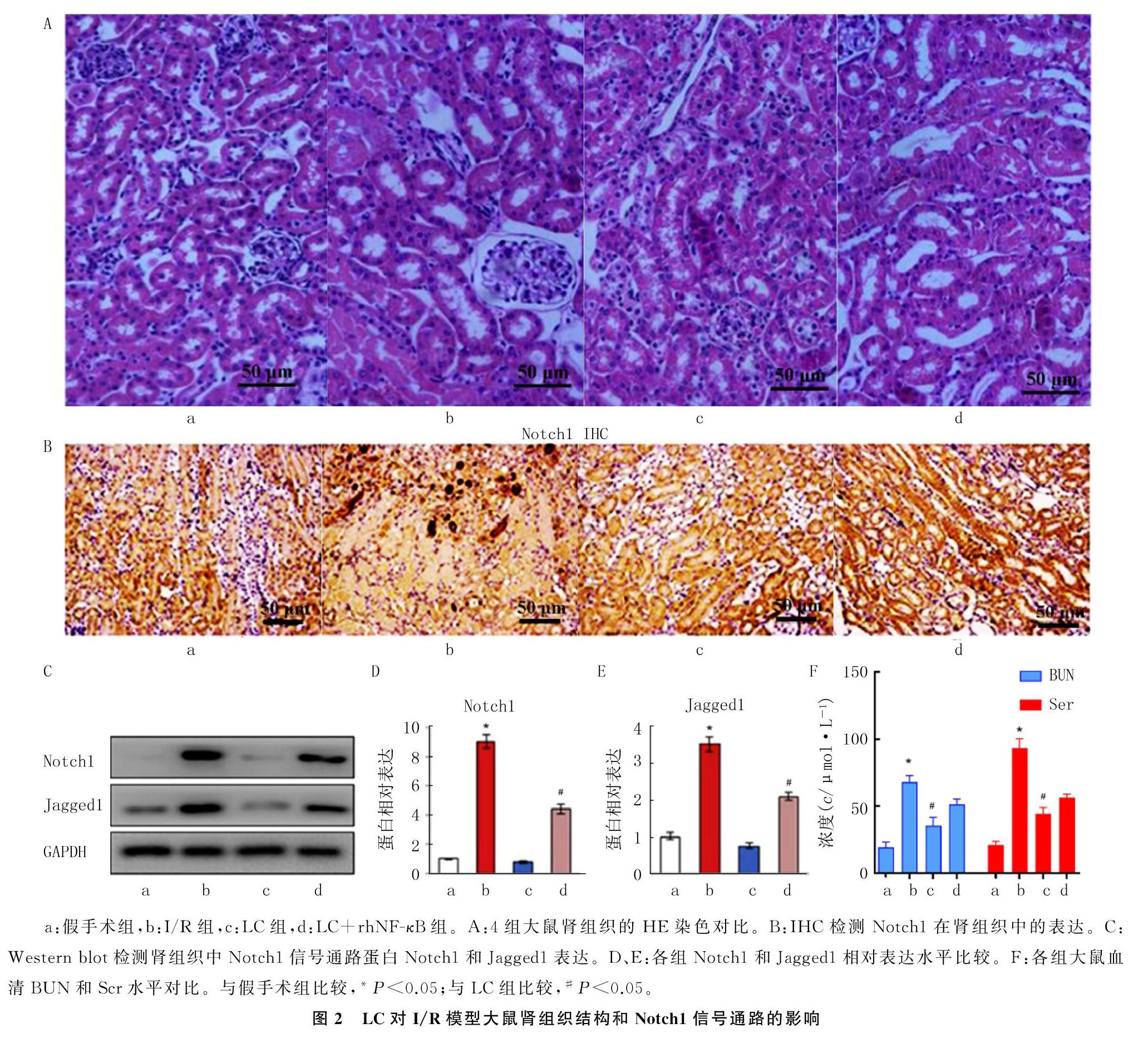
HE染色结果显示,与I/R组相比,LC组破坏的肾组织的结构有明显恢复;与I/R+LC组相比,I/R+LC+rhNF-κB组的肾组织结构破坏又加重。见图2A。肾组织中的Notch1和Jagged1表达检测结果显示,4组Notch1和Jagged1的均数差异有统计学意义(F=256.311、189.106,P均<0.05)。两两比较的结果显示,与假手术组相比较,I/R组中Notch1和Jagged1在肾组织中表达上调(P均<0.05);与I/R组相比, LC组Notch1和Jagged1的表达下调(P均<0.05);使用Notch1信号激活剂rhNF-κB处理后与LC组相比,LC+rhNF-κB组的Notch1和Jagged1的表达明显恢复(P均<0.05),见图2B~E。另外,4组的BUN、Scr均数差异有统计学意义(F=182.060、183.772,P均<0.05)。两两比较结果显示,与I/R组相比,在LC组中BUN、Scr水平降低(P均<0.05);但是与LC组相比较,LC+rhNF-κB组的BUN、Scr水平又增加,但并未超过I/R组,差异均有统计学意义(P均<0.05)。见图2F。
2.3 LC对I/R大鼠肾脏炎症相关指标表达的影响
本文4组肾脏组织IL-6和TNF-α的mRNA表达差别有显著意义(F=203.012、214.310,P均<0.05)。两两比较结果显示,与假手术组相比,I/R组肾脏组织IL-6和TNF-α的mRNA表达升高(P均<0.05);而与I/R组相比,LC组肾脏组织IL-6和TNF-α的mRNA表达水平降低(P均<0.05);但是LC+rhNF-κB组IL-6和TNF-α的mRNA表达部分恢复(P均<0.05)。见图3A、B。4组大鼠肾脏组织IL-6和TNF-α的蛋白表达水平差异有显著意义(F=113.412、128.204,P均<0.05)。两两比较结果显示,与假手术组相比,I/R组肾脏组织IL-6和TNF-α的蛋白表达水平升高(P均<0.05);而与I/R组相比,LC组肾脏组织IL-6和TNF-α的蛋白表达水平降低(P均<0.05);但是LC+rhNF-κB组IL-6和TNF-α的蛋白表达水平部分恢复(P均<0.05)。见图3C~F。
2.4 LC对I/R大鼠肾脏细胞凋亡相关标志物表达的影响
本文4组Caspase3和Bax/Bcl-2表达差别有统计学意义(F=156.205、143.337,P均<0.05)。两两比较结果显示,Caspase3和Bax/Bcl-2在I/R组的表达均高于假手术组(P均<0.05),而二者在LC组的表达均低于I/R组(P均<0.05),二者在LC+rhNF-κB组大鼠肾组织表达均高于LC组(P均<0.05)。见图4A~C。
3 讨 论
AKI是一种潜在的致命疾病,病人死亡率高。肾脏I/R是AKI的主要原因[15]。有研究显示,当肾动脉灌注压力处于10.64~23.94 kPa范围时,肾血流将随着灌注压力的变化相应地变化。但是,当灌注压力低于10.64 kPa时,肾血流量急剧降低,形成缺血并造成不可逆性损伤[16]。不幸的是,唯一合适的治疗方法是肾移植和肾透析。因此,迫切需要找到一种有效的药物来预防或者治疗I/R。LC可能对AKI具有保护作用,但是否能够改善肾I/R仍不明确。因此,我们分析了在体内LC对肾I/R大鼠的影响。结果表明,LC可通过抑制Notch1活化,抑制I/R大鼠的肾组织损伤和炎症反应,从而发挥肾脏保护作用。
炎症反应增强是肾I/R的另一个明显的特征,I/R可以引发肾脏炎性细胞增多、促炎性因子(如TNF-α、IL-1β、IL-6等)的水平升高以及黏附分子增加,这些因子共同作用激发炎症的级联反应,放大局部炎症反应,甚至引起器官损伤[17]。本研究检测肾I/R后肾组织中IL-6和TNF-α的mRNA和蛋白表达水平,结果表明,无论在血清中还是在肾脏组织中炎症因子的表达水平都伴随着I/R过程增加。已有相关研究同样观察到,大鼠肾I/R后炎症因子表达增加[18]。
Notch1信号通路存在于多种动物体内,影响机体的发育和细胞分化、增殖、凋亡等,并参与多种疾病的发生和发展[19-20],与肾脏炎症级联反应增加具有密切关系[21]。本文的研究结果也表明,LC能够改善I/R肾功能和肾组织的形态变化,而这些保护作用可能通过调节Notch1信号通路活化实现的。首先,Notch1信号通路蛋白Notch1和Jagged1的表达水平在I/R组中表达显著上调,而已有研究表明Notch1信号激活能够加剧I/R的损伤[22]。本研究结果则显示,LC腹腔注射能够明显抑制I/R导致的Notch1和Jagged1的上调,当使用Notch1信号通路激活剂rhNF-κB时,LC的作用明显被削弱。其次,I/R肾组织中IL-6和TNF-α的mRNA和蛋白表达同样被LC所抑制,LC的作用也可被rhNF-κB部分逆转。表明LC也可能通过抑制Notch1信號减弱I/R的炎性损伤。
由于雄性激素更容易使肾脏受到I/R侵害,因此本研究采用雄性大鼠作为实验对象[23]。而本实验对肾I/R大鼠的研究表明,I/R增加了Scr和BUN的水平,加重了肾组织学损伤。另外,I/R增加了肾组织Caspase3和Bax/Bcl-2的表达,通过HE染色也观察到细胞体积缩小、细胞核固缩、碎裂等凋亡特征,这表明I/R能够诱导更多肾组织细胞凋亡。LIU等[24]观察到I/R对大鼠肾脏的损伤特征与本研究结果一致。值得注意的是,LC注射后I/R组的肾脏组织形态具有明显的改善,与此同时I/R组大鼠中血BUN和Scr的高水平及肾组织中的凋亡标记物Caspase3和Bax/Bcl-2都被LC所抑制。已有研究结果表明,LC对系膜细胞、神经元细胞中的Caspase3和Bax/Bcl-2水平具有同样的调节作用[25-26]。而且Notch1信号被敲低后可以抑制足细胞的Bcl-2依赖性凋亡[27]。而本研究反向验证中使用rhNF-κB激活Notch1信号通路后,LC对肾组织Caspase3和Bax/Bcl-2的抑制作用被减弱。以上研究结果表明,LC通过抑制Notch1信号可能减弱I/R肾组织的Caspase3和Bax/Bcl-2依赖的细胞凋亡。
综上所述,LC可通过抑制Notch1信号保护I/R肾脏损伤。LC治疗后,肾组织中促炎性细胞因子(TNF-α和IL-6)和促凋亡蛋白(Caspase3和Bax/Bcl-2)的表达下调。rhNF-κB激活Notch1信号后,该保护作用减弱。但本研究仍存在大鼠样本量较少、动物模型较单一等缺点。因此,今后仍需加大动物样本量,或者以不同方法,或者以多种模式动物构建I/R模型进一步验证LC对肾脏I/R的保护作用。本研究可为肾脏I/R的保护提供新的治疗策略和研究靶点。但是LC的保护作用和机制仍需进一步在体外和体内进行研究。
[参考文献]
[1]ONO S, MATSUI H, NODA M, et al. Functional regulation of von Willebrand factor ameliorates acute ischemia-reperfusion kidney injury in mice[J]. Scientific Reports, 2019,9(1):14453.
[2]邵俊,方时书,郑瑞强,等. 内毒素休克诱导急性肾损伤家兔模型的建立[J]. 实用临床医药杂志, 2018,22(15):18-22.
[3]魏开勇,王忠庆,黄维义. 阿托伐他汀预诱导HO-1表达对泛影葡胺致大鼠急性肾损伤模型保护性作用研究[J]. 河北医学, 2018,24(1):1-5.
[4]蔡名敏,姚澜,张经纬,等. 基于线粒体损伤机制的药物性急性肾损伤研究进展[J]. 中国临床药理学与治疗学, 2018,23(5):578-585.
[5]王亚苹,张振坤,李喆,等. 重组人MG53蛋白激活Akt/GSK-3β通路降低LPS诱导的hUC-MSCs氧化损伤[J]. 郑州大学学报(医学版), 2019,54(4):522-526.
[6]曾娟,邓丁玲,肖继,等. 氢吗啡酮对肾缺血再灌注损伤大鼠细胞凋亡的影响及其机制[J]. 中国临床药理学杂志, 2019,35(16):1756-1758.
[7]佘瑶,杨陈,吴洪銮,等. 肾小管上皮细胞坏死新机制研究进展: necroptosis与急性肾损伤[J]. 中国免疫学杂志, 2018,34(9):1418-1422.
[8]高文强,邱雪峰,李凯,等. 丹参酮Ⅰ在肾脏缺血再灌注损伤中的保护作用研究[J]. 东南大学学报(医学版), 2018,37(3):372-379.
[9]沈剑箫,王玲,姜娜,等. 对比剂激活NLRP3炎症体通路诱导肾小管上皮细胞凋亡[J]. 中华肾脏病杂志, 2018(1):36-43.
[10]全柳叶,王小兵,李明权. 肾衰康灌肠液在急性肾缺血再灌注损伤中的作用及对p38-MAPK信号通路的影响[J]. 亚太传统医药, 2018,14(8):7-9.
[11]GU J F, SU S L, GUO J M, et al. Anti-inflammatory and anti-apoptotic effects of the combination of Ligusticum chuanxiong and Radix Paeoniae against focal cerebral ischaemia via TLR4/MyD88/MAPK/NF-κB signalling pathway in MCAO rats[J]. The Journal of Pharmacy and Pharmacology, 2018,70(2):268-277.
[12]TAI J, ZOU J B, ZHANG X F, et al. Using network pharmacology to explore potential treatment mechanism for coronary heart disease using Chuanxiong and Jiangxiang essential oils in jingzhi Guanxin prescriptions[J]. Evidence-Based Complementary and Alternative Medicine: ECAM, 2019, 2019(1):7631365.
[13]LIN Y L, WANG G J, HUANG C L, et al. Ligusticum Chuanxiong as a potential neuroprotectant for preventing serum deprivation-induced apoptosis in rat pheochromocytoma cells: functional roles of mitogen-activated protein kinases[J]. Journal of Ethnopharmacology, 2009,122(3):417-423.
[14]楊敬华,谢晋良,熊凤姣. 川芎素对急性缺血性肾损伤的保护作用[J]. 中国医师杂志, 2003(7):985-987.
[15]FLOEGE J, MAK R H, MOLITORIS B A, et al. Nephrology research: the past, present and future[J]. Nature Reviews Nephrology, 2015,11(11):677-687.
[16]胡成欢,张丽娜. 肾脏灌注压多少合适[J]? 临床荟萃, 2019,34(7):590-594.
[17]武康,蔡明. NLRP3炎症小体在肾缺血再灌注损伤中的作用[J]. 解放军医学杂志, 2017,42(12):1102-1105.
[18]李毅,张雪霞,周文英,等. 缺血后处理对梗阻性黄疸大鼠肾缺血再灌注损伤IL-6及ATP的影响[J]. 实用医学杂志, 2016,32(15):2442-2444.
[19]桑露倩,李娜,王映,等. 全反式维甲酸对食管癌KYSE70细胞增殖、迁移及Notch1、DLL4、VEGF-C表达的影响[J]. 郑州大学学报(医学版), 2018,53(4):405-409.
[20]程少燕,李峰,平玉,等. 抑制notch1信号通路对CD8+T细胞免疫检查点、功能及增殖的影响[J]. 郑州大学学报(医学版), 2019,54(3):323-326.
[21]徐晓嫦,朱晔,张慧涛,等. Notch通路在大鼠肾脏缺血再灌注损伤TLR4介导的炎症反应中的作用[J]. 中国病理生理杂志, 2016,32(3):485-491.
[22]MONSALVE E, RUIZ-GARC A A, BALADRN V, et al. Notch1 upregulates LPS-induced macrophage activation by increasing NF-k
appaB activity[J]. European Journal of Immu-
nology, 2009,39(9):2556-2570.
[23]PARK K M, KIM J I, AHN Y, et al. Testosterone is responsible for enhanced susceptibility of males to ischemic renal injury[J]. The Journal of Biological Chemistry, 2004,279(50):52282-52292.
[24]LIU S S, CHEN Y Y, WANG S X, et al. Protective effect of dabrafenib on renal ischemia-reperfusion injury in vivo and in vitro[J]. Biochemical and Biophysical Research Communications, 2020,522(2):395-401.
[25]ZHAO T F, FU Y X, SUN H, et al. Ligustrazine suppresses neuron apoptosis via the Bax/Bcl-2 and caspase-3 pathway in PC12 cells and in rats with vascular dementia[J]. IUBMB Life, 2018,70(1):60-70.
[26]XUE Y, TIE C R, LI J, et al. Ligustrazine inhibits lipopolysaccharide-induced proliferation by affecting P27, Bcl-2 expression in rat mesangial cells[J]. European Journal of Pharmacology, 2011,665(1/3):8-12.
[27]GAO F, YAO M, SHI Y H, et al. Notch pathway is involved in high glucose-induced apoptosis in podocytes via Bcl-2 and p53 pathways[J]. Journal of Cellular Biochemistry, 2013,114(5):1029-1038.
(本文編辑 于国艺)

