碱金属改性对ZSM-5结构和吸附甲苯特性的影响及机理
崔永康,邢 奕,苏 伟✉,王嘉庆
1) 北京科技大学能源与环境工程学院, 北京 100083 2) 工业典型污染物资源化处理北京市重点实验室, 北京 100083
近年来,随着工业的快速发展,挥发性有机化合物 (Volatile organic compounds, VOCs)排放量以每年近9%的速度增长[1]. 包括醇类、醛类、芳香族化合物和多环芳烃在内的VOCs排放主要来自工业废气的迁移转化、溶剂挥发、生物质燃烧和汽车尾气[2]. VOCs不但对人类具有严重的致癌性,即使在极低浓度下也会对环境造成严重破坏,如有助于光化学烟雾的形成、平流层臭氧的减少和超细颗粒的成核[3]. 因此,在复杂的工业环境采用适当的技术和方法去除有机气体具有重要意义.
吸附法因其再生和使用方便等优点被认为是去除低浓度VOCs最具成本效益的处理技术之一[4−6]. 在吸附过程中,吸附剂的结构特性,如孔体积、比表面积和孔径,会影响吸附量和扩散阻力.同时,吸附剂表面引入的阳离子和官能团也会通过静电相互作用影响吸附亲和力和吸附量.Yang等[7]研究了孔径对活性炭吸附甲苯的影响,发现吸附容量和扩散阻力主要由孔结构和进气浓度决定. Kustov等[8]比较了拓扑结构和阳离子对甲苯吸附的差异,发现芳香环的π键与活性中心的相互作用对吸附性能的影响更为关键. Lillo-Ródenas等[9]研究了苯和甲苯在炭材料上的吸附性能,结果表明,吸附量主要受孔结构的影响,尤其是微孔尺寸(<2 nm),扩散速率随孔径的减小而减小. Koriabkina等[10]报道了酸性中心对直链和支链己烷在ZSM-5上扩散的影响,提出吸附质与活性中心的相互作用可显著提高扩散阻力.
上述文献表明,吸附去除有机气体的机理十分复杂,且大多数研究只关注单一的静电相互作用或与电荷密度和孔径有关的空间效应对吸附扩散过程的影响. 因此,有必要选择合适的多孔材料对VOCs的吸附进行系统的探索. 与具有不规则微孔结构、吸附过程易自燃、脱附过程再生困难特征的活性炭相比,沸石孔结构规则、粒径分布可控、电荷量可调、且硅铝结构可耐受300~400 ℃高温. 具有MFI结构的ZSM-5分子筛其十元环孔道孔径为0.55~0.6 nm,与甲苯分子的动力学直径0.58 nm相接近,受微孔填充机制的影响,ZSM-5分子筛孔道内壁对甲苯分子产生较强的吸附作用力进而提升吸附容量. 另外,ZSM-5分子筛成本较低,在有机气体实际应用脱除中有一定的前景,但目前缺少其对有机气体吸附、放热、扩散和脱附的综合探讨. 用 Li+、Na+和 K+对 ZSM-5 分子筛进行改性,得到不同的孔径分布和电荷密度的吸附剂. 采用实验方法结合表征技术和相应的理论模型详细讨论了空间位阻和吸附强度对甲苯吸附扩散的影响.
1 实验与方法
1.1 材料和化学试剂
实验中使用LiCl、NaCl和KCl改性的Na−ZSM-5作为吸附剂对甲苯进行吸附实验. 其中,LiCl、NaCl和KCl药品购自国药集团化学试剂北京有限公司,ZSM-5(Si/Al(摩尔比)=25)吸附剂购自天津元力化工有限公司,甲苯标气(体积分数1.09×10−4)购自北京华元气体有限公司.
在本实验中,使用LiCl、NaCl和KCl溶液对ZSM-5进行离子交换,将得到的吸附剂材料分别记为 Li−ZSM-5、Na−ZSM-5 和 K−ZSM-5. 具体的离子交换步骤如下:将5 g质量的ZSM-5原粉溶解在体积 250 mL 浓度 2 mol·L−1的碱金属交换溶液,使用磁力搅拌器在 200 r·min−1条件下将该溶液充分混合并加热到70 ℃,24 h后将此混合溶液过滤取滤纸上方滤饼将其重新溶解到新的碱金属交换溶液. 每天重复上述步骤,5 d后用蒸馏水冲洗最后的样品去除残留在表面的过多的阳离子,随后120 ℃ 干燥和 500 ℃ 煅烧 4 h.
1.2 实验与装置
甲苯的吸附去除实验装置如图1所示,主要由载气装置、甲苯气源装置、吸附柱和VOCs检测仪四部分构成. 空气被压缩机排放到缓冲罐中,储存在缓冲罐的空气经过干燥装置和高效空气过滤器(High efficiency particulate air filter, Hepa)处理后得到干净的空气作为载气,由质量流量计(Mass flow controller, MFC) 1 控制其流量,甲苯标气流量由MFC2控制. 通过控制载气和甲苯流量调节甲苯进气浓度并保持进气流量不变.
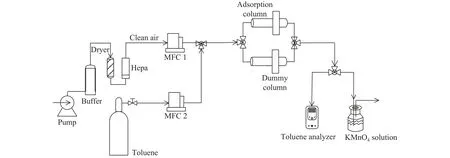
图1 吸附甲苯实验流程图Fig.1 Schematic of toluene adsorption system
吸附柱内径为7 mm,柱内装填粒径为250~425 μm 质量 70~80 mg的吸附剂和相同粒径质量700~800 mg的石英砂. 吸附柱设置空白组和实验组,载气和甲苯混合之后的气体通入到空白组,待VOCs检测仪示数稳定后记录此数值标记为进气浓度C0,同时通过三通阀门将进气切换到实验组.末端设置酸性高温酸钾溶液吸收甲苯尾气.
使用热重分析仪(TGA, Q50,美国沃斯特公司)对已吸附饱和的ZSM-5分子筛进行脱附实验,得到质量变化(TG)曲线和质量变化速率(DTG)曲线. 首先对100 mg吸附剂进行预处理以去除含有的水分和气体以及其它杂质,放入含有20 mL甲苯溶液的烧杯中并振动,密封之后在室温静置6 h使得吸附剂吸附甲苯饱和,在120 ℃烘箱中干燥1 h去除多余的甲苯液体得到脱附实验样品. 上述3种脱附样品分别取三份20 mg左右共计9份样品放入铝质托盘中,脱附程序为30 ℃温度下恒温1 min 后记录数据,分别以 10,20,30 K·min−1的升温速率加热. 在500 ℃温度下样品质量不再下降,脱附基本达到平衡,此时停止记录数据. 恢复初始平衡温度降至室温,准备下一组脱附实验.
1.3 表征仪器
X 射线衍射仪 (D8Advace, Bruker);电感耦合等离子体−原子发射光谱仪(ICP2070,Baird);全自动比表面和孔径分布分析仪(Autosorb-1,美国康塔仪器公司);多站重量法蒸气吸附仪(3H-2000W,贝士德仪器有限公司).
2 理论计算
吸附剂的动态吸附饱和量为
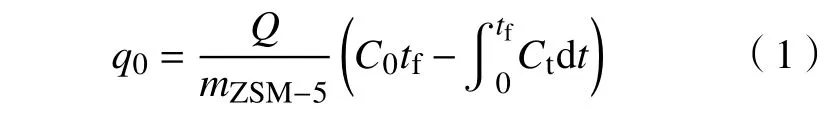
其中:q0为吸附容量,mol·g−1;Q为总气体流速,m3·min−1;mZSM-5为吸附实验吸附剂质量,g;C0为甲苯进气浓度,mol·m−3;tf为吸附时间,min;Ct为t时刻的甲苯进气浓度,mol·m−3.
吸附剂的静态饱和吸附量Langmuir-Freundlich(L-F)[11]和Freundlich表达公式分别为:
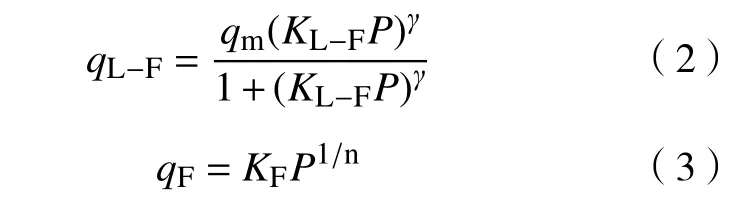
其中:qL−F为 L−F 饱和吸附量,mmol·g−1;qm为最大吸附量,mmol·g−1;KL−F为 L−F 模型吸附作用能常数;γ为校正吸附位与吸附分子系数;P为吸附质分压,量纲为一;qF为 Freundlich 饱和吸附量,mmol·g−1;KF为 Freundlich 吸附容量常数,mmol·g−1;n为吸附强度,量纲为一.
作为吸附作用强度的重要依据,为了更进一步求出吸附过程中放热数值的变化,使用范特霍夫方程公式[12]和吉布斯自由能公式计算熵变和焓变,公式如下:
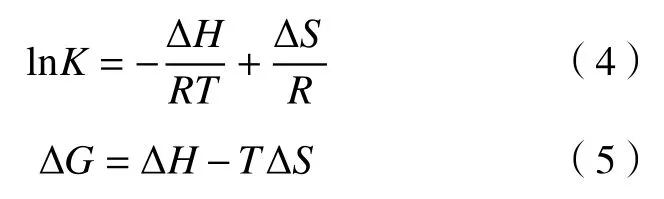
其中:R为气体分子常数,8.314 J·mol−1·K−1;T为吸附反 应温度,K;ΔH为吸 附放出热量 ,kJ·mol−1;ΔG为吉布斯自由能,kJ·mol−1;ΔS为吸附的混乱程度,J·mol−1·K−1;K为平衡常数. 通过 Freundlich 模型得到[13].
吸附剂中甲苯扩散速率采用恒定浓度波动力学计算. 其中,扩散阻力主要由内扩散阻力和气膜扩散阻力组成,KGα为总传质系数. 公式列在下方,详细推导过程见文献[14−15].
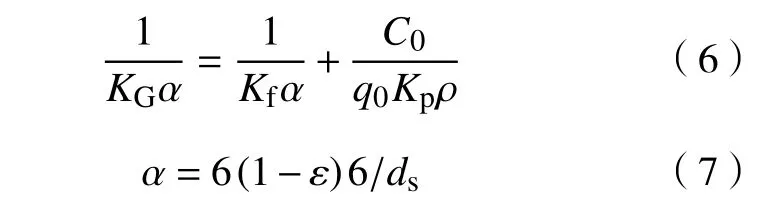
其中:ε为床层孔隙率,%;ds为吸附剂当量直径,m;KGα为总传质系数,s−1;Kf为气膜扩散阻力系数,s−1;Kp为内扩散阻力系数,s−1;C0为进口气相甲苯浓度,mol·m−3;α为床层单位体积的传质区面积,m2·m−3;ρ为固定床密度,kg·m−3.
吸附剂的脱附程度和脱附动力学的脱附活化能分别由TG和DTG曲线得,其中表示吸附剂的失重程度和脱附活化能分别用失重率θ和Kissinger[16]方程计算,表达式如下:
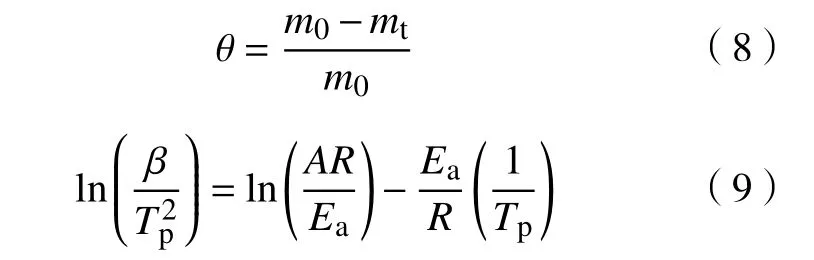
其中:m0为脱附实验吸附剂初始质量,mg;mt为时刻t的吸附剂质量,mg;Tp为DTG曲线达到峰值时相对应的温度,K;β为温度上升速率,K·min−1;A,指前因子,min−1;Ea,脱附活化能,J·mol−1.
3 实验结果与讨论
3.1 碱金属改性对 ZSM-5 结构影响分析
如图2的XRD结果显示,通过与标准ZSM-5的XRD谱图进行比较,ZSM-5衍射峰位置和强度在改性后完全保留下来,并且没有碱金属氧化物的衍射峰. 表明材料高纯度的结晶性,但碱金属改性后材料衍射峰的强度按照Na−ZSM-5≈Li−ZSM-5>K−ZSM-5呈现略微降低. 据文献报道[17],沸石中碱金属最外层电子会影响骨架原子的衍射,另外碱金属交换量的增加也会对衍射强度产生抑制效果. 其中,改性ZSM-5的碱金属交换程度和拓扑结构参数列在表1中. XRD图中26°附近改性后的三种ZSM-5分子筛衍射峰强度明显增强,这是合成过程中α-SiO2的特征峰[18],有可能是改性合成实验时间过长导致生成了更加稳定的α-SiO2.
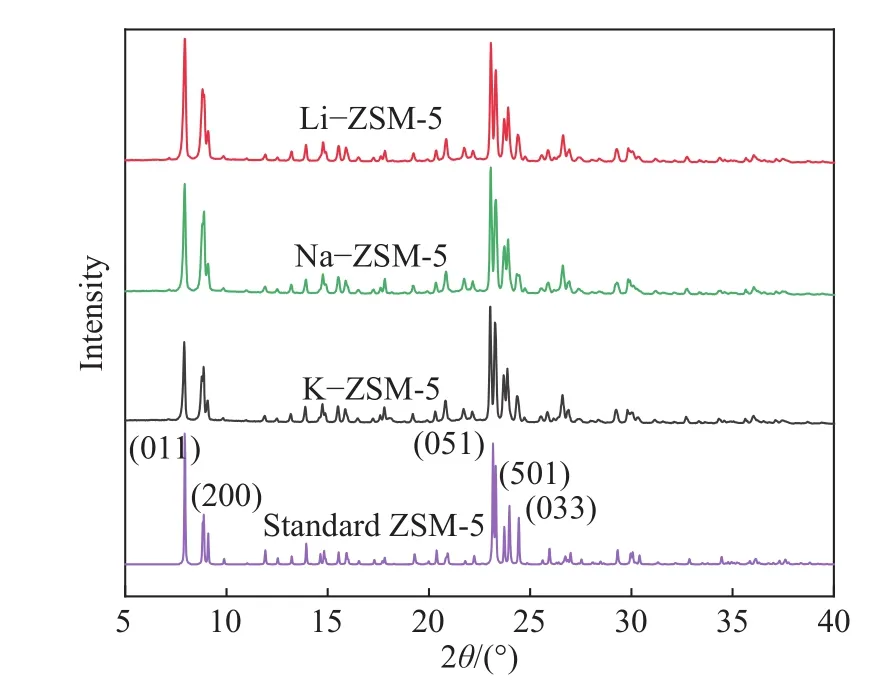
图2 改性 ZSM-5 的 XRD 图Fig.2 XRD patterns of modified ZSM-5
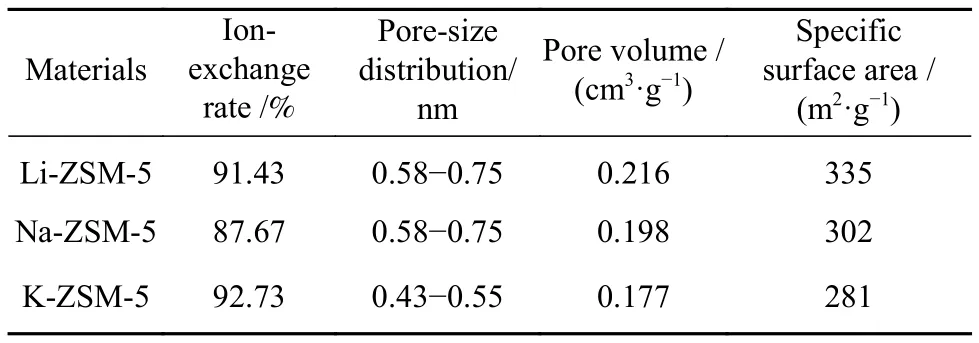
表1 改性 ZSM-5 的离子交换程度和孔结构Table 1 Ion-exchange rate and texture properties for modified ZSM-5
碱金属交换离子的电荷、水合离子半径和金属活动性顺序影响离子的交换率. 其中,离子交换率计算方式为,分别计算改性后与改性前ZSM-5材料中碱金属摩尔量/Al摩尔量的值,两个数值之比为离子交换率. 实验选择的离子电荷均为1价,离子交换率的大小只与水合离子半径有关. 有文献证明分子筛的离子交换选择性随着水合离子半径的升高而改变[19],水合离子半径排序为Li+(0.382 nm)
由图3得,ZSM-5的Ar吸脱附等温线属于国际纯粹与应用化学联合会(IUPAC)划分的Ⅰ型−向上凸等温线,表明所选取的两种分子筛为微孔结构,这与实际材料的性质相符合. 图3中分子筛孔结构中的孔径分布采用NLDFT (Nonlocal density functional theory)模型计算,表1中样品比表面积由BET (Brunauer-Emmett-Teller)方程计算相对压力 (P/P0)为0.05~0.30处的等温线数据获得,总孔容由P/P0为0.99处的吸附量计算获得,主孔径为孔容积随孔径变化率最大的孔径.
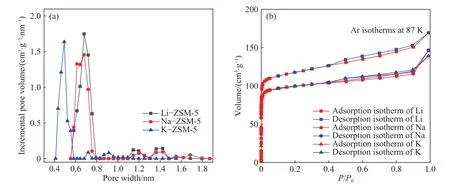
图3 改性 ZSM-5 的孔径分布(a)和吸/脱附等温线图(b)Fig.3 Pore size distribution (a) and adsorption/desorption isotherm (b) of modified ZSM-5
从表1的BET表征结果来看,不同半径的阳离子改变了分子筛的孔结构并呈现一定的规律.对于分子筛平均孔径、比表面积和孔体积,呈现出 Li−ZSM-5≥Na−ZSM-5>K−ZSM-5. 其中,主孔径分布结果为 Li−ZSM-5(0.58~0.75 nm)≥Na−ZSM-5(0.58~0.75 nm)>K−ZSM-5(0.43~0.55 nm). 交换离子位于分子筛的孔道和笼之中,在孔道上的遮挡作用使得水合半径更大和交换程度更高的离子占据孔道更多空间,导致ZSM-5孔径变得越小,比表面积和孔道体积也相应减小.
3.2 碱金属改性对 ZSM-5吸附甲苯容量影响分析
吸附热力学方面,图4主要表示甲苯在三种材料 Li−ZSM-5、Na−ZSM-5 和 K−ZSM-5 上的吸附等温线,L−F和Freundlich模型相关参数信息列在表2中. 表2为使用公式(2)和(3)拟合之后得到的热力学参数,参数R2为拟合相关系数表述实验与模型的拟合程度,L−F模型与Freundlich拟合相关系数R2均在0.99左右,说明可以很好拟合本次实验数据. 其中,参数γ值为0.3~0.5,表明甲苯在ZSM-5表面为非单分子层吸附,但饱和吸附量排序与实验结果完全相反. Freundlich模型适用于描述分子筛活性位点分布不均匀的材料,n表示活性中心的非均匀性和吸附强度的大小[21],三个材料的n值分别为2.698、2.166和1.962,表示甲苯在Li−ZSM-5有更大的吸附亲和力,这也与Li+具有最大的荷径比相一致.KF反应甲苯在ZSM-5上的饱和吸附量分别0.363 mmol·g−1>0.360 mmol·g−1>0.325 mmol·g−1.
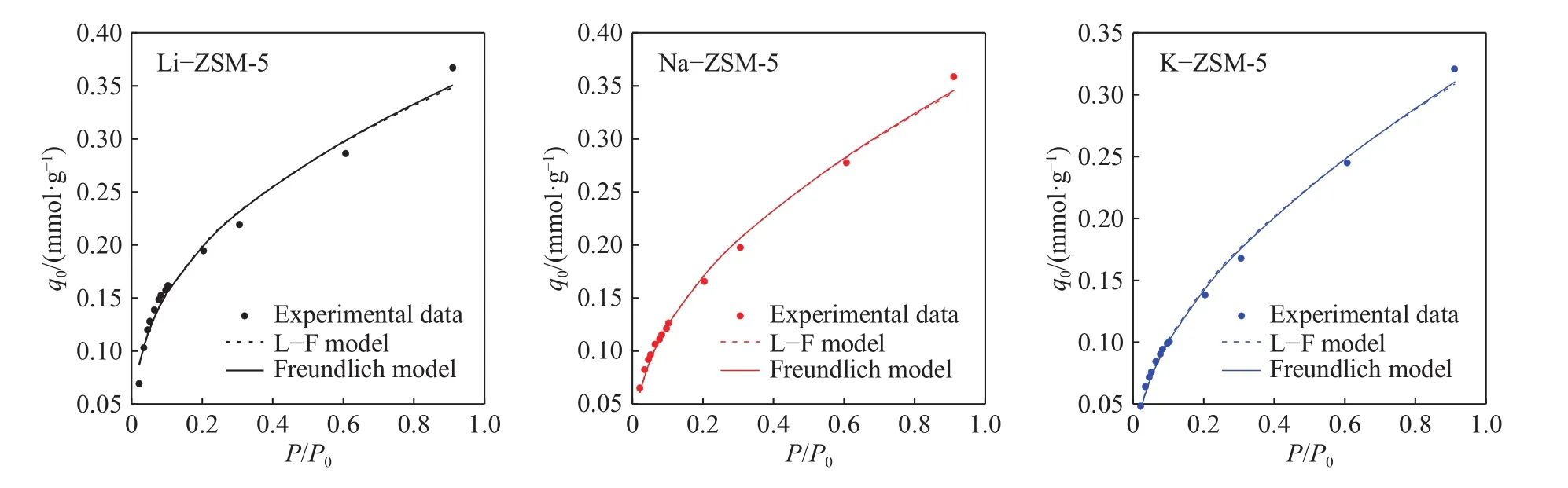
图4 298 K 温度下甲苯在改性 ZSM-5 的吸附等温线Fig.4 Adsorption isotherms of toluene on modified ZSM-5 at 298 K
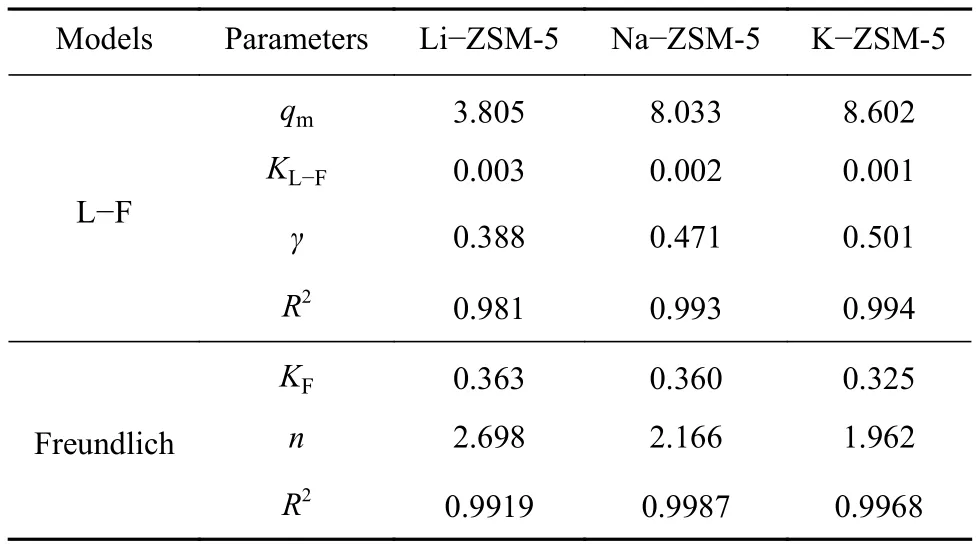
表2 吸附等温线拟合结果Table 2 Fitting results of adsorption isotherm models
图5为高低不同浓度下甲苯在改性ZSM-5中的穿透曲线. 当进气质量浓度为 25 mg·m−3时,采用公式(1)计算得到动态吸附量分别为Li−ZSM-5(0.106 mmol·g−1)>Na−ZSM-5 (0.095 mmol·g−1)>K−ZSM-5 (0.081 mmol·g−1);当进气质量浓度为155 mg·m−3时 ,Li−ZSM-5 (0.233 mmol·g−1)>Na−ZSM-5 (0.225 mmol·g−1)>K−ZSM-5 (0.215 mmol·g−1). 这与不同进气质量浓度下动态吸附量排序规律相同,但是甲苯动态吸附量略低于静态饱和吸附量,这主要是因为测量静态饱和吸附量时甲苯最大进气浓度为其达到饱和蒸气压条件的浓度,而动态吸附时甲苯气体经过载气稀释导致进气浓度较低.
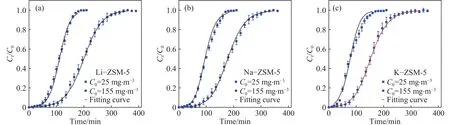
图5 298 K 温度下甲苯在改性 ZSM-5 的吸附等温线Fig.5 Model-fitting and experimental breakthrough curves for toluene on modified ZSM-5 at 295 K
吸附过程主要由吸附作用和微孔填充构成.沈文龙等[22]和Frantz等[23]认为吸附非极性气体CO2时,由于ZSM-5表面电荷的存在,CO2分子极化率、瞬时偶极矩和四极矩的增强均会提升气体吸附量. 甲苯作为极性气体,其极化率和偶极矩均高于CO2分子,因此更强的阳离子−偶极矩作用对吸附量的贡献作用更大. 吸附作用主要发生在阳离子与苯环的π键以及部分骨架中的氧原子与C−H键,相互作用的强度按离子电荷−直径比例的增大而递增,Li−ZSM-5最大的荷径比产生更强的电场强度导致对甲苯气体吸附量最大. 另外,甲苯作为三维扁平状分子,其动力学直径为0.58 nm,介于Li−ZSM-5 (0.68 nm)和 Na−ZSM-5 (0.67 nm)与 K−ZSM-5 (0.49 nm)孔径之间. 由于尺寸筛分效应,甲苯气体进入K−ZSM-5孔道时只能以“竖直”方式进入且微孔体积 (0.177 m3·g−1)最小,吸附甲苯分子数量最少. Li−ZSM-5 的孔体积 (0.216 m3·g−1)最大且孔径大于甲苯分子尺寸,在微孔填充时可利用体积更高导致更多的气体分子可以进入孔道中. 综合以上两个机制,Li−ZSM-5较大的荷径比和孔体积使得有更多的甲苯气体分子吸附在阳离子周围或者孔道中.
3.3 碱金属改性对ZSM-5吸附甲苯放热影响分析
为进一步分析不同碱金属改性的ZSM-5吸附甲苯气体时对放热能量的影响,对3种ZSM-5分子筛进行过滤负载实验. 分别对 Li−ZSM-5、Na−ZSM-5和K−ZSM-5三种分子筛在288、298、308 K 不同温度下进行吸附等温线实验,采用Freundlich模型对其等温线拟合求出KF值后使用范特霍夫方程公式(4)和(5)计算吉布斯自由能、熵变和焓变.表3为不同碱金属对吸附过程放热数值的影响.
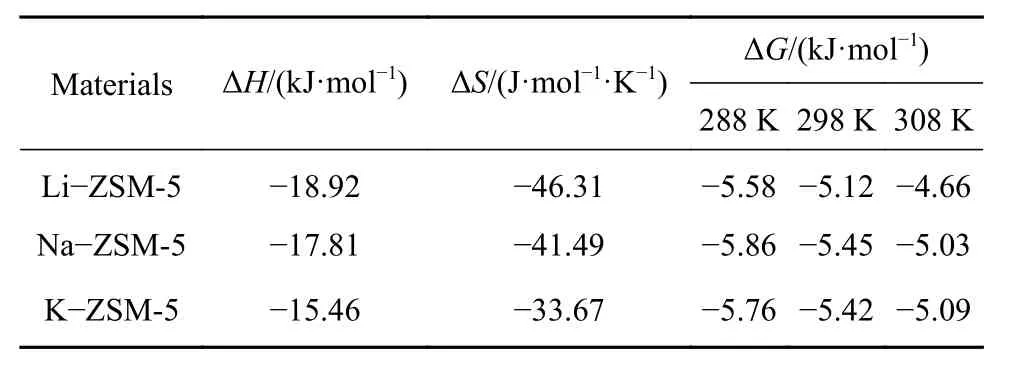
表3 甲苯吸附在改性 ZSM-5 中的热力学变化Table 3 Changes in thermodynamics for toluene adsorption on modified ZSM-5
由表3得到,对于吉布斯自由能ΔG,在不同的材料中ΔG<0表明ZSM-5对甲苯吸附过程可以在环境中自发进行. 其中,Li−ZSM-5的ΔG值在三者材料之间最低,表明甲苯在Li−ZSM-5表面吸附较其它两种材料更接近吸附平衡. 三种材料中ΔS<0表明甲苯气体被吸附到ZSM-5表面时自由程度降低,甲苯分子被吸附,其移动会受到限制导致熵变为负. 其中,Li−ZSM-5吸附甲苯的熵值变化最大,表明甲苯分子被吸附后其自由度降低程度最高,这可能与Li+较高荷径比产生较强的静电作用有关. 三种材料中ΔH<0表明此吸附为放热过程,甲苯在 Li−ZSM-5、Na−ZSM-5 和 K−ZSM-5产生的吸附热均低于 20 kJ·mol−1这是典型的物理吸附特性[13],分别为 18.92 kJ·mol−1>17.81 kJ·mol−1>15.46 kJ·mol−1,表明吸附过程中孔道叠加效应明显,甲苯分子间的π−π堆积作用占据主导[8]. 另外,吸附放热排序这与三种改性吸附剂对甲苯的静态饱和和动态吸附量规律一致,表明吸附气体分子数量越多产生的吸附热越高.
3.4 碱金属改性对 ZSM-5 吸附甲苯扩散阻力影响分析
吸附动力学方面,图5表示气体动态吸附穿透曲线的实验与模拟值,相关动力学拟合参数被列在表4,由系数R2可看出该穿透模型对纯气体和气粒混合的拟合效果较好. 其中,K−ZSM-5拟合的相关度低于另外两个材料,这可能与穿透曲线斜率较高有关,K−ZSM-5较小的孔径使得甲苯气体分子进入孔道内部困难,孔体积没有被充分利用就离开吸附剂表面,这与该模型的假设条件相违背. 其中,内扩散阻力系数KP远小于气膜扩散阻力系数Kf,表明内扩散阻力远大于气膜扩散阻力. 考虑到甲苯的分子动力学直径(0.58 nm)与ZSM-5孔径接近,内扩散为其吸附扩散的控速步骤. 对于甲苯气体在ZSM-5上的内扩散,不同的进气浓度条件下,不同材料的内扩散阻力显示出不同的排序. 从表4得出,在 155 mg·m−3进气质量浓度时,三种材料的KP值分别为 8.97×10−2、8.90×10−2、8.20×10−2s−1,内扩散阻力排序为 Li−ZSM-5
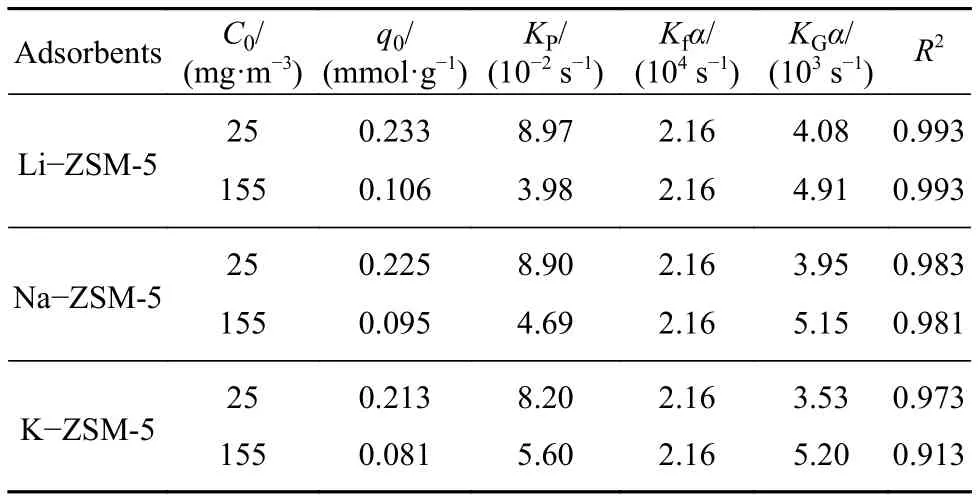
表4 甲苯在改性 ZSM-5 上的吸附动力学参数Table 4 Mass transfer parameters for toluene adsorption on modified ZSM-5
气体分子在材料中的扩散主要受到两个方面因素的影响:气体与表面的相互作用强度以及气体扩散过程的受限空间,哪个因素占主导与气体浓度密切相关. 在相对较高 155 mg·m−3进气浓度时,较高的浓度梯度产生较大气体推动力,空间位阻效应增大,气体分子在孔口堆积和积聚,较小的孔径吸附剂上(K−ZSM-5)甲苯的扩散阻力较大,因此孔径成为限制内扩散阻力的主要因素. 在较低浓度下,吸附扩散推动力较弱,吸附质分子与孔壁碰撞的频率也较弱,空间位阻对气体扩散的影响程度下降,ZSM-5孔道内阳离子对对甲苯较强的束缚力成为其扩散的主要阻力. Koriabkina等[10]认为正乙烷气体与ZSM-5吸附位点作用会增加内扩散阻力,随着ZSM-5吸附量增加此束缚作用力逐渐减弱. 电场强度更高的Li−ZSM-5对甲苯分子的作用力更大,大量的气体分子积聚在孔口附近使得在较低浓度时Li−ZSM-5受到的阻力更大.
3.5 碱金属改性对 ZSM-5 脱附甲苯影响分析
图6 为甲苯在 10,20,30 K·min−1升温速率下的ZSM-5脱附TG与DTG曲线. 由图可知TG曲线到800 K附近趋于平缓,说明在不同的升温速率条件下三种吸附剂均在800 K左右达到脱附平衡.对于不同离子改性的材料,DTG曲线均在320 K附近达到质量变化速率最高点,这低于文献中报道的活性炭脱附有机气体的温度,表明分子筛材料吸附再生性能好,同时说明ZSM-5阳离子与苯环π键结合较弱. 另外,ZSM-5脱附峰拖尾现象较严重,三种材料均在600 K附近出现第二个小峰值,尤其在K−ZSM-5材料中更为明显. 为了更深入了解甲苯在ZSM-5脱附材料的综合脱附性能,得到甲苯在ZSM-5脱附时的综合脱附动力学结果,使用Kissinger方程对三条不同升温速率的DTG曲线进行计算,脱附动力学参数结果如表5所示.
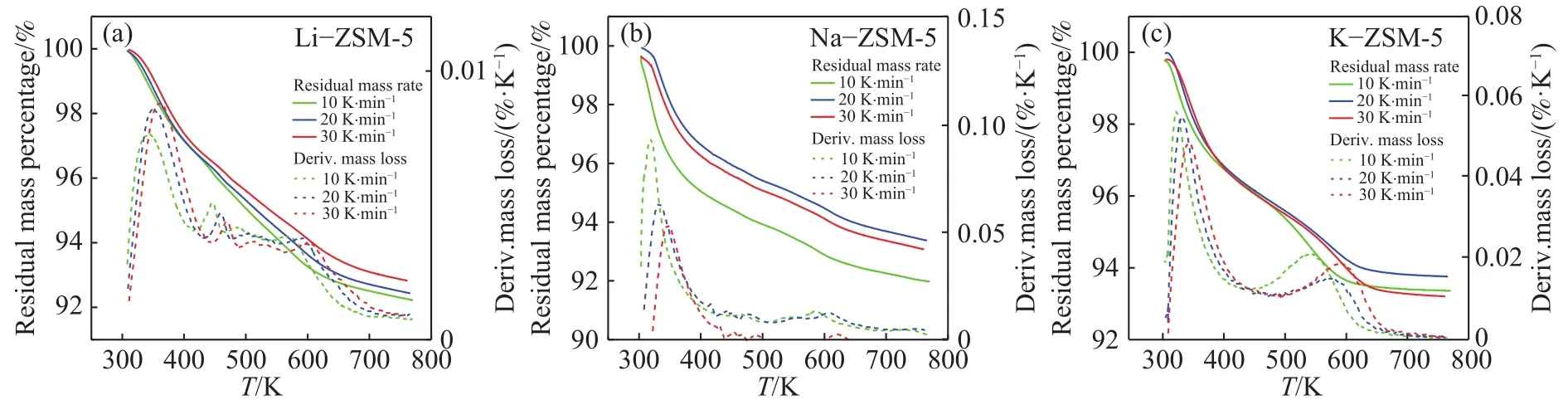
图6 甲苯在改性 ZSM-5 的 TG 和 DTG 曲线Fig.6 TG and DTG curves of toluene on modified ZSM-5
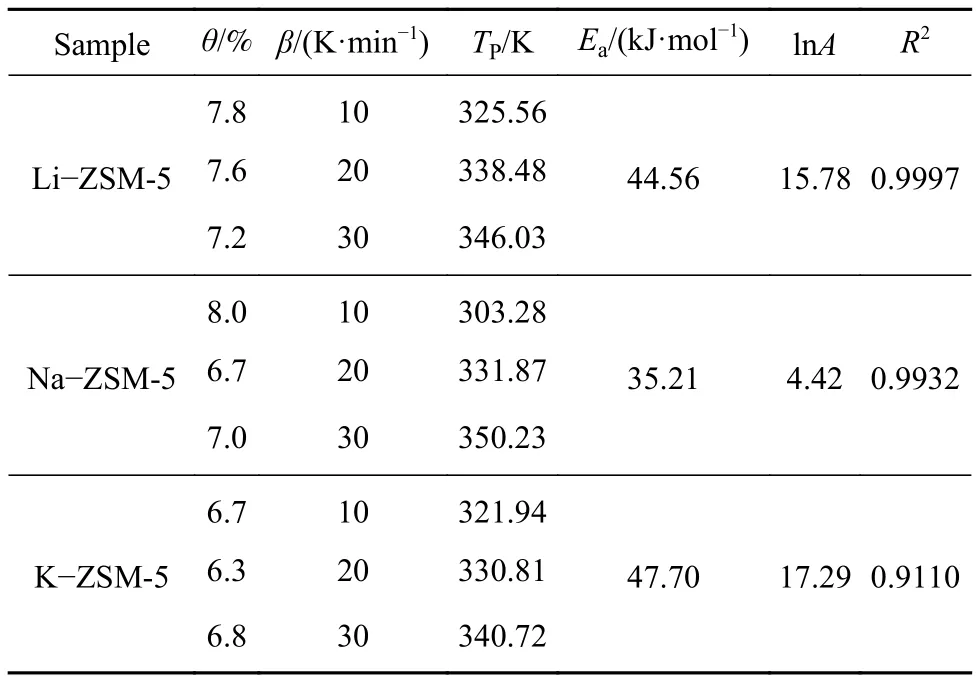
表5 Kissinger方程估算脱附动力学参数Table 5 kinetic parameters obtained by the Kissinger method
从表5看出,在不同的升温速率下,三种材料的失重率θ整体表现为 Li−ZSM-5 (7.2~7.8)>Na−ZSM-5 (6.7~8.0)>K−ZSM-5 (6.3~6.8),失重率的排序从脱附角度证明3.2章节重吸附量排序的结果.脱附活化能Ea是衡量脱附难易程度的重要参数,从表5得到三种材料的脱附活化能分别为K−ZSM-5 (47.70 kJ·mol−1)>Li−ZSM-5 (44.56 kJ·mol−1)>Na−ZSM-5 (35.21 kJ·mol−1),表明 K−ZSM-5 脱附甲苯需要的能量最高. 其中,表5中的脱附活化能与表4吸附能相差较大,主要与以下两个原因有关.脱附活化能必须能够克服吸附热(ΔH)和吸附活化能两者所形成的总位垒的能量,本实验中脱附活化能为 45 kJ·mol−1左右,略高于吸附热 18 kJ·mol−1左右. 另外,本实验采用经典TPD模型计算出的活化能包括吸附分子摆脱活性位点束缚能和气体分子反复吸脱附所需的能量[24],经典TPD模型笼统的将这两部分能量估算为脱附活化能. 综上两个原因,造成了本实验中脱附活化能和吸附能之间存在明显的差异.
脱附能大小与吸附强度及孔道空间位阻有关.吸附强度主要来自于气体和材料表面活性位点的结合强度,吸附剂孔径和气体分子的直径匹配程度影响气体分子扩散阻力的大小,孔壁内表面产生的范德华力将气体分子吸引在孔壁中[25]. 该作用力的大小与原子之间(吸附质原子与吸附剂原子)距离的六次方成反比,因此当孔径与客体分子直径接近时,孔壁产生极高的范德华力叠加势能.由文献知甲苯的三维空间结构[26],扁平状的分子最大直径尺寸为 0.8 nm,最小尺寸为 0.4 nm. 甲苯分子横向最大尺寸大于Li−ZSM-5孔径的0.68 nm,竖向最小尺寸0.4 nm小于K−ZSM-5孔径的0.49 nm.因此甲苯分子只能以0.4 nm “竖”向的形式进入ZSM-5孔道. 由于K−ZSM-5孔径与甲苯最小尺寸接近程度最高,甲苯气体分子与孔壁频繁接触产生较高范德华力;Li−ZSM-5材料中Li+的荷径比最大产生较高的阳离子吸附强度,导致K−ZSM-5和Li−ZSM-5的脱附活化能均较高且相差不大. 相反,Na−ZSM-5孔径和阳离子的荷径比均适中,产生较低的脱附活化能.
4 结论
(1)不同碱金属(Li、Na和K)的改性仅改变了ZSM-5分子筛衍射峰强度,没有引入碱金属氧化物等杂峰. 随着碱金属半径的提高,ZSM-5分子筛微孔结构(孔径、比表面积和孔体积)降低.
(2)引入骨架中半径较小的碱金属可以增加ZSM-5分子筛吸附强度和加大微孔体积,进而提高对甲苯的吸附容量,吸附量排序规律均为Li−ZSM-5 (0.363 mmol·g−1) > Na−ZSM-5 (0.360 mmol·g−1)>K−ZSM-5 (0.325 mmol·g−1).
(3)吸附强度的增加会增加物理吸附反应熵的变化程度,碱金属改性对吸附放热量的影响与吸附容量的排序一致.
(4)ZSM-5吸附甲苯的阻力主要为内扩散阻力. 较低进气质量浓度时 (25 mg·m−3)内扩散阻力主要受静电束缚力影响,阻力排序为Li−ZSM-5>Na−ZSM-5>K−ZSM-5;较高进气质量浓度时(155 mg·m−3)内扩散阻力主要受空间位阻影响,排序为 Li−ZSM-5 (5)脱附活化能同时受到吸附强度与空间阻力影响,Na型ZSM-5吸附强度和孔径均适中,脱附活化能为 35.21 kJ·mol−1在三种材料中最低表现出较好的再生性.

