PPARγ基因多态性与老年重症肺炎预后的相关性分析
陈 宵
重症肺炎是ICU常见的急危重症,病情危急,病情发展速度快,若未及时干预,严重危及患者的生命安全[1]。ICU重症肺炎患者多为老年人,老年人机体免疫调节功能减弱,病原体侵袭后,容易发生肺炎[2]。临床上对于ICU重症肺炎多采取抗感染治疗,常规治疗虽然可消除炎症达到一定疗效,但难达到预期,容易增加耐药性,不利于患者预后[3]。据相关数据统计[4],老年重症肺炎患者的病死率高达20%~50%,而且还有不断增高趋势。因此,早期识别老年重症肺炎的相关因素,尽早筛选出高风险患者,对于提升患者的近远期存活率、降低多重器官功能衰竭具有重要价值。重症肺炎是由多因素互相作用导致的一种复杂疾病,发病机制目前尚无明确定论。有研究认为[5],导致重症肺炎的发生遗传因素具有重要作用。过氧化物酶体增殖物激活受体γ(PPARγ)是核受体超家族的一员,属于自由配体激活转录因子,参与氧化应激反应、炎症反应、糖脂代谢的调控。PPARγ基因存在广泛单核算多态性,在所有PPARγ基因点位中rs1801282是研究最多的单核苷酸多态性(SNP)位点。有研究发现[6],rs1801282位点与肺炎脓毒症多器官功能衰竭具有一定相关性,但是这种突变是否与老年重症肺炎的发生和预后相关未见明确报道。因此,本文选取我院119例老年重症肺炎患者作为研究对象,探讨过氧化物酶体增殖物激活受体γ(PPARγ)基因多态性与老年重症肺炎预后的相关性,具体报告如下。
1.资料与方法
1.1 一般资料 选取我院119例老年重症肺炎患者作为研究对象,将其作为重症肺炎组,另选取同期100例老年轻症肺炎患者作为轻症肺炎组。纳入标准:患者符合重症肺炎或轻症肺炎诊断标准;为相同地区的汉族人群;年龄≥60岁;对本研究知情并签署同意书。排除标准:合并手术或创伤的患者;合并免疫系统疾病者;恶性肿瘤放化疗者;免疫系统疾病者;入院后24h内死亡患者;有器官移植史的患者;曾应用或摄入对炎症过程有调节作用的细胞因子。另取100名健康者作为对照组。三组患者一般资料对比无明显差异(P>0.05),如表1所示。

表1 一般资料
1.2 方法
1.2.1 基因检测:①DNA提取:DNA提取方法为留取外周静脉血作为标本,在-20℃冷冻保存,应用北京天根生化科技有限公司DNA提取试剂盒提取全血基因组DNA,最终将样本置于-80℃冷冻箱内冷冻保存。基因点位筛选方法为依照基因分型结果应用Haploview4.2软件依照r2≥0.8且最小等位基因频率>0.1标准选取rs1801282标签作为SNP位点。②SNP点位选择:查阅相关NCBI中dbSNP相关数据库,找到PPARγ基因功能区的SNPs位点,并在Pubmed上找出已经发表的关于PPARγ基因与疾病相关的SNPs点位。最后从HapMap数据库中选择当地汉族人群作为样本,以r2>0.8作为主要条件,得到标签SNPs。共得到13个SNPs。由于以往研究发现PPARγ基因rs1801282点位SNP与肺炎发生具有一定关系,因此本文仅针对PPARγ基因rs1801282点位进行分析[7]。③PCR扩增条件:rs12255372,95℃预变性5min后进行下序循环,94℃变性30s,60℃退火15s,72℃延伸30s,共32个循环,最后72℃延伸8min;rrs7955866,95℃预变性5min后进行下序循环,94℃变性30s,54℃退火15s,72℃延伸30s,共32个循环,最后72℃延伸10min。
1.2.2 资料收集:收集所有患者的性别、年龄、病程、自身合并基础疾病类型、住院时间、PSI评分等一般临床资料。肺炎严重指数(PSI)评分主要是针对患者各项临床指标进行评价,分数越高表示患者肺炎越严重。
1.2.3 重症肺炎组的再分组研究:所有患者院内28d死亡情况进行统计,28d内存活的患者为存活组(n=94),死亡的患者为死亡组(n=25);合并重度器官功能衰竭的36例患者为重度气管功能衰竭组,轻度器官功能衰竭的83例患者为轻度器官功能衰竭组。对比不同临床结局与器官衰竭程度患者的临床特征。
1.3 统计学方法 采取SPSS 23.0软件,计数资料以(例数/百分比)表示,进行χ2检验。计量资料以符合正态分布则用(均数±标准差)表示,组间比较采用t检验。采用Spearman相关分析方法分析PPARγ基因多态性与老年重症肺炎预后的相关性。以P<0.05为差异有统计学意义。
2.结果
2.1 PPARγ基因rs1801282点位多态性对比分析 重症肺炎组、轻症肺炎组和对照组PPARγ基因rs1801282点位的等位基因与基因型对比差异显著(P<0.05),如表2所示。

表2 PPARγ基因rs1801282点位多态性对比分析 单位:例
2.2 不同器官衰竭程度和不同临床结局患者的临床特征对比分析 死亡组与存活组、重度器官功能衰竭组与轻度器官功能衰竭组患者性别、合并基础疾病、住院时间对比无明显差异(P>0.05),死亡组与存活组患者年龄、PSI评分、rs1801282基因型对比差异显著(P<0.05),如表3所示。

表3 不同器官衰竭程度和不同临床结局患者的临床特征对比分析 单位:例
2.3 PPARγ基因多态性与老年重症肺炎预后的相关性 Spearman相关分析结果显示年龄、PSI评分、rs1801282基因型与临床结局具有明显相关性(P<0.05),年龄、rs1801282基因型与器官衰竭程度具有明显相关性(P<0.05),如表4所示。
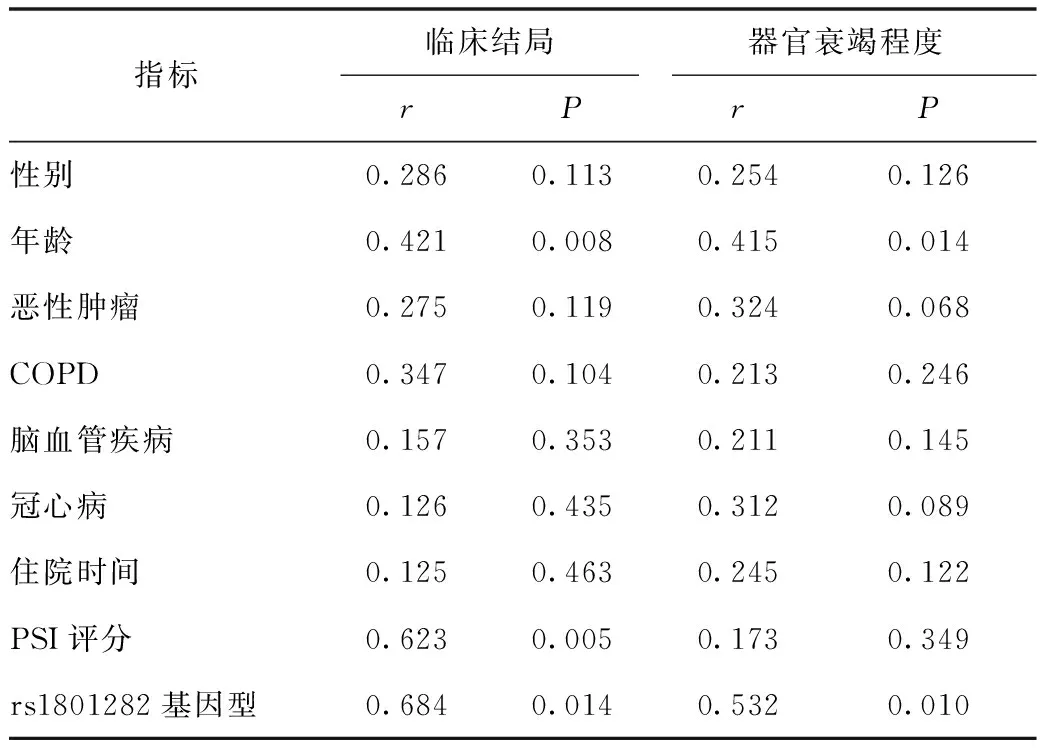
表4 PPARγ基因多态性与老年重症肺炎预后的相关性
3.讨论
PPARγ是核转录因子的一种,参与人体氧化应激反应、炎症反应以及糖脂代谢反应调控。有研究发现[8],PPARγ基因存在广泛多调性,在所有PPARγ基因的位点中rs1801282被认为是与炎症因子关系最密切的位点,该位点位于外显子2第12位密码子,在发生从CCA向GCA突变之后,编码的氨基酸从脯氨酸变为丙氨酸,导致编码产物蛋白结构与功能发生变化。PPARγ基因rs1801282点位在不同人群中存在一定差异,在亚洲人群中位点SNP发生率明显低于白种人。有报道显示[9],中国汉族人群PPARγ基因的rs1801282位点的GG+GC突变基因型比例约为15%左右,而且多发生纯合突变现象,并且PPARγ基因编码产物的炎症抑制作用会受到影响,参与多种炎症疾病的发生与发展。孙小平等研究发现[10],肺炎脓毒症患者的PPARγ基因rs1801282位点SNP分析最终结果发现,脓毒症器官衰竭患者肺炎脓毒症发生GG纯合突变的患者为零,只有1例出现GC杂合突变,提示PPARγ基因位点C向G的突变可能对肺炎脓毒症起到一定保护作用[11]。因此本研究针对PPARγ基因多态性与重症肺炎预后相关性进行分析,希望能够为日后重症肺炎的治疗与预后判断提供参考。
本研究结果表明,重症肺炎组、轻症肺炎组和对照组PPARγ基因rs1801282点位的等位基因与基因型对比差异显著(P<0.05),由此证明PPARγ基因rs1801282点位可能与肺炎严重程度具有一定关系。研究发现[12],PPARγ基因的遗传变异可能与脓毒症的临床转归具有相关性,与本研究结果相似,这可能是因为PPARγ具有多种效应,不仅能够调节免疫反应与炎症因子,还在维持机体稳态与糖脂代谢中具有重要作用。当前大多数研究中,对于PPARγ基因的研究多集中在恶性肿瘤、代谢综合征、2型糖尿病、血脂紊乱与变异性肥胖等方面,与重症肺炎预后相关性的研究报道比较少见[13,14]。死亡组与存活组、重度器官功能衰竭组与轻度器官功能衰竭组患者性别、合并基础疾病、住院时间对比无明显差异(P>0.05),死亡组与存活组患者年龄、PSI评分、rs1801282基因型对比差异显著(P<0.05),由此证明老年重症患者临床结局与多器官功能衰竭除了与肺炎严重程度和年龄相关,还与PPARγ基因rs1801282突变具有一定相关性。有研究发现[15],重症肺炎患者的合并基础疾病情况与住院时间和患者预后具有一定关系,与本研究结果不同,这可能是因为本研究数据样本量过少,与以往研究结果存在一定差异,因此还需后续加大样本量进行持续深入研究。有研究发现[16],rs10865710能够增加脓毒症发病风险与疾病严重程度评分,但是本研究中没有发现PPARγ基因rs10865710位点与重症肺炎的转归相关,造成此研究结果的不同可能是因为重症肺炎与脓毒症的发病机制有所不同,还可能由感染病原体、种族差异、环境因素以及样本量偏小具有一定关系。Spearman相关分析结果显示年龄、PSI评分、rs1801282基因型与临床结局具有明显相关性(P<0.05),年龄、rs1801282基因型与器官衰竭程度具有明显相关性(P<0.05),由此证明年龄越大的重症肺炎患者发生多器官功能衰竭的人数和死亡率偏高。rs1801282基因型也可能是影响重症肺炎多器官功能衰竭和临床死亡结局的重要因素。有研究发现[17],rs1801282能够降低脓毒症重度器官功能障碍发生风险,其功能研究发现与脯氨酸到丙氨酸的突变有关,从而造成PPARγ和靶基因结合能力降低,减弱PPARγ对于靶基因转录与激活。有研究发现[18],PPARγ抗炎作用是通过转录抑制,也就是干扰核因子-kB和活化蛋白-1等靶基因的结合,从而抑制靶基因的转录,此功能并不需要PPARγ和靶基因结果。所以,rs1801282通过什么样的机制影响重症肺炎的预后还需进一步研究探索。
综上所述,PPARγ基因多态性可能与老年重症肺炎患者的死亡与多器官功能障碍相关,因此可以考虑针对临床老年重症肺炎患者可应用PPARγ基因rs1801282点位多态性来判断患者的预后情况,并制定对应的治疗措施。

