微波消融术联合免疫治疗合并慢性淋巴细胞白血病与小淋巴细胞淋巴瘤的肺鳞癌1例并文献复习
刘 松 乔元岗 邱忠华 张伟伟 焦桂花
肺癌因其高发病率和死亡率,严重危害人类健康。对于各种原因不能行外科手术的早期非小细胞肺癌,微波消融术是一种有效的局部介入治疗方法。同时,近年来免疫单药治疗肺癌也取得了突破性进展。近期我院介入治疗科收治1例合并CLL/SLL的早期周围型肺鳞状细胞癌患者,应用微波消融术联合免疫治疗,现报道如下。
1.病例资料
患者,男性,69岁,既往慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)病史8年,行多次化疗,目前规律口服伊布替尼胶囊(420mg,1次/日)。否认呼吸系统及心血管系统病史;无烟酒不良嗜好。因“声音嘶哑、咳嗽1月入院”于2020年4月5日入院。患者无咯血、胸痛、憋喘等症状。入院查体:体温36.5℃,血压120/70mmHg;全身皮肤、黏膜未见出血点及瘀斑,颈部及腹股沟淋巴结未触及肿大,双腋窝可触及小淋巴结;双肺呼吸音粗,未及干湿性啰音;心率80次/分,律齐;腹平软,无压痛及反跳痛,肝脾未触及;双下肢无水肿。实验室检查:白细胞16.02×109/L,血小板48×109/L,淋巴细胞百分比62.20%,中性粒细胞百分比35.40%;凝血酶原时间10.1s,部分凝血活酶时间30.0s,纤维蛋白原2.9g/L,D-二聚体0.24mg/L,鳞状上皮细胞癌相关抗原1.1ng/ml;癌胚抗原8.50ng/ml;神经特异性烯醇化酶14.270ng/ml;细胞角蛋白19片段测定4.030ng/ml,余检验结果未见明显异常。胸部CT扫描:与前片比较,左肺下叶外基地段新发一实性结节,直径约20mm,界清,见分叶及毛刺,局部支气管截断(图1);支气管炎,肺气肿。入院诊断:肺占位、肺气肿、支气管炎。

图1 胸部CT肺窗红箭头所示:左肺下叶外基地见一实性结节,见分叶及毛刺,局部支气管截断。
患者入院后给予药物抗炎、止咳化痰等治疗,为明确病变性质,先行CT引导下肺穿刺活检术。病理结果回示:鳞状细胞癌,基因检测示:EGFR/ALK阴性;TMB:0Mb;微卫星稳定状态(MSI-S);PD-L1:TPS:10%,CPS:10(图2、图3)。患者病情较复杂,为获得最佳治疗方案组织多学科讨论,胸外科、肿瘤科、血液科均考虑患者合并淋巴瘤,血小板减少,同时结合基因检测结果,不适宜行手术切除、放化疗及靶向治疗,建议系统治疗可选用PD-1抑制剂。我科考虑患者病灶单发,小于3cm,可行局部消融治疗。经讨论后拟订方案:肺部肿瘤局部行微波消融术,序贯静滴卡瑞利珠单抗行免疫抑制治疗。于2021年4月13日行CT引导下肺肿瘤微波消融术,手术顺利。2020年5月15日复查胸部强化CT,肿瘤灭活(见图4)。分别于2020年5月16日、5月30日、6月13日、6月27日4次应用注射用卡瑞利珠单抗200mg行免疫抑制治疗。2020年7月初当地医院复查CT提示肿瘤复发,为控制肿瘤进展2020年7月17日行第二次微波消融术(见图5),术后于7月20日、8月11日、8月25日3次应用注射用卡瑞利珠单抗200mg行免疫抑制治疗。2020年9月1日,患者开始出现发热,体温最高达39.0℃,伴寒战、咳嗽、咳脓痰,无咯血等不适。在当地医院给予抗感染治疗(具体药物、剂量不详),效果不佳。为进一步治疗,于2020年9月10再次入住我科。入院后我科首先考虑为肺部感染,给予莫西沙星400mg,1次/日静滴,并给予止咳、化痰等对症治疗;但患者应用PD-1,不排除合并免疫相关性肺炎,需完善胸部CT等检查,进一步明确病因。复查胸部CT:肺部肿瘤消融后基本灭活(见图6);右肺上叶新发炎症。查白细胞5.32×109/L,血小板24×109/L,C反应蛋白248.32mg/L,降钙素原1.969ng/ml。结合相关检查结果,患者肺部感染诊断明确,但患者血小板数值较前明显降低,继续积极抗感染治疗,同时输注单采血小板、皮下注射重组人血小板生成素15000U 1次/日升血小板治疗。经上述处理后,患者未再发热,复查实验室检查:白细胞4.21×109/L,血小板62×109/L,C反应蛋白70.70mg/L,降钙素原0.58ng/ml,各项炎症指标明显好转,血小板亦较前上升。2020年9月25日再次应用注射用卡瑞利珠单抗200mg后出院。出院后患者每2~3周来院应用卡瑞利珠单抗,定期复查血常规、胸部CT(见图7)等检查,肺肿瘤无复发,血小板数值维持在70×109/L到95×109/L之间,且未出现反应性皮肤毛细血管增生症表现。患者自发病距今已1年,目前病情稳定,继续随访。

图2 基因检测送检样本位点分型,结果示:微卫星稳定(MSI-S)型

图3 免疫组化PD-L1(10×40):抗体型号SP263;检测方法IHC;检测结果TPS:10%,CPS:10

图4 复查胸部CT:肿瘤灭活,瘢痕形成(圆圈)。
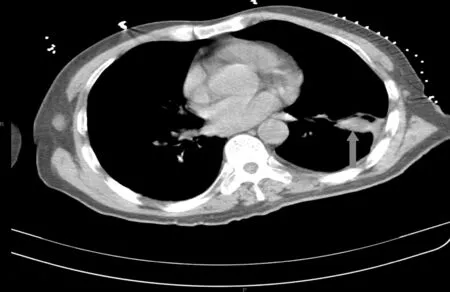
图5 第二次微波消融定位时可见复发肿瘤(箭头所示)。

图6 复查胸部CT:病灶灭活,瘢痕形成(圆圈)

图7 2020.12.28复查胸部CT左肺肿瘤瘢痕形成,无活性(圆圈)
2.讨论
肺癌是全世界患病率和病死率最高的癌症[1],其中肺鳞状上皮细胞癌(简称肺鳞癌)是肺癌最常见的病理类型,占45%~50%[2]。对于早期肺鳞癌患者,目前的指南首推手术切除以及区域性淋巴结清扫。然而,许多患者可能由于并发症或器官的功能状态有限而不能耐受手术[3]。因此,我们需要选择一些微创、高效、安全的治疗手段。
近年来,微波消融术(microwave ablation,MWA)作为一种局部控制肿瘤的介入手段已广泛在临床应用。微波探针在300MHz~300GHz的微波频率范围内产生椭圆形电磁场。电磁场的振荡导致水分子改变其运动方向。水分子的运动通过介电损耗使周围组织温度升高(>60℃)进而产生凝固性坏死。这种类型的热消融对组织传导的依赖较少,并且可能不会受到限制射频消融(radiofrequency ablation,RFA)的热沉效应影响,从而产生更均匀的消融区域,破坏肿瘤微血管,使肿瘤细胞变性坏死,减少机体的肿瘤负荷,同时刺激机体免疫系统,提高机体免疫功能,起到抑制肿瘤细胞复发、扩散的作用,因此已经被用于经皮治疗各种器官的肿瘤[4]。研究[5]结果显示,MWA安全有效,与胸腔镜下手术切除治疗相比,两者随访1年和2年总生存率和肿瘤无复发生存相似。本例患者病灶单发,直径约2cm,2020年4月虽胸部CT提示纵膈及双侧腋窝多发稍大淋巴结,但对比既往CT,考虑系CLL/SLL病史所致,不支持淋巴结转移,且患者无远处转移,结合穿刺活检病理为鳞状细胞癌,依据2020版CSCO非小细胞肺癌(non-small cell lung cancer,NSCLC)指南,属于IB期NSCLC。治疗方案首选手术切除、淋巴结清扫或放疗,但患者高龄,合并CLL/SLL病史8年,行多次化疗,血小板一直处于较低水平,骨髓抑制Ⅲ度,胸外科考虑手术切除风险大,肿瘤科考虑行放疗会加重骨髓抑制,两种方案均不适合。我科考虑病灶位于左肺下叶外基地段,属于周围型肺癌的范畴,且病灶直径小于3cm,周围无重要血管及组织,选择在CT引导下对该病灶进行微波消融术。
目前尚无采用CT引导下经皮MWA治疗早期周围型NSCLC的多中心研究。Yang等[6]回顾性评价47例不能手术的I期周围型NSCLC患者MWA的安全性及有效性,中位随访时间为30月。MWA后1年、2年、3年和5年的总存活率分别为89%、63%、43%和16%。本例患者共行两次微波消融术,第一次术后3月即出现了局部复发。有研究[7,8]表明肺亚叶切除术和MWA治疗早期肺癌的疗效相似,术后总生存率差异无统计学意义,但MWA组的肿瘤局部复发率更高。该患者局部复发的原因,我们考虑系因顾忌患者血小板低,有大出血风险,第一次术中选择消融时间较短和范围不够所致。在行第二次消融术中,在确保安全的前提下,我们延长了消融时间,扩大了消融范围,二次消融后随访至今已9月,未再局部复发。微波消融术后常见并发症有气胸、咯血、胸腔积液、肺部感染和支气管胸膜瘘等[6],其中气胸最常见,发生率为10%~67%,多数气胸是自限性,可自行吸收[9]。本例患者仅在第二次微波消融术后出现少量气胸,未行特殊处理后自行吸收,后续复查胸部CT亦未见迟发性气胸。因此,MWA是治疗早期肺癌安全、有效的方法。
目前肺癌治疗的三大研究热点:抗肿瘤血管生成治疗、靶向治疗及免疫治疗。本例患者血小板一直处于较低水平,应用抗血管生成药物有出血风险,且基因检测提示无敏感靶向药物,从而否定了前两种方案。近年来肺癌的免疫治疗取得了重要进展,但大多应用的NSCLC患者已处于Ⅲ期、Ⅳ期。随着2020 CSCO非小细胞肺癌诊疗指南注释部分增加了CheckMate 159、LCMC3、NADIM及NEOSTAR等多项免疫新辅助治疗研究,意味着未来免疫新辅助治疗可在早期至局部晚期治疗NSCLC中得到更广泛应用[10]。该患者虽处于IB期,但因可选择的治疗方案有限,为延长生存期、提高生活质量,我们考虑联合应用PD-1抑制剂。关于肺鳞癌的免疫治疗,EYOTE-407研究[11]显示,帕博利珠单抗联合化疗显著延长PFS期(中位PFS期8.0月比5.1月,HR=0.57)和OS期(中位OS期17.1月比11.6月,HR=0.71),不良反应未明显增加。NMPA已于2019年批准帕博利珠单抗联合卡铂及紫杉醇用于转移性肺鳞癌的一线治疗,2020年CSCO指南将其推荐等级上调至Ⅰ级推荐[10],同时在注释中添加卡瑞利珠单抗二线治疗晚期NSCLC的Ⅱ期伞形研究内容和卡瑞利珠单抗联合阿帕替尼二线治疗晚期NSCLC的Ⅱ期研究内容[10]。慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(chronic lymphocytic leukemia/ small lymphocytic lymphoma,CLL/SLL)是主要发生在中老年人群的一种具有特定免疫表型特征的成熟B淋巴细胞克隆增殖性肿瘤[12]。该疾病在西方国家发病率高,而在亚洲相对少见[13]。本病例患者罹患CLL/SLL病史8年,已行多次化疗,目前采用公认的单药方案伊布替尼维持治疗[14]。文献表明CLL/SLL患者因免疫缺陷等原因,易合并第二肿瘤,其中以肺癌、恶性黑色素瘤等实体瘤多见[15]。该患者无吸烟史,肺癌发病原因不排除与合并CLL/SLL病史相关。同时,有研究表明5%~10%的病例向高级别淋巴瘤转化(Richter转化),其中转化为霍奇金淋巴瘤(hodgkin lymphoma,HL)占0.1%~0.7%,其发生机制还不清楚[13,16],一旦发生转化,预后较差[17]。随着免疫疗法在恶性肿瘤中的发展,免疫检查点抑制剂在血液系统肿瘤中的应用增多。有研究[18]表明帕博丽珠单抗被用于治疗在前期使用了伊布替尼后疾病进展发生Richter转化的患者,其客观反应率为44%,中位总生存时间为11个月。鉴于以上综合考虑,我们给予患者推荐联合应用免疫抑制剂帕博丽珠单抗或卡瑞利珠单抗。患者因经济状况,最终选择应用卡瑞利珠单抗。
卡瑞利珠单抗作为国内自主研发的PD-1抑制剂,是一种人源化免疫球蛋白G4(IgG4)型单克隆抗体(mAb)[19],可与PD-1靶向结合,阻断其与PD-L1及程序性死亡配体2(PD-L2)之间的相互作用而恢复机体免疫功能,最终发挥抗肿瘤的作用[20,21]。在最新的CameL-sq[22]研究中,共纳入389例未经治疗的经组织学或细胞学证实的ⅢB~Ⅳ期鳞状NSCLC患者(卡瑞利珠单抗联合化疗组193例,安慰剂联合化疗组196例)。数据截至2020年11月6日,与安慰剂联合化疗组相比,卡瑞利珠单抗联合化疗组显著改善了患者的PFS(8.5月vs.4.9月,HR=0.37,95%CI 0.29~0.47,单侧P<0.0001),卡瑞利珠单抗联合化疗组患者疾病进展或死亡风险下降63%。亚组分析显示,PD-L1 TPS<1%人群(HR=0.49,95%CI 0.35~0.68)和PD-L1 TPS≥1%(HR=0.34,95%CI 0.24~0.49)人群中均观察到PFS的获益。卡瑞利珠单抗联合化疗组同样带来了OS的显著获益,两组中位OS分别为未达到(95%CI 18.4~NR)和14.5月(95%CI 13.2~16.6,HR=0.55,95%CI 0.40~0.75,单侧P<0.0001)。此外经IRC评估,卡瑞利珠单抗联合化疗组还显著提高ORR(64.8% vs.36.7%,P<0.0001)、延长中位缓解持续时间(13.1月vs.4.4月)。安全性方面,3级及以上TRAE发生率卡瑞利珠单抗联合化疗组为73.6%,安慰剂联合化疗组为71.9%,未观察到预期外的不良反应。最近更新的2021版CSCO指南中,已将卡瑞利珠单抗联合紫杉醇和铂类列为晚期鳞状NSCLC一线治疗Ⅱ级推荐(ⅠA类证据)。就本例患者来讲,因考虑其骨髓抑制不宜行化疗,同时参考最新指南中提及帕博利珠单抗单药治疗晚期鳞状NSCLC一线治疗Ⅰ级推荐(TPS1%~49%,ⅡA类证据),相当于给予该患者“去化疗”的免疫治疗。对于该患者的疗效评价,我们在参考了免疫相关RECIST标准[23]的同时,还是以RECIST 1.1标准为主进行判定。就目前随访情况来讲,通过介入加免疫联合治疗,患者取得了不错的临床受益。患者在应用了4次卡瑞利珠单抗后,出现了发热、咳嗽、咳浓痰的情况,我们考虑合并免疫检查点抑制剂相关肺炎(checkpoint inhibitor pneumonitis,CIP)的可能性。因为CIP可表现为新发或加重的呼吸困难、咳嗽、胸痛、发热及乏力等[24],且肺癌患者CIP的总发生率及重度CIP的发生率均高于其他肿瘤患者[25,26]。最后行胸部CT检查,并符合CIP双肺野散在或弥漫性磨玻璃影、斑片状实变影等影像学表现[27],排除该诊断。该患者在出现肺部感染的同时,伴随着血小板数值的急剧下降,我们考虑系感染所致。在输注血小板的同时,给予对巨核细胞生成的各阶段均有刺激作用的重组人血小板生成素[28],使患者的血小板在短时间内得到了上升,降低了出血风险。我们在治疗中还发现,该患者未出现应用卡瑞利珠单抗后的反应性皮肤细血管增生症[19],后续还在观察其余不良反应。
随着肺癌筛查及影像学定位技术不断进步,早期周围型肺癌的检出率逐年增加,目前多家单中心正在进行的CT引导下的微波消融技术获得了良好的局部疗效结果[4],MWA术必然成为早期周围型肺癌的非手术治疗的主角之一。同时,基于热消融后机体的抗肿瘤反应及肿瘤免疫学的相关研究,联合治疗模式逐渐被认可[29]。未来还需要多中心、大样本的研究,来探索更新的治疗方案,但是不可否认,越来越多的中国声音正在逐渐改变着中国肺癌患者的治疗格局。

