共轭亚油酸甘油酯及其微囊乳液对高脂饮食诱导的大鼠非酒精性脂肪肝的缓解作用
文瑾,范超,夏俪宁,石超,吴文忠
(大连医诺生物股份有限公司,辽宁 大连,116600)
随着社会的发展进步,生活水平的逐渐提高,很多人饮食结构逐渐失衡,引起了多种代谢综合征全球化的流行,如脂肪性肝病、Ⅱ型糖尿病、心血管系统疾病、骨关节疾病等。其中,脂肪性肝病已取代慢性乙型肝炎成为我国最常见慢性肝病,发病率不断攀高并趋于低龄化,因此引起了广泛的关注[1]。脂肪性肝病可分为酒精性脂肪肝(alcoholic fatty liver disease, AFLD)与非酒精性脂肪肝(non-alcoholic fatty liver disease NAFLD),其中NAFLD患者大多伴有肥胖、胰岛素抵抗或2型糖尿病、血脂异常、高甘油三酸酯血症和高血压等多种危险因素,引起代谢综合征高发病率,因此对NAFLD病理机制及治疗方法的研究成为了近年来的研究热点[2-3]。但目前NAFLD的治疗主要以祛除诱因、调整饮食、减轻体重为主,尚没有明确真正有效的治疗药物上市。
共轭亚油酸(conjugated linoleic acid, CLA)是一种天然的具有共轭双键的十八碳二烯酸异构体的新型功能性脂肪酸,普遍存在于人和动物体内,但又无法自主合成,仅能从食物中摄取。主要通过摄入反刍动物的脂肪以及牛奶制品而得,其有免疫调节、抗癌、抗动脉粥样硬化、抗氧化、抗过敏、抗糖尿病、降血脂、影响骨形成等多方面生物学功能[4]。但CLA天然来源较少,且以游离脂肪酸形式存在,易氧化且口感不好,因此人工合成将其制备为甘油酯形式成为了获取CLA的主要途径,酯化后保持了CLA的营养价值并且气味、稳定性更好,且合成成本较低。但由于共轭亚油酸甘油酯(conjugated linoleic acid glyceride, CLA-TG)为含有共轭双键的长链脂肪酸酯,因此乳化难度较大。本课题组在前期工作中将CLA-TG与淀粉或胶质、小分子填充物、抗氧化剂在一定条件下有效结合,经剪切乳化及高压均质制备得到微囊化CLA-TG,使其易于乳化,达到提高稳定性及生物利用度作用[5]。
因此,本研究考察了CLA-TG及微囊化CLA-TG对高脂饮食诱导的NAFLD相关指标的影响,为临床治疗及预防脂肪性肝病提供了一种新的策略,也为CLA-TG的应用开拓了新的方向。
1 材料与方法
1.1 材料与试剂
共轭亚油酸甘油酯,含量81.4% (c9,t11 CLA 39.6%;t10,c12 CLA 39.6%)(批号11825F)、微囊化共轭亚油酸甘油酯乳液,含上述共轭亚油酸甘油酯20%(批号SNT18103102),大连医诺生物股份有限公司;健康成年雄性SPF级SD大鼠,体重160~180 g,共40只,由北京维通利华实验动物技术有限公司提供(许可证号:SCXK(京)2016—0006,实验动物质量合格证编号:No.1100111911028450)。
基础饲料和高脂模型饲料均由北京华阜康生物科技股份有限公司提供。其中基础饲料能量配比为64.5%碳水化合物,13.3%脂肪,22.2%蛋白质;高脂饲料能量配比为71%脂肪,11%碳水化合物及18%蛋白质[6]。
甘油三酯、谷丙转氨酶、谷草转氨酶、总胆固醇、低密度脂蛋白、高密度脂蛋白含量检测试剂盒,南京建成生物工程研究所。
1.2 仪器与设备
电子分析天平,上海第二天平仪器厂;恒温水浴锅,上海医用恒温设备厂;SCP7OH 低温超速离心机,美国 HITACHI 有限公司;组织匀浆机,德国 IKA 集团;Thermo 354 酶标仪,美国Thermo Scientific 公司;YS2倒置生物显微镜,日本尼康公司;4715 组织包埋机,日本樱花公司;冰冻切片机,德国徕卡公司。
1.3 实验方法
1.3.1 动物造模方法及样品留存
SD大鼠饲养于SPF级动物房中,单笼饲养,食水自由摄入,动物房温度20~26 ℃,湿度40%~70%。将SD大鼠随机分成4组,每组10只,分别为空白对照组、NAFLD组、CLA-TG组及微囊化CLA-TG组。CLA-TG推荐的人体摄入限量为每日4.5 g/60 kg·BW(成人),根据人-鼠体表面积折算给药剂量,将CLA-TG及微囊化CLA-TG分别分散于0.2%羧甲基纤维素钠(carboxymethyl cellulose sodium,CMC-Na)溶液中,二者剂量按摄入CLA-TG含量为0.375 g/kg配制。为排除灌胃操作及溶剂带来的干扰,将0.2% CMC-Na灌胃处理作为阴性对照。各剂量组均按5 mL/kg·BW给予灌胃。各组处理方式如下:空白对照组:基础饲料+0.2% CMC-Na灌胃;NAFLD组:高脂饲料+0.2% CMC-Na灌胃;CLA-TG组:高脂饲料+CLA-TG灌胃;CLA-TG微囊组:高脂饲料+微囊化CLA-TG灌胃。各组大鼠自由饮食。实验时间为6周,实验期间记录摄食量,并将血清生化指标及肝脏切片油红O染色结果作为造模成功的观测指标。试验结束后,记录体重,1%戊巴比妥钠[0.5 mL/(100 g·BW)]麻醉,腹主动脉取血5 mL并处死动物。血样留存分析,取肝脏洗净,取少量置于4%多聚甲醛固定,室温静置24 h,切片用于肝脏组织病理学研究,其余部分液氮速冻后置于-80 ℃冰箱中留存备用[7]。
1.3.2 生化指标检测
腹主动脉取血后,将血样在室温下自然凝固20 min,然后在4 ℃下以3 000 r/min离心15 min,离心后收集血清[8]。将大鼠肝脏组织在冰冷的生理盐水中匀浆,然后将匀浆物以3 500 r/min 在4 ℃下离心20 min。收集大鼠肝匀浆的上清液部分。制得10%的组织匀浆,血清与组织匀浆置于-80 ℃冰箱中保存待测。根据试剂盒的使用说明书测定大鼠血清或组织匀浆液中的谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterin,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)及甘油三酯(triglyceride,TG)含量[9]。
1.3.3 病理学检测
将多聚甲醛中固定的肝脏组织进行冰冻切片制备并用油红O染料染色。冰冻切片机切取15 μm的冰冻组织,将组织裱贴于载玻片,经油红O常规染色方法染色,随机选择样品在光学显微镜下观察并采集图像。肝细胞脂肪变的范围通过半定量进行评估。根据肝组织的腺泡结构测算脂肪变的肝细胞百分比:5%~33%为轻度脂肪变,34%~66%为中度脂肪变,>66%为重度脂肪变[10-11]。
1.4 数据处理与分析
实验中涉及的所有值均表示为mean±SD。数据间的比较使用单因素方差分析(ANOVA),然后进行student-newman-keuls(SNK)检验。本实验的所有实验结果代表至少3次独立实验。使用GraphPad Prism5.0(GraphPad Prism Software,La Jolla,CA)进行统计学分析。P<0.05 表示差异有统计学意义。
2 结果与分析
2.1 微囊化CLA-TG对NAFLD大鼠体重、体重增重、脂体比的影响
在高脂饮食诱导的NAFLD发展过程中,多伴随着肥胖的发生[12]。首先检测了该NAFLD模型是否引起肥胖。在整个实验周期内各组大鼠皮毛光泽度好,正常进食饮水,活动自如,对外界刺激反应迅速,无腹泻及死亡现象且均未出现异常行为。结果如表1所示,在第6周末,与空白组相比,NAFLD组大鼠的末期体重、体重增重、脂体比显著升高(P<0.01),分别升高13.7%、61.5%、42.7%,该结果与长期高脂饮食易导致肥胖发生的认知一致;CLA-TG组与NAFLD组对比,末期体重、体重增重及脂体比有了明显下降(P<0.05),分别下降了7.0%、25.1%、14.8%,且微囊化CLA-TG组大鼠有更好的减重、减脂效果,与NAFLD组相比,分别下降了9.3%、30.7%、17.0%。且在整个实验周期内,各组大鼠摄食量并没有明显差异(图1)。从以上结果可知,CLA-TG及微囊化CLA-TG能够在不影响摄食量的前提下缓解NAFLD引起的肥胖。
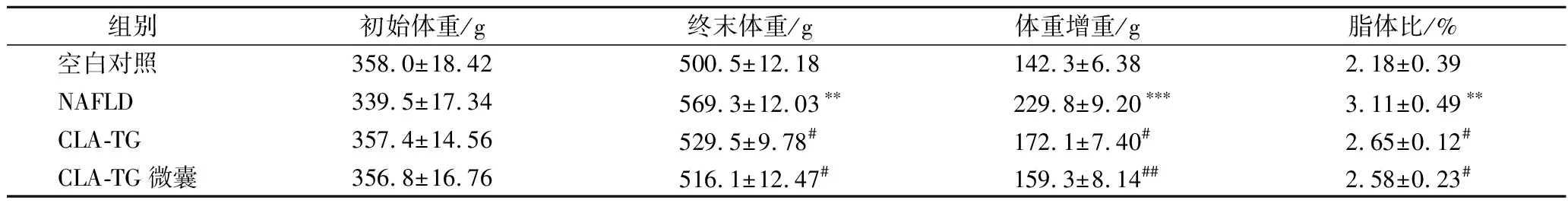
表1 CLA-TG及微囊化CLA-TG对大鼠体重、体重增重、脂体比的影响Table 1 Effect of CLA-TG and microencapsulated CLA-TG on the body weight, weight gain and fat-to-body ratio in rats
图1 CLA-TG及微囊化CLA-TG对大鼠总摄食量的 影响(n=10)Fig.1 Effect of CLA-TG and microencapsulated CLA-TG on the food intake in rats
2.2 微囊化CLA-TG对NAFLD大鼠血脂水平的影响
脂代谢紊乱是NAFLD患者的病理现象之一,主要表现为血脂的异常升高[6]。因此检测了大鼠血清血脂含量,如图2所示,NAFLD组大鼠与空白对照组相比LDL-C、TC、TG水平显著升高,分别从(0.357±0.07)、(1.45±0.11)、(0.71±0.33)mmol/L上升为(0.52±0.11)、(2.20±0.19)、(2.09±0.43)mmol/L,分别升高了45.7%、51.7%、194.4%,HDL-C水平显著下降(P<0.01),从(0.58±0.08)mmol/L降低至(0.50±0.05)mmol/L,下降13.8%。
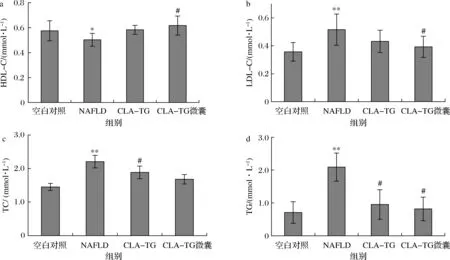
a-HDL-C;b-LDL-C;c-TC;d-TG图2 CLA-TG及微囊化CLA-TG对大鼠血清血脂水平的影响(n=10)Fig.2 Effect of CLA-TG and microencapsulated CLA-TG on the serum blood lipids levels in rats注:**与空白对照组相比有显著性差异(P<0.01);*与空白对照组相比有显著性差异(P<0.05);#与NAFLD组相比有显著性差异(P<0.05)(下同)
结果证明,在本研究中NAFLD模型大鼠血脂水平显著升高。CLA-TG组能够显著下调血清中LDL-C、TC、TG水平及上调HDL-C水平(P<0.05),分别为(0.43±0.08)、(1.88±0.19)、(0.95±0.45)、(0.58±0.04)mmol/L,分别下(上)调17.3%、14.5%、54.5%、13.8%,且CLA-TG微囊化处理后降血脂作用有所增强,LDL-C、TC、TG水平下调至(0.39±0.08)、(1.68±0.14)、(0.82±0.36)mmol/L,分别下调了25%、23.6%、60.8%,HDL-C水平上调至(0.62±0.08)mmol/L,上调24.0%。上述结果证明CLA-TG及微囊化CLA-TG的摄入能够缓解NAFLD引起的高血脂。
2.3 微囊化CLA-TG对NAFLD大鼠的血液生化指标的影响
血液中的ALT及AST是反映肝脏损伤的重要且敏感的生化指标[13]。因此,检测了血清中的ALT、AST含量以考察本实验中的大鼠肝损伤情况。如图3所示,NAFLD组大鼠ALT、AST与空白对照组相比有显著上升(P<0.001),分别从(33.90±12.03)、(18.40±9.22)U/L上升至(79.00±9.77)、(87.00±24.59)U/L,分别上133.0%、372.8%,提示本研究NAFLD模型引起了严重肝损伤。CLA-TG组能够显著下调血清中ALT、AST含量(P<0.05),分别下调至(59.10±20.56)、(61.44±20.11)U/L,下调比列分别为25.2%、29.4%,且微囊化CLA-TG组较CLA-TG组对以上血清学指标下调稍多,分别下调至(55.30±20.95)、(62.22±18.24)U/L,下调比例为30%、28.5%,证明CLA-TG及微囊化CLA-TG的摄入能够缓解NAFLD引起的肝损伤,且CLA-TG微囊化处理后效果优于CLA-TG。
2.4 微囊化CLA-TG对NAFLD大鼠的肝脏TG含量的影响
NAFLD疾病发展的起点为肝脏TG的累积[14]。为了进一步探究CLA-TG对NAFLD大鼠的肝脂肪变性情况,对肝脏中TG的累积进行了考察。实验结果如图4所示,NAFLD大鼠肝脏TG水平与基础饲料饲养组相比有显著上升(P<0.001),从(3.06±1.17)mmol/L上升至(5.23±1.16)mmol/L,增加了70.9%,在CLA-TG组及微囊化CLA-TG组中肝脏TG含量显著下调(P<0.05),分别下调至(3.99±0.80)、(3.79±0.95)mmol/L,下调比例分别为23.7%、27.5%,证明CLA-TG及微囊化CLA-TG的摄入能够降低NAFLD大鼠肝脏中TG累积,即证明CLA-TG及微囊化CLA-TG的摄入可能对NAFLD大鼠的肝脂肪变性具有一定的缓解作用。
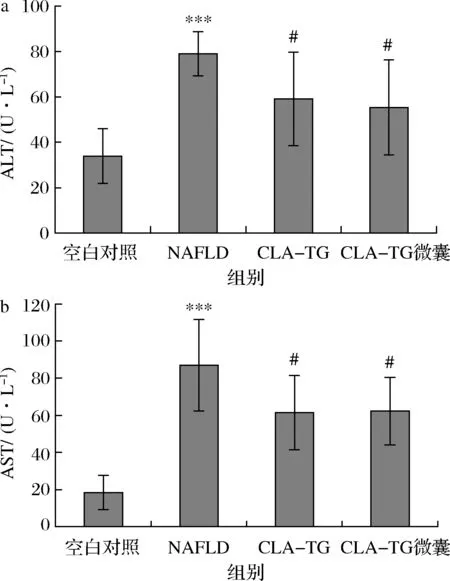
a-ALT;b-AST图3 CLA-TG及微囊化CLA-TG对大鼠血清ALT、AST 水平的影响(n=10)Fig.3 Effect of CLA-TG and microencapsulated CLA-TG on the serum ALT and AST levels in rats
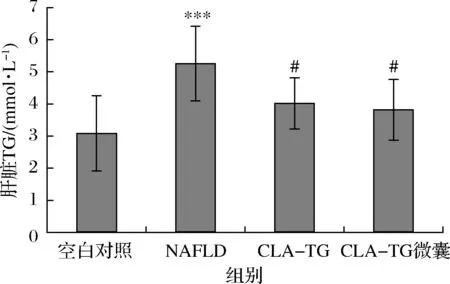
图4 CLA-TG及微囊化CLA-TG对大鼠肝脏TG 水平的影响(n=10)Fig.4 Effect of CLA-TG and microencapsulated CLA-TG on the liver TG levels in rats注:***与空白对照组相比有显著性差异(P<0.001)
2.5 微囊化CLA-TG对NAFLD大鼠肝脏脂滴积聚的影响
NAFLD的病变主要在肝小叶以肝细胞脂肪变性和脂肪贮积为主要病理特征[15]。因此采用油红O染色技术对肝脏切片进行脂滴染色,直观考察肝脏脂肪沉积情况[11]。如图5所示,与空白对照大鼠相比,NAFLD大鼠肝脏细胞中出现大量的脂滴积聚现象(P<0.01),油红O染色评分从(2.3±1.1)上升为(4.2±0.98),但在CLA-TG组并未显著缓解脂滴积聚现象,但在微囊化CLA-TG组,肝脏细胞中脂滴堆积情况有一定减轻(P<0.05),油红O染色评分降低为(2.7±1.1),证明CLA-TG微囊化后能够进一步减轻NAFLD大鼠肝细胞中脂滴堆积现象。
3 讨论与结论
NAFLD作为全球范围内发病率最高的一种肝脏代谢类疾病,发病机制复杂,迄今为止尚未完全阐明。目前在临床上,多选择对机体脂代谢具有调节作用的药物应用于NAFLD的治疗。其中,一些具有减轻体重或调节新陈代谢作用的功能性食品可能对于NAFLD的治疗起到重要作用。
CLA是亚油酸的一类同分异构体,常以c9t11和t10c12-CLA异构体形式存在,也是多种CLA异构体中具有生理活性的成分。研究报道,CLA具有减肥、降血糖、免疫调节、抗癌、抗动脉粥样硬化、抗氧化、抗过敏、改善骨质疏松等多方面生物学功能,目前广泛应用于减肥产品中[4, 16]。在NAFLD的发病机制中,较经典的理论为“二次打击”学说,该学说认为,机体首先产生胰岛素抵抗,抑制脂质过氧化,使肝内脂肪酸利用减少,导致肝脂肪变,包括肝脏过多脂肪积聚、脂代谢紊乱,使肝对外界刺激敏感性增加,形成“初次打击”。各种致病因素引发的氧化应激使反应性氧化物和脂质过氧化物增多,进而引起细胞炎性因子释放增加,促进肝细胞发展为炎症和病变坏死,形成“二次打击”[17]。研究报道,CLA具有抑制脂肪酸合成酶活性及胰岛素增敏作用,可通过改善线粒体功能,上调脂肪动员和分解相关酶的表达,影响脂肪酸的摄取和氧化及脂质的合成代谢,从而发挥减肥、降脂、降糖、改变脂肪酸组成等作用[18]。且CLA还可以缓解短期高果糖饮食诱导的NAFLD中肝脏扩大及肝糖原累积,改变肝内脂肪酸组成,下调新生脂肪合成基因的表达并改善血管内皮功能障碍[19]。因此,CLA在高脂饮食诱导的NAFLD的治疗中可能具有较好的应用前景,其作用机制可能与增加肝脏对胰岛素的敏感性、促进肝脂肪代谢、减少肝内脂肪合成、增强肝脏抗氧化能力有关。
但CLA在实际应用中,由于游离脂肪酸形式易氧化,性质不稳定、气味不好闻,因此常将其进行结构改造以提高其应用性。其中,CLA-TG是CLA的主要酯化形式,在保持CLA生理功能和营养功能的同时,增加脂溶性,具有稳定性更好、气味更平和、更易被吸收等优点,还可防止体内脂质累积[20]。目前CLA-TG属于新资源食品,可从红花籽油中提取,合成成本低,营养价值高。由于功能性脂肪酸特殊的分子结构,使其容易氧化、酸败,为了有效保护CLA-TG,避免遭受外界环境的破坏,同时也为了改变物质形态,提高应用性,使脂溶性的CLA-TG具有冷水分散性质,开发了CLA-TG的微囊乳液。微囊系指利用天然的或合成的高分子材料(统称为囊材)作为囊膜壁壳,将固态或液态活性成分包裹成的药库型微型胶囊,常以溶液、分散体或乳液的形式使用[21]。近年来,大量研究表明活性成分制成微囊后主要可以增加其稳定性,提高溶解度,掩盖不良臭味,防止在胃内破坏或对胃的刺激作用,延长作用时间达到缓释效果,提高生物利用度等[22-23]。基于上述理论基础,本研究在验证CLA-TG抗NAFLD功效基础上,进一步探究CLA-TG微囊化乳液通过提高生物利用度从而提升其疗效。
在肥胖群体中,NAFLD的患病率高于一般人群(25%~30%)[24]。大量研究证明,NAFLD与肥胖之间可能存在双向调节作用,即肥胖影响NAFLD的发生发展,NAFLD也可能通过多种机制加重肥胖,如引起肝功能障碍,肝缺血再灌注,氧化应激,加重糖毒性和脂毒性等[12, 25]。在本实验中,高脂饮食诱导的NAFLD大鼠体质量、体重增重增加,即诱发产生肥胖。同时引起血脂代谢紊乱,表现为血液中TC、TG及LDL含量显著上调,HDL含量显著下降。在给予CLA-TG及微囊化CLA-TG处理后,在显著减轻NAFLD大鼠体重基础上,进一步降低了血液中上调的TC、TG及LDL水平,升高了HDL,减轻高血脂症状。因此,本实验验证了CLA-TG或微囊化CLA-TG的摄入对NAFLD大鼠的肥胖现象可起到调节作用,且CLA-TG微囊化后对体重及血脂的调节作用进一步提升。
除肥胖外,在NAFLD患者中大多存在5%~10%的肝脂肪变性[26]。其原因在于NAFLD患者的脂肪细胞存在功能障碍和胰岛素抵抗,导致脂解作用加速和皮下脂肪组织中脂肪酸吸收减少,引起循环中产生过量的游离脂肪酸,形成异位脂肪积聚(如肝脏、骨骼肌等),产生脂毒性[25]。在该条件下,肝细胞则发挥脂肪细胞样功能的作用,但肝细胞缺乏处理过量游离脂肪酸的能力,因此过量的脂质则以TG的形式存储在肝细胞中,导致肝脂肪变性。TG在肝脏中衍生的有毒代谢产物异位积累,激活肝内炎症反应,引起细胞功能障碍,导致肝细胞脂凋亡,最终形成非酒精性脂肪肝炎[27-29]。因此,肝脂肪变性的发生被广泛认定为NAFLD病程的起点,最终导致了可逆或不可逆性肝损伤。在本研究中,首先通过检测血清转氨酶含量来考察肝损伤情况,高脂饮食诱导的NAFLD大鼠模型表现出了显著的ALT、AST上调,即严重的肝损伤,而CLA-TG及微囊化CLA-TG干预后,大鼠 ALT、AST水平降低,说明在本研究所述NAFLD中,CLA-TG具有修复肝损伤、改善肝功能的作用。进一步通过对肝脏组织中TG含量的检测,发现在高脂饮食诱导的NAFLD模型中,出现了显著的肝脏TG累积,而CLA-TG及微囊化CLA-TG的摄入显著降低模型组中的TG累积。根据对肝脏组织切片进行油红O染色,直观地对肝脏脂滴观察,结果表明微囊化CLA-TG能抑制NAFLD大鼠肝脏中的脂滴积聚,该现象可能与CLA-TG微囊化后可通过促进其吸收,提高生物利用度有关。综上所述,CLA-TG能够缓解NAFLD引起的肝脏损伤,且CLA-TG微囊化后可能具有更好的缓解作用。
综上所述,本研究所得结论如下:CLA-TG或微囊化CLA-TG能够在不影响摄食量的前提下降低高脂饮食诱导的NAFLD大鼠的体重,降低血脂,同时减轻高脂饮食引起的非酒精性脂肪肝损伤。还验证了微囊化的CLA-TG可能具有更好的缓解作用。但仍需要进一步探寻CLA-TG对NAFLD缓解功效的作用机制。总而言之,本研究提供CLA-TG在减肥及缓解高脂饮食引起的脂肪肝方面的应用,并验证了CLA-TG微囊化后作用有较明显的增强,为开发安全有效的减肥产品及治疗脂肪肝的食品、保健品及药品提供数据支持。

