二氧化硫对蓝莓酒发酵动力学及品质变化的影响
荆红彭,刘明,陈晓明*,郭丰利,郭意如*
1(天津市农业科学院 农产品保鲜与加工技术研究所,天津,300384)2(国家农产品保鲜工程技术研究中心(天津), 农业农村部农产品贮藏保鲜重点实验室,天津市农产品采后生理与贮藏保鲜重点实验室,天津,300384) 3(天津多吉果酒工程技术有限公司,天津,301723)
蓝莓酒是将蓝莓鲜果或冻果经过破碎、发酵、陈酿等工艺酿制而成的发酵酒[1-2],在人们普遍注重营养健康的时代,消费者对具有低酒精度、保留蓝莓果的特有香气和天然营养成分的蓝莓酒需求量在增加[3-4]。在蓝莓酒的发酵前期通常会添加适量的SO2来抑制杂菌生长繁殖和延缓果酒中多酚、单宁、色素等物质的氧化[5-7]。商业酿酒酵母最高可抗25 mg/L的游离SO2,添加50 mg/L的SO2约有50%变为游离SO2,50 mg/L的SO2添加量不会对酿酒酵母有抑制作用,同时可有效防止果汁的氧化[8]。前人研究均发现在发酵液中添加50 mg/L的SO2酿造出的蓝莓酒花青素含量更高,综合感官分值最高[9-11]。
在发酵基质中添加的SO2除了以游离态的形式存在外,还会和糖、乙醛、色素等不同物质结合以结合态的形式存在,2种形态的SO2以不同方式影响着蓝莓酒的发酵进程和理化、感官指标[12]。随着发酵时间的延长,微生物发酵产物形成、底物消耗,可以采用数学建模的方法来研究发酵期间酒精生成和总糖消耗的动态平衡和内在规律。有学者分别应用不同模型研究了山葡萄酒、黑加仑果酒、沙棘果酒在发酵过程中发酵动力学的变化规律,通过非线性模拟建立了果酒的发酵动力学模型[13-15]。
目前在蓝莓酒酿造期间存在着SO2带来的不确定因素,其对发酵过程本身品质影响的研究还不够深入,同时尚未发现SO2对蓝莓酒发酵过程中酒精生成、糖基质消耗等发酵动力学影响的研究。本试验采用经典的DoseResp模型、Boltzmann模型、logistic模型对蓝莓酒发酵过程中酒精度和总糖含量的变化进行非线性拟合,建立蓝莓酒发酵动力学模型。同时对发酵期间蓝莓酒的总酸、挥发酸、干浸出物、总SO2含量进行测定,并对不同陈酿时期的蓝莓酒做感官评定,探究50 mg/L的SO2添加量对蓝莓酒品质的影响,以期为蓝莓酒生产中发酵环节的精准控制提供理论基础。
1 材料与方法
1.1 试验材料
蓝莓冻果,江苏万新蓝莓种植园;F33型葡萄酒活性干酵母、Clarification果胶酶,法国拉福德公司;Enartis Winy K2S2O5,意大利爱赛科有限公司;木棉花白砂糖,广西东门南华糖业有限责任公司;CuSO4、酒石酸钾钠、NaOH、无水葡萄糖、碘等试剂皆为分析纯,天津市风船化学试剂科技有限公司。
1.2 试验设备
AS 220.X2(教育版) 1/10000分析天平,波兰瑞戈威电子衡器有限公司;DHP—120型电热恒温培养箱,天津市中环实验电炉有限公司;小型304不锈钢发酵桶、陈酿罐,天津市津乐金属制品有限公司。
1.3 试验方法
1.3.1 蓝莓果酒酿造工艺
蓝莓→选果→清洗→破碎打浆→酶解→成分调整→发酵→除酒脚→陈酿
1.3.2 试验方案设计
称取100 kg优质蓝莓冻果,均分成2份,在20 ℃室温环境下化冻24 h后进行破碎打浆处理,将蓝莓果浆分别置于2个小型不锈钢发酵桶内,加入发酵液总体积0.003%的Laffort-Clarification果胶酶、0.02%的F33酵母(使用前进行活化:将10倍酵母质量的发酵液升温到35~40 ℃,干酵母倒入后轻轻搅拌使其无结块,静置15 min),EG处理组在添加酵母的同时加入相当于质量浓度为50 mg/L的SO2水溶液(1 gEnartis Winy K2S2O5可以产生约0.56 g的SO2),CG组不做处理作为对照。在18~25 ℃下进行控温发酵,每12 h对发酵桶摇匀1次,每2 d取适量发酵液测定蓝莓酒的理化指标,并进行1次感官评定,具体样品处理方法见表1。

表1 样品处理方法Table 1 Sample processing methods
1.3.3 检测方法
1.3.3.1 理化指标
乙醇含量、残糖浓度、总酸(滴定酸)浓度、干浸出物含量、挥发酸浓度、总SO2含量均按照国家标准GB/T 32783—2016《蓝莓酒》规定执行。
1.3.3.2 感官评价
参照文献[16-17]的方法,由有果酒品尝基础的10名研究人员分别对发酵结束后、陈酿3个月、陈酿6个月的蓝莓酒样进行品评(CG和EG处理组随机编号),从色泽、光泽度、澄清度、香气、典型性、酸味、持久性、整体平衡感8个方面采用十点强度量化进行感官评价,结果用感官分析雷达图进行展示。
1.4 数据处理
每组试验进行3次重复,采用Origin 2017进行作图分析,选取适合的模型对发酵液乙醇含量、残糖含量进行非线性拟合。
2 结果与分析
2.1 蓝莓果酒发酵动力学模型
2.1.1 酒精生成动力学模型
由表2可知,3种模型对酒精生成情况进行拟合,对CG组模拟效果最好的是DoseResp模型和Boltzmann模型,判定系数均为0.999 17,能够较好地反应对照组酒精生成的情况;而logistic模型对EG组拟合效果最好,R2=0.999 75。此时CG组判定系数为0.997 52,远远低于其他2组模型,所以综合选取DoseResp模型和Boltzmann模型对蓝莓酒发酵过程酒精生成情况进行定量描述,拟合曲线图由图1和图2所示。

表2 酒精生成的拟合方程及其拟合优度Table 2 Fitting equation of alcohol formation and its goodness of fit
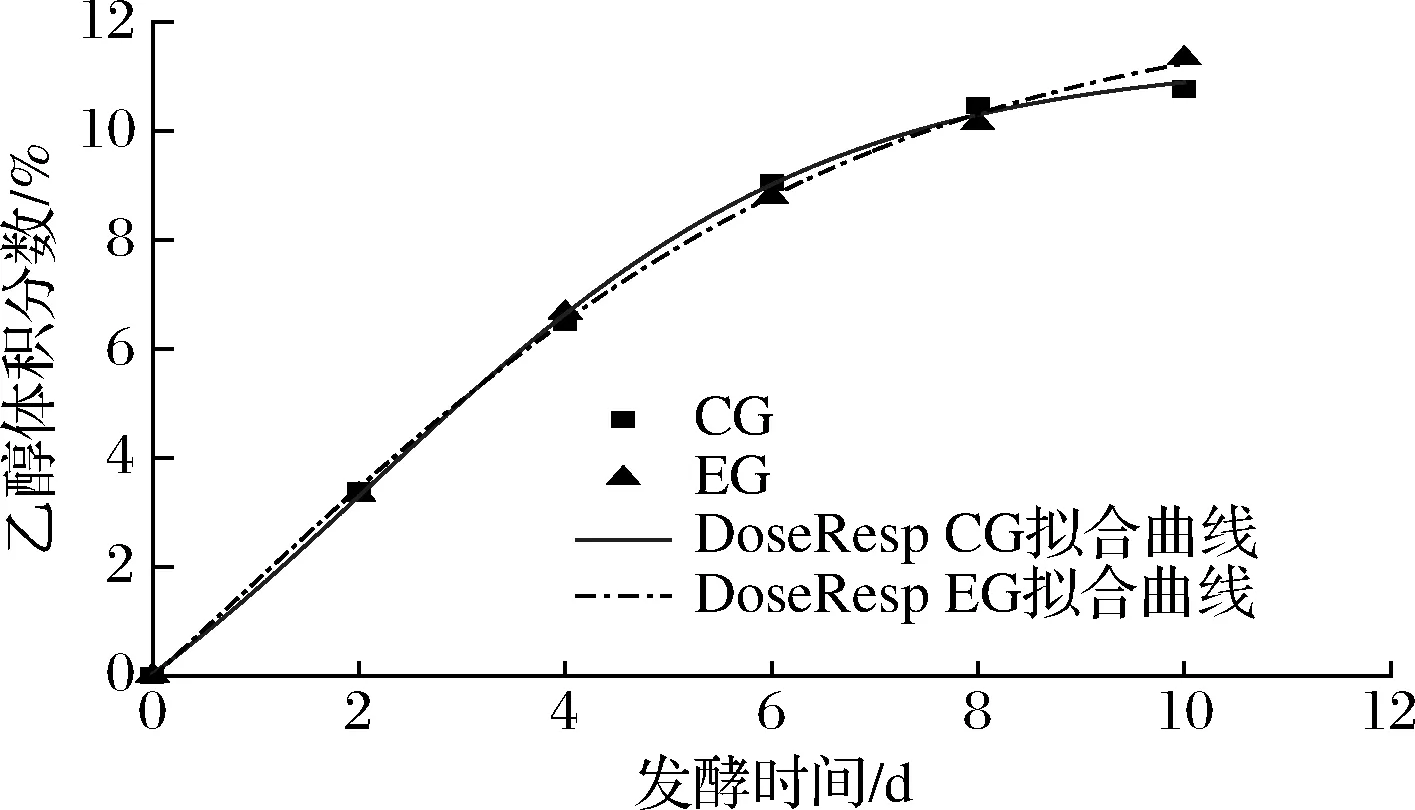
图1 DoseResp模型酒精生成拟合曲线Fig.1 Fitting curve of alcohol formation in DoseResp model
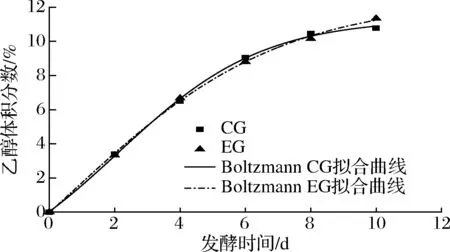
图2 Boltzmann模型酒精生成拟合曲线Fig.2 Fitting curve of alcohol formation in Boltzmann model
2.1.2 总糖消耗(残糖)动力学模型
由表3可得,与酒精生成拟合效果类似,DoseResp模型和Boltzmann模型均能较好表明总糖在发酵过程的消耗情况,CG组和EG组判定系数分别为0.980 02和0.995 48。故选用DoseResp模型和Boltzmann模型对蓝莓酒发酵过程总糖消耗情况进行定量描述,拟合曲线如图3和图4所示。EG组残糖含量下降速度较CG组快,结合酒精生成曲线可知:发酵液中添加50 mg/L的SO2对蓝莓酒的发酵进程无显著影响。
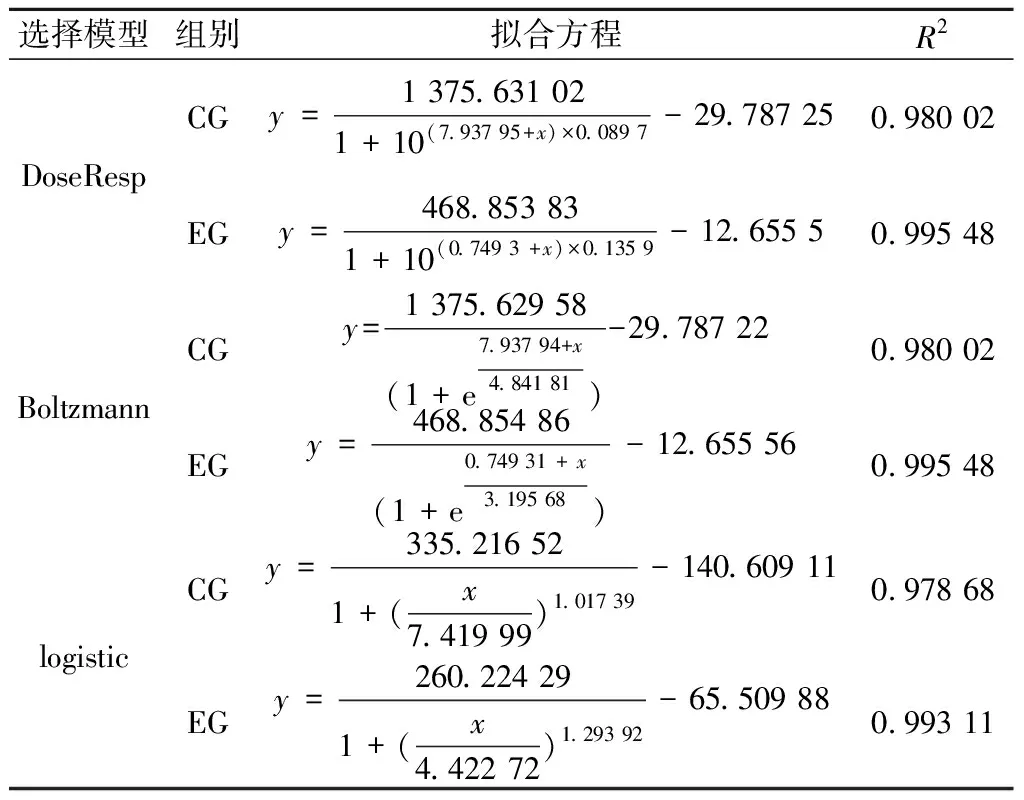
表3 总糖消耗的拟合方程及其拟合优度Table 3 Fitting equation of total sugar consumption and its goodness of fit
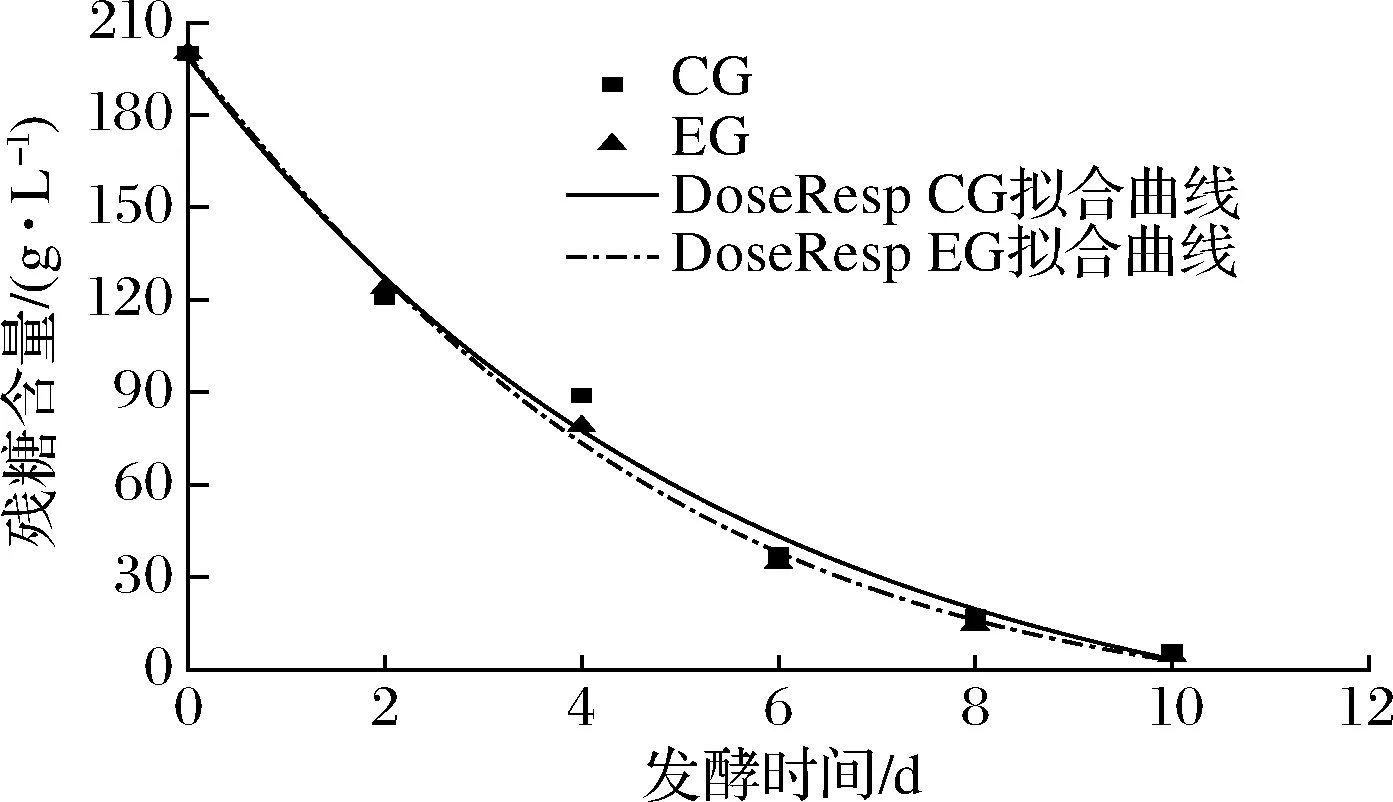
图3 DoseResp模型总糖消耗拟合曲线Fig.3 Fitting curve of total sugar consumption in DoseResp model
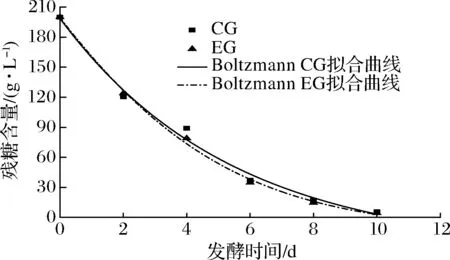
图4 Boltzmann模型总糖消耗拟合曲线Fig.4 Fitting curve of total sugar consumption in Boltzmann model
2.2 总酸(可滴定酸)含量的变化
蓝莓酒中总酸(可滴定酸)含量一般以柠檬酸计,在发酵过程中总酸(可滴定酸)含量变化如图5所示。0~2 d CG组和EG组的总酸含量几乎没有增长,CG组2 d的总酸值较EG组高0.2 g/L,2~6 d总酸含量显著升高,4 d开始进入增长迟缓期,6 d后总酸含量趋于稳定,CG和EG总酸值分别为6.2、6.0 g/L。在发酵过程中CG组总酸含量均高于EG组,2组数据总体方差显示P=0.777 86,说明SO2的添加对蓝莓酒总酸无显著影响(P>0.05),这与刘彩婷等[9]采用50 mg/L的SO2对蓝莓酒总酸含量的影响结果相似。
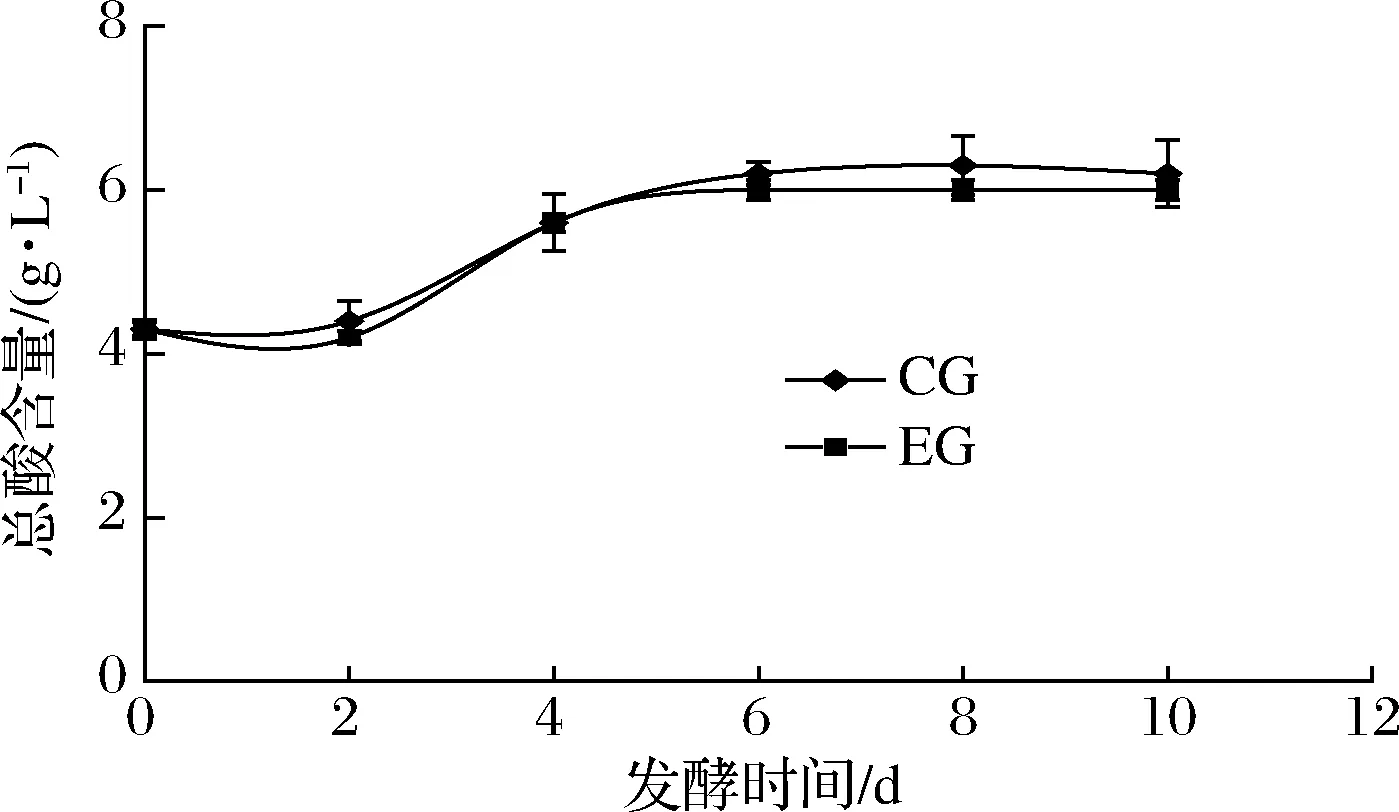
图5 蓝莓酒发酵期间总酸(可滴定酸)含量的变化Fig.5 Changes of total acid (titratable acid) content during fermentation of blueberry wine
2.3 可挥发性酸含量的变化
从图6可以看出,0~2 d CG组与EG组的挥发酸含量均呈明显上升趋势,CG组2~10 d的挥发酸值在缓慢得增长,10 d达到0.35 g/L,EG组2~8 d的挥发酸值一直保持在0.20 g/L,10 d增长为0.24 g/L。可见,添加SO2对蓝莓酒发酵期间挥发酸的生成有抑制作用,这与陈祖满[18]研究的蓝莓酒发酵过程中挥发酸含量的变化趋势一致。
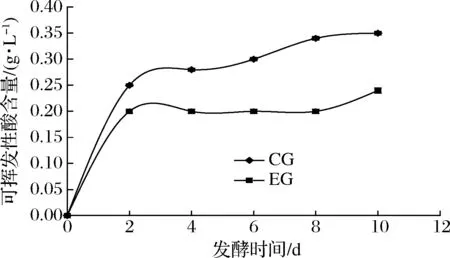
图6 蓝莓酒发酵期间挥发酸含量的变化Fig.6 Changes of volatile acid content during fermentation of blueberry wine
2.4 干浸出物含量的变化
由图7可知,CG组 0~2 d的干浸出物含量随发酵时间的延长有上升的趋势,2 d有明显下降的趋势,4~8 d缓慢上升,从8 d开始明显下降,直到10 d达到终点,期间2 d干浸出物含量达到最高值33.5 g/L,10 d干浸出物含量最低,为18.3 g/L;EG组干浸出物含量变化呈波浪式变化,0~2 d干浸出物含量明显下降,2~4 d干浸出物值从20.8增长至26.3 g/L,4~6 d呈下降趋势,8 d EG组干浸出物含量为27.1 g/L,与CG组差别不大,10 d干浸出物含量为17.3 g/L。2 d CG组和EG组干浸出物差值最大,这可能是因为发酵初期SO2的存在结合了发酵液中一部分非挥发性物质,并在蒸馏期间挥发出来。两组的干浸出物含量均呈波浪式趋势变化,这可能与发酵液中固形物、挥发性成分呈动态变化有关。
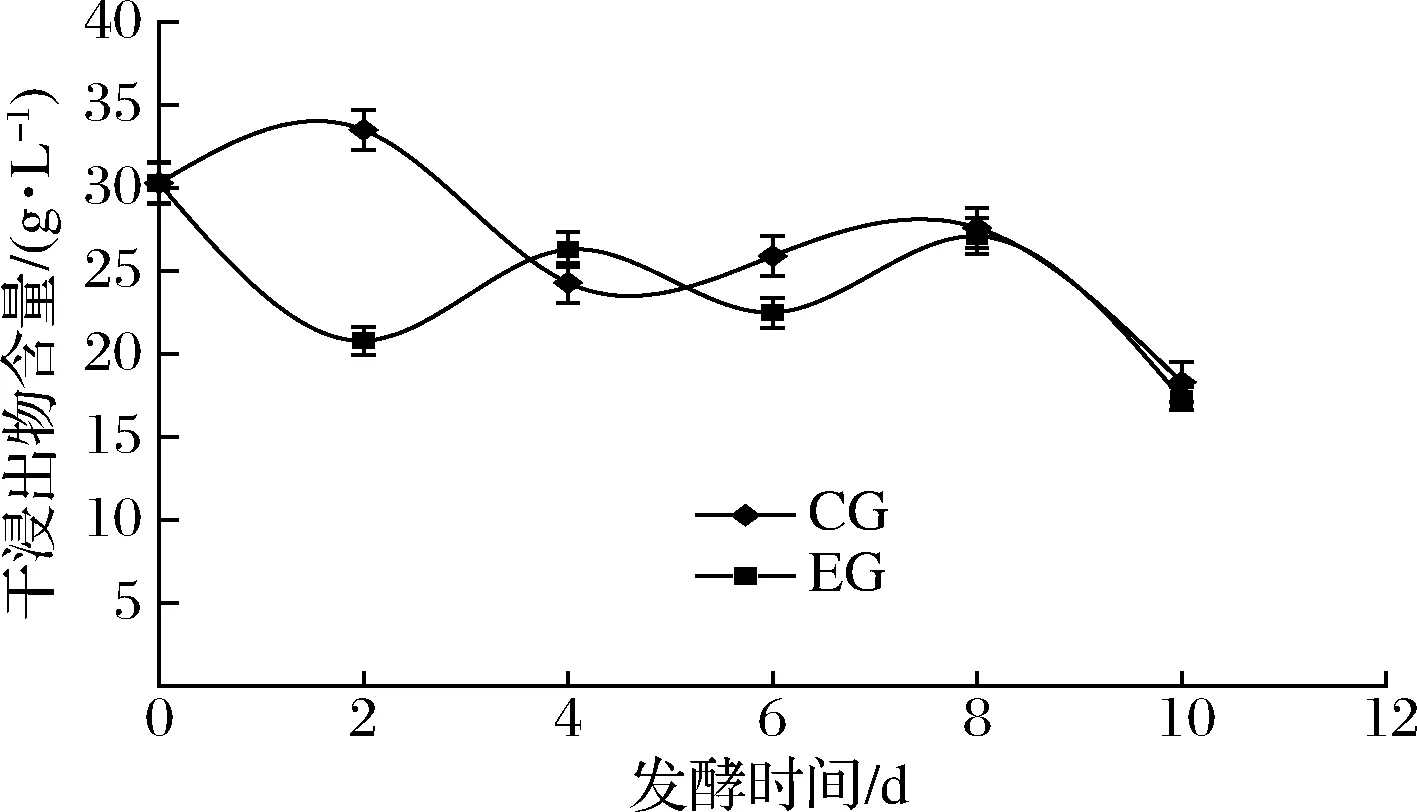
图7 蓝莓酒发酵期间干浸出物含量的变化Fig.7 Changes of dry extract content during fermentation of blueberry wine
2.5 总SO2含量的变化
由图8可知,EG组2 d内发酵液的总SO2质量浓度升至76 mg/L,并随着发酵时间的延长逐渐呈下降趋势,10 d发酵结束时总SO2质量浓度为60 mg/L。CG组的总SO2含量随发酵时间的延长有先增高后降低的趋势,6 d升至最高值35 mg/L,10 d降至20 mg/L。从试验数据看,CG组在未加K2S2O5的情况下总SO2值也在升高,这可能与蓝莓果采摘后用一定量的SO2或SO2制品来防腐保鲜有关[19]。分子态SO2一部分在打循环时被产生的CO2气体带出发酵罐,一部分继续变成结合态SO2,在发酵后期EG和CG组总SO2含量均呈下降趋势,这与牟京霞等[12]的研究结果相似。
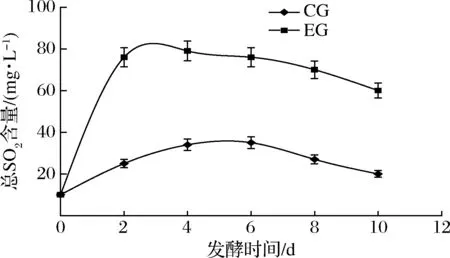
图8 蓝莓酒发酵期间总SO2含量的变化的影响Fig.8 Changes of total SO2 content during fermentation of blueberry wine
2.6 感官指标的变化
由图9-a所示,发酵结束后的蓝莓酒酸感最强,澄清度较差,整体平衡感弱,EG组因为添加SO2的缘故色泽稍浅,香气不如CG组浓郁,有些许“硫臭味”,平衡感较CG弱,但光泽度稍好。陈酿3个月的感官雷达图如图9-b所示,CG组和EG组整体上差别不大,EG组光泽度较CG对照组好。陈酿6个月EG组色泽、光泽度、典型性要优于CG组(图9-c)。由图9可以看出,随着陈酿时间的延长,蓝莓酒的澄清度变高,典型性和整体平衡感变强,酸感减弱,香气、持久性、基本无明显变化。这与刘彩婷等[9]、SUN等[20]的结果类似。添加SO2会使发酵结束后的蓝莓酒颜色衰褪,但在陈酿期间颜色也基本保持不变,这与LI等[21]的研究结果一致。CG组酒体抗氧化能力弱,酒体颜色由发酵结束后的紫黑色变为紫红色。
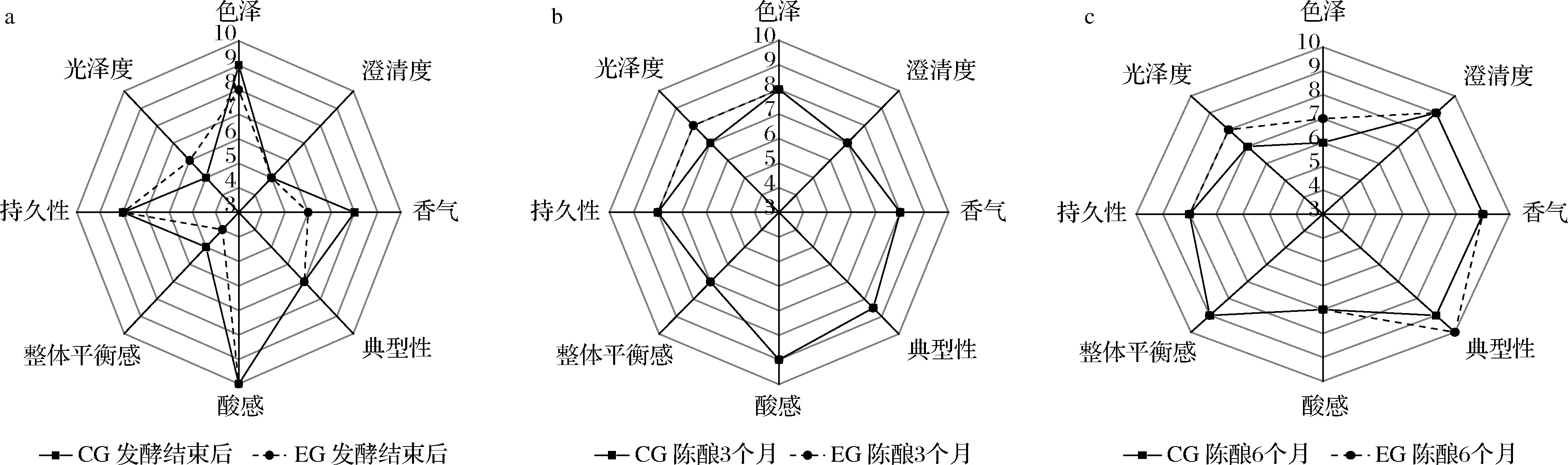
a-发酵结束后;b-陈酿3个月;c-陈酿6个月图9 蓝莓酒感官分析雷达图Fig.9 Sensory analysis radar map of blueberry wine
EG组发酵结束后的香气感官值较差,但随着陈酿的进行,香气值与CG组相同。综上可知,添加SO2虽然对蓝莓酒发酵结束后的颜色、香气造成一定影响,但在后期陈酿阶段有利于酒体颜色的保持,香气也随着酒中SO2量的减少而变得浓郁、怡人。
3 结论与讨论
世界范围内对于在果酒酿造中添加SO2一直争议不断,目前有一些果酒、葡萄酒酒厂在尝试用一些方法代替添加SO2,如:用澄清剂吸附酚类物质或添加抗氧化剂或天然抗氧化提取物来避免酒体氧化,但这种处理会对酒的香气和典型性有影响;控制酒与氧气的接触,在酒倒罐和处理时进行惰性气体保护,这无疑增加了操作的复杂性和酿酒成本;添加壳聚糖、防腐剂、多肽类来抑制杂菌还处于试验阶段,并未在生产中广泛应用。综上,目前在果酒规模化生产中SO2依然是不可或缺的食品添加剂。
本研究应用DoseResp模型和Boltzmann模型建立了有SO2参与的蓝莓酒发酵过程中酒精生成和残糖消耗的发酵动力学模型,综合试验数据及分析可知,50 mg/L的SO2对蓝莓酒的发酵进程总酸(可滴定酸)浓度、干浸出物含量无显著影响,能将酒中挥发酸含量从0.35降至0.24 g/L。发酵结束的酒体颜色稍浅、有少许“硫臭味”,但在陈酿阶段能够保持较稳定的酒体颜色,香气也随着游离SO2的消耗而逐渐变得浓郁、怡人。研究结果为酿酒师在蓝莓酒发酵阶段使用SO2提供了参考,目前研究还局限于小试阶段,工业化生产还需要综合考虑发酵液的pH值与硫平衡、SO2与原花色素是否结合等诸多因素。

