一株分解海参体壁蛋白的耐盐菌株的筛选及发酵条件优化
韩爽,刘奎,张健,井月欣,王艺欣,刘芳,王共明,刘海超,钟静诗
1(上海海洋大学 食品学院,上海,201306)2(山东省海洋资源与环境研究院,山东 烟台,264006)
海参体壁是海参主要食(药)用部位,其蛋白含量非常丰富。研究发现,海参体壁蛋白中约70%为胶原蛋白[1],由于其包裹作用,海参中营养物质难以被消化吸收,降解后的海参多肽易吸收且具有抗氧化[2]、抗疲劳[3]、抗菌、抗肿瘤[4]等活性。同时,随着海参蛋白的降解,与胶原纤维连接的其他营养成分得以释放。以海参主要功能成分之一——岩藻糖基化硫酸软骨素为例,沿胶原纤维以共价O-糖苷键与之结合,呈环状周期性分布[5],降解胶原纤维后有助于其释放。
生物酶解法及微生物发酵法具有作用条件温和、无有毒物质残留及操作易控制等优点[6],是目前较为普遍采用的蛋白降解方法[7]。由酶解及微生物发酵进行蛋白降解可以提高其生物活性及消化率,同时会改善感官品质[6],提升产品鲜味[8]。但目前用于海参蛋白降解的酶及微生物多为普通食品商业酶[9-10]及菌株,缺乏针对性,易造成水解不完全等问题,故多采用复配酶[11]及酶解发酵联用[12]的方法以提高海参蛋白降解水平。由于鲜海参难以储存,为延长其储存期,90%左右的海参都经过盐渍处理[13],但目前通用型商业酶及微生物耐盐性低,因此降解前需将海参进行脱盐处理。而相关研究发现,海参在脱盐过程中会造成蛋白、多糖及特征性风味物质的损失[14],且会破坏其组织形态[13]。通过筛选可直接分解海参蛋白的耐盐菌株可为发酵法提供备选微生物,进而促进相关蛋白酶资源的开发。
为筛选得到可在高盐环境下直接进行海参蛋白分解的微生物菌株,本实验采用以海参蛋白作为唯一氮源的马丁氏培养基(高盐), 筛选得到3株可直接降解海参蛋白的海水源菌株。通过对3株菌发酵海参蛋白能力的比较,选定降解能力最强的1株菌进行发酵条件优化,并与4株常见商业发酵菌对比,记录72 h发酵过程中发酵液的菌体浓度、pH以及水溶性蛋白含量的动态变化。通过研究,获得了可在高盐环境下进行海参蛋白直接分解的微生物菌株及其最佳发酵条件,为未来相关商业菌株及酶的开发提供基础数据支持。
1 材料与方法
1.1 材料与设备
1.1.1 主要材料
盐渍仿刺参,烟台市开发区八角海鲜市场;链霉素(生化试剂),美国Sigma-Aldrich;Lowry蛋白浓度测定试剂盒,北京索莱宝科技有限公司;Ezup柱式真菌基因组DNA 抽提试剂盒、SanPrep 柱式DNA胶回收试剂盒、SanPrep 柱式 DNA 胶回收试剂盒,生工生物工程(上海)股份有限公司;Taq Plus DNA聚合酶、琼脂糖B、4S Red Plus核酸染色剂(10 000×水溶液),BBI生命科学有限公司;API Staph,生物梅里埃法国股份有限公司;葡萄球菌乳胶凝集试剂盒,赛默飞世尔科技公司。
1.1.2 主要设备
XHF-DY 高速分散器,宁波新芝生物科技股份有限公司;MQL-61R立式全温振荡培养箱,上海旻泉仪器有限公司;Kjeltec8400凯氏定氮仪,丹麦Foss公司;SevenCompact pH计、ME204E 电子天平,梅特勒-托利多仪器(上海)有限公司;BSP-100F生化培养箱,沙鹰科学仪器(上海)有限公司;5430R离心机,德国Eppendorf公司。
1.2 实验方法
1.2.1 海参匀浆液制备
取盐渍仿刺参200 g,置于1 L烧杯中,加纯水800 mL没过海参,在4 ℃冰箱中浸泡12 h后取出,去除口环后清洗并称质量,记为m1,加纯水1 L并煮40 min。将煮制完成的海参及煮液一起倒入1 L烧杯中并续水至800 mL,放4 ℃冰箱浸泡6 h后,加纯水1 L,复煮40 min。然后以m1∶m[纯水(含蒸煮液)]=1∶5的比例向含海参的煮液中补充加入纯水,剪碎海参后用高速分散器匀浆,制得海参匀浆液。
1.2.2 培养基设计
1.2.2.1 固体马丁氏培养基(高盐)的制备
参考文献[15]中固体马丁氏培养基配方并加以改进。葡萄糖10 g,KH2PO41 g,MgSO4·7H2O 0.5 g,1/3 000虎红钠盐溶液100 mL,海参匀浆液500 mL,海水300 mL,琼脂粉27 g,pH自然,121 ℃灭菌20 min,用前加入0.03%链霉素稀释液100 mL,采用SC/T 3011—2001《水产品中盐分的测定》中的方法测定培养基盐浓度。
1.2.2.2 液体马丁氏培养基(高盐)的制备
参考1.2.2.1中固体马丁氏培养基的制备,去除琼脂粉的添加。
1.2.3 菌株的筛选纯化
将未稀释海水和稀释至10-2和10-4的海水分别取100 μL涂布于固体马丁氏培养基(高盐)中。将培养后长出的单个菌落多次划线纯化保存备用。
1.2.4 纯化菌株分解海参蛋白效果比较
1.2.4.1 种子液及发酵液的制备
分别从上述筛菌固体培养基中挑取1环纯化菌株,接入盛有3 mL种子培养基的试管中,28 ℃、200 r/min摇床振荡培养制成种子液。当OD600=1时,将上述种子液转入摇瓶中(250 mL三角瓶中装液体马丁氏培养基100 mL),在28 ℃、200 r/min摇床振荡培养72 h[16]即得发酵液。
1.2.4.2 液态培养基及发酵液中水溶性蛋白含量的测定
参照GB/T 5009.5—2016《食品中蛋白质的测定》方法中凯氏定氮法,将液态培养基及发酵液7 800 r/min离心10 min后,取上清液进行蛋白含量的测定。
1.2.5 菌株的鉴定
1.2.5.1 菌株形态学及生理生化特征鉴定
将纯化的菌株接种于固体马丁氏培养基上,26 ℃倒置培养24 h,观察菌落形态并进行革兰氏染色,于油镜下观察菌体形态特征,再挑取新菌落处理后进行扫描电镜观察。参照《伯杰氏细菌鉴定手册》[17]并利用试剂盒分析菌株的生理生化特征。
1.2.5.2 菌株分类的分子生物学鉴定
使用Ezup 柱式基因组DNA抽提试剂盒提取分离菌株基因组DNA。以提取的细菌DNA为模板, 以引物27F/1492R进行PCR扩增,PCR扩增条件:95 ℃,5 min;94 ℃,30 s;57 ℃,30 s;72 ℃,90 s;72 ℃,8 min;30个循环。取3 μL PCR产物经1.5%琼脂糖凝胶凝胶电泳,将PCR产物进行16S rDNA测序,将所得特定序列在NCBI上通过BLAST程序进行菌株同源性对比[18],最后用MEGA X 10.0.2软件构建系统发育树。
1.2.5.3 菌株致病性鉴定
利用葡萄球菌乳凝胶试剂盒对SW03进行常见致病性的检验。在检测板上加测定试剂及菌株SW03,若2 min 内出现凝集,表明测试菌落为金黄色葡萄球菌或其他具有凝固酶或A蛋白的葡萄球菌。
1.2.6 SW03最优发酵工艺的确定
1.2.6.1 单因素试验
通过预试验确定发酵温度、培养基初始pH及接种量3个单因素的水平分别为:发酵温度为24、26、28、30、32 ℃;培养基初始pH为5、6、7、8、9;接种量为1%、3%、5%、7%、9%,其余条件与1.2.4.1相同,每个水平重复3次,结果取平均值。发酵液7 800 r/min离心10 min后取上清液,利用Lowry蛋白浓度测定试剂盒进行水溶性蛋白含量测定。
1.2.6.2 响应面试验设计
在单因素试验的基础上,以水溶性蛋白含量为响应值,采用Box-Behnken设计3因素3水平试验[19],因素编码和水平如表1所示。
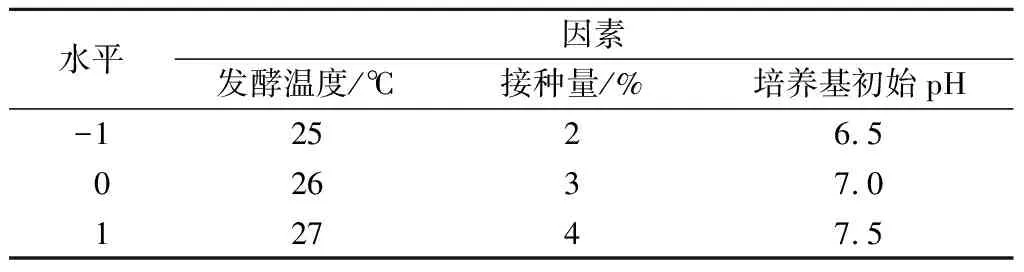
表1 Box-Behnken设计因素及水平表Table 1 Experimental factors and levels of Box-Behnken design
1.2.7 SW03及4株商业菌株发酵过程中的动态变化
1.2.7.1 SW03及4株商业菌株生长曲线的测定
SW03及枯草芽孢杆菌(Bacillussubtilis)、解淀粉芽孢杆菌(Bacillusamyloliquefaciens)、植物乳杆菌(Lactobacillusplantarum)、肠膜明串珠菌(Leuconostocmesenteroides) OD600 nm=1的菌液6 mL接种于200 mL马丁氏液体培养基中, 在各菌株最适生长条件下培养0、6、12、18、24、30、36、42、48、54、60、66、72 h, 每个时间段重复 3次。以空白马丁氏液体培养基为对照,测定不同菌株各时间段OD600 nm值。以菌株培养时间为横坐标,以OD600 nm值为纵坐标绘制各菌株生长曲线。
1.2.7.2 发酵过程中pH及水溶性蛋白含量的变化
参照1.2.7.1中培养及接种方法,培养0、1、2、3、4、5、6、12、18、24、30、36、42、48、54、60、66、72 h,每个时间段重复3次。以空白马丁氏液体培养基为对照,测定不同菌株各时间段pH及水溶性蛋白含量。以菌株培养时间为横坐标,以pH和水溶性蛋白含量为纵坐标绘制曲线。
1.2.8 数据处理
2 结果与分析
2.1 菌株筛选及蛋白含量的测定
经测定,改良后的马丁氏培养基盐质量分数为(2.5±0.1)%。利用马丁氏培养基,从海水中分离纯化得到3株可分解海参蛋白的菌株SW01、SW02和SW03。对上述菌株所得发酵液及未发酵培养基的离心上清液中蛋白含量的测定结果如表2所示。SW03对海参蛋白的分解效果最佳,因此后续研究围绕菌株SW03展开。

表2 未发酵培养基及发酵液中水溶性蛋白含量 单位:g/kg
2.2 菌株形态学及生理生化特征
SW03菌株为革兰氏阳性菌,菌落橙黄色、湿润,菌落直径为(0.15±0.003)cm。菌落呈圆形,表面光滑,边缘整齐,中间凸起(图1-a);菌体呈球状,大小为8.5~9 μm(图1-c),革兰氏阳性(图1-b)。利用API Staph试剂盒测定的生理生化特征结果见表3。将所得结果与菌种库进行对比后发现,无与该菌株匹配的具体种,也与常见的葡萄球菌致病菌的生理生化指标不符。致病性葡萄球菌一般菌体大小在0.5~1 μm,且利用凝胶试剂盒进行测定时会出现凝集现象[20]。SW03相对致病菌菌体更大,且在常见葡萄球菌的致病性检测中未出现凝集现象,检测结果呈阴性,由此初步推测,菌株SW03不具致病性。
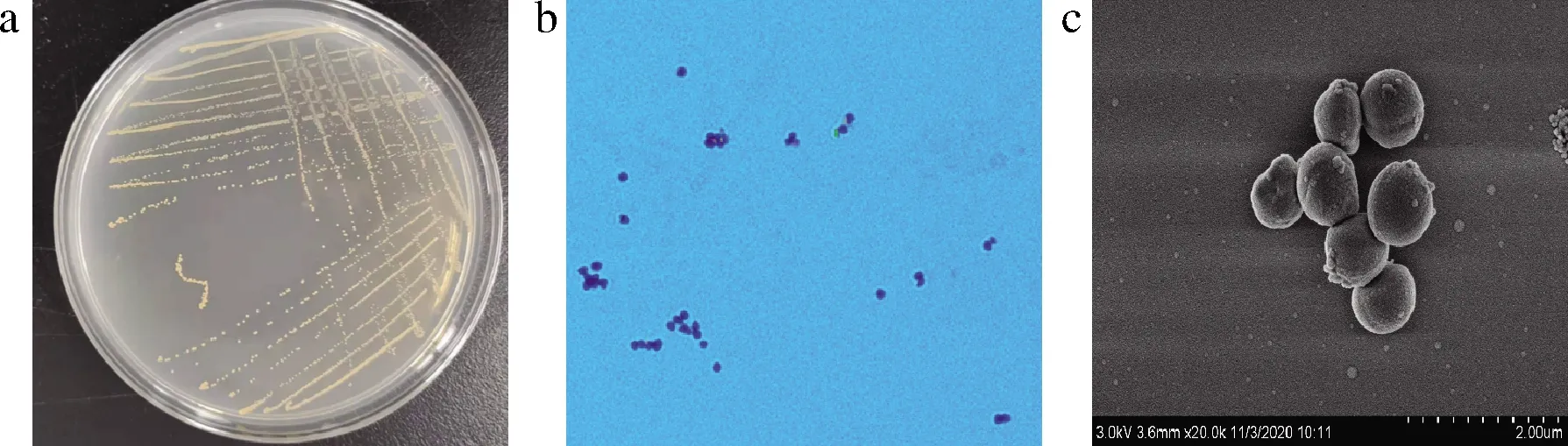
a-菌落形态图;b-革兰氏染色图;c-扫描电镜形态图图1 菌株SW03的菌体及菌落形态Fig.1 Microscopic and colony morphology of SW03

表3 菌株SW03的生理生化特征Table 3 Physiological and biochemical characteristics of SW03
2.3 菌株分子生物学鉴定
将测序所得特定序列在NCBI网站通过BLAST程序进行同源性对比并用MEGA X 10.0.2软件构建系统发育树结果如图2所示。该菌株的16S rDNA序列与数据库中葡萄球菌属(Staphylococcussp.)中的多个种的16S rDNA序列相近,同源性都大于97%,因此推断SW03是葡萄球菌属。但从系统发育树上可以看出,虽然SW03与葡萄球菌属中各种的系统发育关系很近,分支处数值却较低,推测可能出现了变种,这也与生理生化特征的验证结果相符。葡萄球菌多用于肉制品的发酵,是常见的发酵剂[21-22],并因其高效分解蛋白的能力成为研究热点,本研究利用其高效分解蛋白的能力,进行海参蛋白的降解。

图2 基于16S rDNA序列菌株SW03的系统发育树Fig.2 Phylogenetic tree of SW03 based on 16S rDNA sequence
2.4 单因素试验结果
由图3-a可知,在24~26 ℃随温度的上升,蛋白含量呈上升趋势,当温度为26 ℃时蛋白含量最高,26 ℃后随温度的上升开始呈现下降趋势,故在26 ℃左右可达到较好发酵效果。由图3-b可知,接种量为1%~3%时,蛋白含量随接种量的增大而不断提高,接种量为3%时含量最高,此后继续增大接种量,蛋白含量下降。相关研究发现培养基内营养物质的过度消耗会抑制菌株产酶的能力,进而影响其发酵效果,导致蛋白含量下降[22],故在接种量为3%左右时可达到较好发酵效果。由图3-c可知,pH<7时, 随着pH的增加蛋白含量不断增加, 在pH 7时达到最高点,随后随着pH的上升蛋白含量开始下降。pH通过对降解底物解离程度及细胞结构和功能的影响对菌株发酵效果产生作用。pH不同,蛋白在水中的解离程度不同[24],当pH过高或过低时会导致蛋白质变性进而影响菌株细胞膜活性[25]。因此,在初始pH 7左右进行菌株发酵可达到较好发酵效果。

a-温度;b-接种量;c- pH图3 温度、接种量及pH对水溶性蛋白含量的影响Fig.3 Effects of temperature, inoculum size and pH on the content of water-soluble protein注:误差线上不同字母表示不同组间存在显著差异(P<0.05)
2.5 响应面优化试验
2.5.1 Box-Benhnken结果
利用Design-Expert 8.0.6对数据进行多元二次回归拟合,得到Y:水溶性蛋白含量(g/L)对A:发酵温度(℃)、B:接种量(%)、C:培养基初始pH的多元回归方程为:
Y=-4 527.529 3+234.786 8A+5.833 5B+464.345 0C-6.725 0AC+4.081 0BC-3.6623A2-5.945 8B2-21.807 0C2
回归模型的方差分析结果见表4。回归方程决定系数R2=96.76%,表明96.76%的水溶性蛋白含量的变化可由此模型解释,且实际值和预测值之间的拟合度和可信度良好。由表4可得,培养基初始pH和发酵温度交互作用极显著(P<0.01),和接种量交互作用显著(P<0.05)而发酵温度和接种量交互作用不显著。A2、B2、C2影响极显著(P<0.01)。

表4 回归模型的方差分析Table 4 Variance analysis of regression model
2.5.2 各因素交互作用的响应面图
对二次响应面回归模型作出相应的响应曲面及等高线,结果如图4所示。等高线的形状反映交互项影响的强弱,椭圆形为交互作用显著,圆形则相反。培养基初始pH和发酵温度交互项对蛋白含量的影响显著性高于其他两组交互项。

图4 各因素交互作用对水溶性蛋白含量影响的 响应面曲线及等高线Fig.4 Response surface curve and contour map of various factors on the content of water-soluble protein
2.5.3 验证实验
如回归模型绘制的响应面所示,回归模型最大点为A=25.68、B=2.9%、C=6.96,在此条件下理论预测蛋白含量为109.4 g/L,根据实际实验室操作情况,得到最佳发酵条件为:26 ℃,接种量2.9%,pH6.9,实验实际蛋白含量为108.2 g/L,与预测值接近,说明所建模型拟合良好且可靠。
2.6 菌株生长曲线测定
比浊法、菌落平板计数法和显微镜直接计数法是测定微生物生长状况的常用方法,本研究采用比浊法反映细菌生长发育特征。如图5所示,菌株SW03及植物乳杆菌延迟期为0~6 h,在6 h后进入快速繁殖的对数期,30 h后进入稳定期,72 h内未进入衰亡期。解淀粉芽孢杆菌及肠膜明串珠菌在经过0~6 h延迟期后,分别在6~12 h及6~18 h进入快速繁殖对数期。枯草芽孢杆菌在0~6 h就进入快速繁殖的对数期,在60 h后出现衰亡的特征。SW03的快速繁殖期较长且进入稳定期后SW03具有较高的菌浓度。

图5 各菌株72 h培养的生长曲线Fig.5 Growth curve of different strains cultured for 72 h
2.7 菌株发酵过程中pH及水溶性蛋白含量的变化
2.7.1 发酵液pH变化
如图6所示,SW03及枯草芽孢杆菌的发酵液pH均是先下降后再上升,植物乳杆菌的发酵液pH先下降再上升后再出现下降趋势,解淀粉芽孢杆菌出现2次pH上升下降的循环过程,肠膜明串珠菌pH一直呈下降趋势,且72 h后发酵液pH最低。
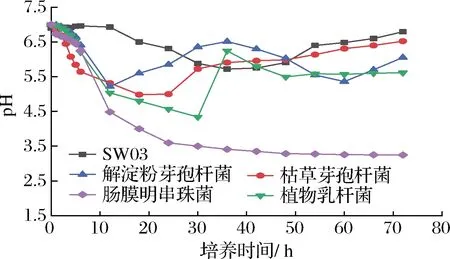
图6 各菌株发酵液的pH变化Fig.6 Changes of pH in the fermentation broth of different strains
2.7.2 发酵液水溶性蛋白含量变化
由图7可知,SW03与枯草芽孢杆菌在0~1 h水溶性蛋白含量增长速度最快,分别在1~18 h和1~6 h水溶性蛋白含量增长速度减缓。植物乳杆菌及肠膜明串珠菌分别在0~3 h及0~6 h水溶性蛋白含量呈高速增长状态,解淀粉芽孢杆菌在0~1 h的蛋白含量增长速度较缓,在1~3 h进入蛋白含量高速增长状态。在进入水溶性蛋白含量的稳定期后SW03发酵液中水溶性蛋白含量显著高于其他菌株,呈现出更佳的海参蛋白分解能力。4株商业菌株多进行泡菜、豆制品或肉制品的发酵,其可分解的蛋白种类及结构都与海参蛋白有所不同。同时,鲜海参因其难以贮藏及运输的特点无法大量流通,方便贮藏的盐渍海参是目前重要的海参制品及深加工原材料。盐渍海参制品含盐量高,实验采用添加海参匀浆液的高盐培养基,4株商业菌的耐盐性不及从海水中筛选得到的SW03,对海参蛋白的降解效果也会受到限制。
3 结论
目前,可直接进行海参蛋白降解的耐盐菌株有限,需开发新的高效商业菌株。经筛选、纯化鉴定和菌株发酵条件优化后,从海水中分离得到了可直接分解海参蛋白的葡萄球菌属(Staphylococcus)耐盐菌株SW03,其最佳发酵条件为26 ℃,接种量2.9%,培养基初始pH6.9,在此条件下水溶性蛋白含量可以达到108.2 g/L。结果表明,该菌株除了具有海水源微生物共有的发酵温度较低、耐盐性强、发酵时间较短等特点外,还针对海参蛋白具有较好的降解能力可直接进行海参蛋白的降解。通过筛选获得具有较好蛋白分解能力的SW03,一方面为采用微生物直接发酵法降解高盐含量蛋白提供了新菌种选择,同时也为下一步蛋白降解工具酶的开发提供优良微生物源。

