氯马斯汀对急性辐射损伤后OPCs细胞分化和髓鞘形成的影响
王艳艳 常凯 刘晨霞 那琬琳 江忠勇 熊杰
(中国人民解放军西部战区总医院检验科 成都 610083)
髓鞘是围绕在轴突外层的脂质膜,保护轴突不受外界环境的影响,可加速神经冲动的传导。脱髓鞘疾病发生时,机体内的少突胶质细胞前体细胞(Oligodendrocyte precursor cells,OPCs)迁移到病变处快速增殖,进而分化为成熟的少突胶质细胞,产生髓磷脂相关蛋白以包裹受损的轴突[1]。因事故照射、应急照射、恶性肿瘤放射治疗等受到大剂量外照射引起的脑型急性放射病,以脑组织损伤为基本病变,是极其严重的急性放射病[2-3]。辐照损伤大鼠实验研究表明:其主要病理机制为大脑少突胶质细胞数量减少,OPCs增殖和分化障碍,整个白质(包括胼胝体、海马伞、海马联合、皮层下区域、小脑)脱髓鞘改变,胼胝体体积较正常减少25%。因此认为,治疗放射性脑病的关键是促进OPCs的定向分化和增殖,增加少突胶质细胞的数量和形成髓鞘[4]。
已有研究表明OPCs的分化发育受到许多细胞因子及相关信号通路的调控,其中包括毒蕈碱受体等信号通路[5-6]。而OPCs表达乙酰胆碱的毒蕈碱 受 体 (Muscarinic acetylcholine receptors,mAChRs),故毒蕈碱通路是可以促进OPCs分化的重要通路[7]。氯马斯汀为治疗过敏及感冒症状的常用抗组胺药,其同样具有抗毒蕈碱作用,且能高效通过血脑屏障。因而本文旨在探讨氯马斯汀在急性放射损伤后OPCs细胞分化和髓鞘形成中的作用及意义,以期为治疗因事故照射或颅内肿瘤、脑血管畸形、头颈部恶性肿瘤等放射治疗后导致的放射性脑病提供新的靶点和药物[8]。
1 材料与方法
1.1 主要材料
杜氏改良Eagle培养(Dulbecco's modified eagle medium,DMEM)完全培养基(KGM12800 S-500,凯基生物)、氯马斯汀(Sigma)、髓鞘碱性蛋白(Myelin basic protein,MBP)(10458-1-AP,protrintech)、NF(25805-1-AP,protrintech)、NG2antibody(FITC)(orb463913,biorbyt)、OLIG2(13999-1-AP,protrintech)、山羊抗兔IgG/488(ZF-0511,中山金桥)、Goat Anti-Rabbit IgG Cy3,Conjugated:(CW0159S,CWBIO)、即用型4',6-二 脒 基-2-苯 基 吲 哚(4',6-diamidino-2-phenylindole,DAPI)染液(KGA215-50,凯基)、LV-Chrm1-5-RNA(吉凯基因)、新生SD大鼠(达硕动物实验室提供)。荧光PCR仪(CFX Connect™实时,上海伯乐)、化学发光成像系统(Chemi Doc TM XRS+,上海伯乐)。
1.2 急性辐射损伤脑组织病理改变
使用中国核动力院设备制造厂的Cs-137辐照装置对4周龄健康SD大鼠进行γ射线全身照射,总剂量50Gy[9],剂量率为5.224Gy/min。1d后取脑组织进行苏木精-伊红(HE)染色,观察急性放射损伤脑组织病理变化情况。
1.3 动物分组及处理
SD大鼠饮水、摄食1周后,按随机数字表法分为正常对照组、单纯辐射模型组和氯马斯汀组,每组6只。除正常对照组大鼠外,其余各组大鼠脑部均给予50Gy的γ射线照射,剂量率为5.224Gy/min,正常对照组和单纯辐射模型组给予等量生理盐水灌胃,氯马斯汀组给予氯马斯汀灌胃(剂量为0.9mg/kg),连续3d。照射后第3天处死大鼠,摘取脑组织备用。
1.4 原代细胞分离与培养
取新生24h的SD大鼠,用75%酒精消毒后,开颅取脑,置于预冷的hank’s中冲洗,剥离脑膜和血管,眼科剪将皮质层剪成1mm×1mm的大小,转移到离心管中进行机械吹打,静置5min,取上清液备用。
大鼠神经元细胞原代分离。用100μmol/L的细胞筛网进行过滤,收集滤液,1000r/min离心5min,弃去上清液,分别加入神经元细胞培养基(Neurobasal+1% B27+100nmol/L L-谷氨酰胺+100ng/mL NGF+1%P/S)进行重悬,1×106mL-1接种在培养板进行培养,根据细胞生长状态,1~2d换液一次,第3天加入阿糖胞苷(3μmol/L),1d后换全液。
大鼠OPCs原代分离。用70μmol/L的细胞筛网进行过滤,1000r/min离心5min,弃去上清液,加入含10%FBS高糖DMEM培养基重悬细胞,1×106mL-1密度接种于0.025%多聚赖氨酸预处理的培养瓶中,置于37℃、5%CO2培养箱中培养,根据细胞生长状态,2~3d换液一次,培养8~9d,待细胞融汇并形成明显分层,开始OPCs振荡分离和纯化。
1.5 Cell counting kit-8(CCK8)实验
将OPCs细胞消化、重悬、计数、铺板,细胞密度为7×103孔-1;待细胞贴壁后,加不同浓度的氯马斯汀(0.1μmol/L、0.2μmol/L、0.4μmol/L、0.6 μmol/L和0.8μmol/L)处理24h,将待测的96孔板细胞换成相同的培养基,每孔100μL;每孔加入CCK8试剂10μL,孵育2h;在450nm波长处检测吸光值。
1.6 慢病毒转染
将慢病毒配制含终浓度为5μg/mL的Polybrenede的培养液,用该培养液按MOI值为5对病毒进行稀释,加入培养板中轻轻混匀,置于37℃、5%CO2培养箱中,过夜培养,吸出含慢病毒颗粒的培养液,换上新鲜培养基,转染72h后利用RT-qPCR和Western blot检测转染效率。
1.7 免疫荧光染色
在培养板中将已爬好细胞的培养皿用PBS浸洗,用4%的多聚甲醛固定15min,PBS浸洗,0.5%Triton X-100(PBS配制)室温通透20min。PBS浸洗,在培养皿上滴加5% BSA,37°C封闭30min,随后每个培养皿滴加足够量稀释好的一抗,4℃孵育过夜。PBS浸洗后,滴加稀释好的荧光二抗,37°C孵育30min,PBS浸洗,滴加DAPI避光孵育5min,对标本进行染核,用20%甘油封闭培养皿,然后在荧光显微镜下观察采集图像。
1.8 实时荧光定量PCR(qPCR)
收集细胞悬液以提取总RNA。利用紫外可见分光光度计测定RNA的浓度和纯度(OD260/OD280)。将RNA通过逆转录HiFiScript cDNA第一链合成试剂盒合成cDNA。利用荧光PCR仪进行荧光定量PCR。反应体系和步骤详见说明书。
1.9 Western blot检测
收集细胞裂解,获取总蛋白,测定蛋白浓度。蛋白变性,上样,进行SDS-PAGE2电泳2h,然后用300mA恒流转膜80min。一抗溶液孵育,4°C过夜;二抗溶液中室温孵育2h。在膜上滴加ECL发光液,在凝胶成像系统中曝光。用“Quantityone”软件分析各抗体条带灰度值。
1.10 统计学分析
所有数据均用Graphpad Prism7进行统计分析,表示为“平均值±SD”。组间的显著性差异经T-test、One-way和Two-way ANOVA分析,以p<0.05作为显著性差异。
2 结果
2.1 急性辐射损伤脑组织病理改变
为了观察急性辐射损伤对大鼠脑组织的病理改变,依据职业性外照射急性放射病诊断中脑型急性放射病的诊断标准[2],我们用Cs-137γ射线对大鼠全身进行一次性辐照,总剂量为50Gy,剂量率为5.224Gy/min。1d后取大鼠脑组织进行HE染色,结果见图1。
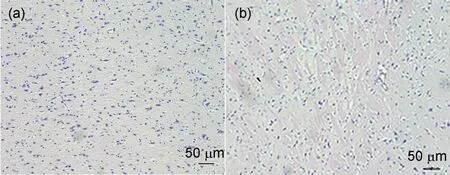
图1 急性辐射损伤大鼠脑组织HE染色:(a)正常对照大鼠脑组织;(b)急性辐射损伤大鼠脑组织Fig.1 HE staining of brain tissue in rats with acute radiation injury:(a)normal control rat brain tissue;(b)acute radiation injury rat brain tissue
与未辐照的正常对照大鼠脑组织比较,急性辐射损伤后的大鼠脑组织出现明显的神经纤维增粗、断裂,少突胶质细胞明显减少。
2.2 大鼠脑组织MBP蛋白表达测定
为了观察氯马斯汀对急性辐射损伤大鼠髓鞘再生的影响,Western blot检测MBP蛋白的表达情况。与对照组比较,单纯辐射模型组大鼠脑组织MBP蛋白量表达显著降低(p<0.01);氯马斯汀组大鼠脑组织MBP蛋白表达量降低(p<0.05),与氯马斯汀组比较,单纯辐射模型大鼠脑组织MBP蛋白表达量降低(p<0.05)(图2)。

图2 脑组织MBP蛋白表达(*p<0.05,**p<0.01,与对照组相比;#p<0.05,与氯马斯汀相比)Fig.2 Protein expression of MBP in rat brain tissue
2.3 原代神经元细胞鉴定
为鉴定分离的大鼠原代细胞是神经元细胞和OPCs(图3),通过免疫荧光分别检测标志蛋白NF和NG2的表达[10],结果如图4所示。NF和NG2免疫荧光染色强阳性,证明所分离培养的原代细胞为神经元细胞和OPCs。

图3 原代分离培养的大鼠神经元细胞和OPCs:(a)大鼠神经元细胞;(b)少突胶质前体细胞Fig.3 Primary isolated and cultured rat neuron cells and oligodendrocyte precursor cells:(a)rat neuron cells;(b)oligodendrocyte precursor cells

图4 大鼠神经元细胞和OPCs鉴定Fig.4 Identification of rat neuronal cells and oligodendrocyte precursor cells
2.4 氯马斯汀对OPCs细胞增殖的影响
为探究不同浓度的氯马斯汀(0.1μmol/L、0.2μmol/L、0.4μmol/L、0.6μmol/L、0.8μmol/L)对OPCs细胞增殖的影响,利用CCK8实验检测细胞活力,结果如图5所示。

图5 CCK8检测氯马斯汀对OPCs细胞增殖的影响;*p<0.05,与对照组相比Fig.5 CCK8detects the effect of clemastine on the proliferation of OPCs cells;*p<0.05,compared with the control group
氯马斯汀浓度梯度(0.1μmol/L、0.2μmol/L、0.4μmol/L、0.6μmol/L、0.8μmol/L)作用于OPCs细胞,0.1μmol/L、0.2μmol/L组与对照组比较细胞存活率无明显差异(存活率分别为84.26±7.76和69.22±9.26),当氯马斯汀浓度为0.4μmol/L时,细胞增殖受到抑制,存活率为61.26±11.27(p<0.01),且随着浓度的增加,细胞活力越来越低(药物浓度为0.6μmol/L、0.8μmol/L时,存活率分别为41.86±7.37、2.65±0.35),表明氯马斯汀能够抑制OPCs细胞增殖,且具有浓度效率,因此选择0.2μmol/L的氯马斯汀进行后续实验。
2.5 转染效率检测
为了验证毒蕈碱型受体1(CHRM1)、CHRM2和CHRM3干扰表达的转染效率,通过RTqPCR和Western blot检测mRNA和蛋白的表达情况,结果见图6。与对照组相比,CHRM1干扰显著降低了CHRM1的mRNA和蛋白的表达水平(图6(a));CHRM2设计了3条干扰序列(M2R-1、M2R-2和M2R-3),结果表明,与对照组相比,M2R-2和M2R-3干扰显著降低了CHRM2的mRNA和蛋白的表达水平(图6(b)),其中第3条干扰序列(M2R-3)的干扰效率最佳,用于后续研究;与对照组相比,CHRM3、CHRM4、CHRM5干扰显著降低了CHRM3、CHRM4和CHRM5的mRNA和蛋白的表达水平(图6(c)、(d)、(e))。结果表明,CHRM1、CHRM2、CHRM3、CHRM4和CHRM5转染成功。

图6 RT-qPCR和Western blot检测CHRM1、CHRM2、CHRM3、CHRM4和CHRM5干扰的转染效率;**p<0.01,与对照组相比Fig.6 RT-qPCR and Western blot to detect the transfection efficiency of CHRM1,CHRM2,CHRM3,CHRM4,and CHRM5 interference;**p<0.01,compared with the control group
2.6 氯马斯汀对OPCs细胞分化和髓鞘形成的影响
为探究氯马斯汀对OPCs细胞分化和髓鞘形成的影响,通过免疫荧光检测髓鞘碱性蛋白(MBP)和少突胶质细胞转录因子2(OLIG2)的表达,以及Western blot检测MBP的表达[11-12]。与正常组相比,CHRM2干扰(M2R)显著促进了MBP的表达,而氯马斯汀处理后进一步促进了MBP的表达(图7(a));此外,免疫双荧光也得到了类似的结果,CHRM2干扰(M2R)显著促进了MBP和OLIG2的表达,而氯马斯汀处理进一步促进了MBP和OLIG2的表达(图7(b));结果表明氯马斯汀可作用于M2R,促进OPCs细胞分化和髓鞘形成。

图7 氯马斯汀对OPCs细胞分化和髓鞘形成的影响:(a)Western blot检测MBP的蛋白表达水平;(b)免疫荧光检测MBP和OLIG2的表达;*p<0.05,与对照组相比Fig.7 Effect of clemastine on cell differentiation and myelination of OPCs:(a)western blot to detect the protein expression level of MBP;(b)immunofluorescence to detect the expression of MBP and OLIG2;*p<0.05,compared with the control group
3 讨论
随着核技术在医学及科研等领域的广泛应用,核与辐射事故引发的脑型急性放射病及防治越发引起人们的重视。Piao等[4]研究发现,将4周龄健康SD大鼠进行放射线照射,全颅总剂量50Gy,水迷宫和加速条件下的旋转等行为学实验发现,被照射大鼠的认知力、理解力、记忆力严重下降,运动协调能力和情绪障碍。其主要病理机制为大脑少突胶质细胞数量减少,OPCs增殖和分化障碍,整个白质脱髓鞘改变[5],目前对该疾病的治疗仍处于探索阶段。因此,寻找一种能够有效促进自体OPCs增殖与分化的药物或者治疗方式,是我们面临的问题和挑战。
急性放射损伤、颅内肿瘤、脑血管畸形、头颈部恶性肿瘤放射治疗以及自身免疫反应性疾病等多种脱髓鞘疾病发病多由OPCs分化障碍所引起。研究并明确OPCs分化的分子机制,对于阐明脱髓鞘疾病的发病机制和寻找疾病治疗的新靶点均有重要意义[13]。在本研究中,我们验证了急性放射损伤大鼠脑组织髓鞘脱失,而应用氯马斯汀后,髓鞘形成增加。并通过进一步研究,明确了氯马斯汀在OPCs细胞分化中的作用。发现氯马斯汀能够抑制OPCs细胞增殖,且具有浓度效率,排除其对OPCs细胞增殖的影响后,实验发现氯马斯汀能够增强CHRM2干扰(M2R)促进OPCs细胞分化的能力。
mAChRs药理分型依据受体与选择性激动剂或拮抗剂亲和力不同,将M受体分为4种亚型[14];分子生物学分型则依据M受体的核苷酸序列差异分为5种亚型,药理学的M1~M4分别与分子生物学的M1~M4型相对应[15]。现有研究发现,M受体均与细胞膜内侧的G蛋白相偶联,而神经递质通过相应的受体与各种G蛋白偶联,以激活相应的信号转导途径,为实现各种神经递质功能和细胞内信号分子网络的相互作用提供了分子基础[16]。本文研究显示,M1~M5亚型在OPCs细胞上均有表达,且M1~M4表达较强,而M5表达较低,结果印证了上述论断,可作为上述论断的证据补充[17]。
氯马斯汀为治疗过敏及感冒症状的常用抗组胺药,具有抗毒蕈碱作用,且能高效通过血脑屏障[18]。Green等[19]将氯马斯汀用于治疗多发性硬化(Multiple sclerosis,MS)患者且具有一定影响,然而该研究并未明确表明干预机制。也有研究发现,氯马斯汀能够改善小鼠神经精神症状并在脱髓鞘模型中促进小鼠髓鞘再生,其作用机制可能是在脱髓鞘病变中穿过血脑屏障,通过抗毒蕈碱作用促进OPCs增殖分化为成熟OLs[20]。本研究基于细胞实验表明:氯马斯汀能够增强抗毒蕈碱作用,促进OPCs细胞分化为OLs,通过上调MBP的表达进而修复受损髓鞘。

