MRI定量分析2型糖尿病合并非酒精性脂肪性肝病肝脂肪变性程度与铁含量的相关性
刘晓怡,温馨,周翔海,张新羽,洪楠,王屹*
1.北京大学人民医院放射科,北京 100044;2.北京大学人民医院内分泌科,北京 100044;*通信作者 王屹 wang_yi@bjmu.edu.cn
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是最常见的慢性肝病。由于代谢紊乱、胰岛素抵抗等诸多复杂因素的相互作用,NAFLD的发生与2型糖尿病(type 2 diabetes mellitus,T2DM)密切相关[1]。近年研究显示,NAFLD患者肝脏铁含量水平较正常人升高,铁是NAFLD发病机制中的促成因素之一[2-3];此外,铁代谢与T2DM之间亦存在紧密联系,铁超载可能在T2DM的发生、发展和慢性并发症的形成中起重要作用[4]。然而,目前关于肝脏铁含量在T2DM合并NAFLD方面的相关研究很少,铁代谢是否与肝脏脂肪变性的严重程度相关,目前尚未很好地阐述。本研究拟采用最小二乘估算法迭代水脂分离技术(iterative decomposition of water and fat with asymmetry and least squares estimation quantitative fat image,IDEAL-IQ)定量评估肝脏脂肪变性及铁沉积情况,探讨肝脏铁含量与T2DM伴有NAFLD患者脂肪变性严重程度的相关性及意义。
1 资料与方法
1.1 研究对象 前瞻性收集2019年12月—2020年12月在北京大学人民医院内分泌科确诊为T2DM并住院治疗的120例患者,并行腹部MRI平扫。纳入标准:①T2DM,年龄≥18岁;②T2DM的诊断符合1999年WHO诊断标准[5]。排除标准:①男性饮酒量为乙醇量>30 g/d,女性饮酒量为乙醇量>20 g/d;②病毒性肝炎、药物性肝病、自身免疫性肝病、肝硬化及肝脏恶性肿瘤;③全胃肠外营养、甲状腺功能减退等可导致脂肪肝的特定疾病;④既往有精神疾病史;⑤患有严重的心、肺、脑或躯体功能损害疾病;⑥妊娠期女性;⑦具有MRI检查禁忌证;⑧MRI影像伪影重,影响结果判断。最终纳入94例患者,其中女31例,男63例;年龄17~83岁,平均(51±13)岁。收集患者的年龄、性别、血压、体质量指数(BMI)及生化指标。本研究获得医院伦理委员会批准(批准号:2019PHB220-01),患者均知情同意。
1.2 仪器与方法 采用GE Discovery 750 3.0T MRI扫描仪。根据临床常规影像检查规范,采用腹部线圈行上腹部MRI平扫,扫描序列:①横断位可变肝脏加速容积采集(LAVA-Flex)序列,TR 3.74 ms,TE 1.69 ms,矩阵40 cm×40 cm;②IDEAL-IQ序列,TR 6.02 ms,TE 2.764 ms,矩阵40 cm×40 cm;③T2WI序列,TR 2 625 ms,TE 82.17 ms,矩阵40 cm×40 cm;④扩散加权成像序列,TR 4 000 ms,TE 58.3 ms,矩阵40 cm ×40 cm。累计检查时间约10 min。
1.3 图像分析 IDEAL-IQ序列在GE AW 4.6工作站上计算质子密度脂肪分数(proton density fat fraction,PDFF)图和铁含量(MRI弛豫率,R2*),在PDFF图上于每个肝段手动勾画感兴趣区(ROI),ROI为200 mm2,避开血管、肝缘、伪影等干扰,计算平均值,确定脂肪含量。在同一患者IDEAL-IQ自动重组的R2*图像上,以同样的方法手动勾画ROI,取平均值。
1.4 分组 以PDFF≥6.4%为标准[6],将T2DM患者分为伴有NAFLD 51例和不伴有NAFLD 43例。进一步根据PDFF按照脂肪变性严重程度划分为4组:PDFF<6.4%为不伴有NAFLD组(F0组,43例),6.4%~17.3%为NAFLD轻度脂肪变性组(F1组,35例),17.4%~22.3%为NAFLD中度脂肪变性组(F2组,11例),≥22.4%为NAFLD重度脂肪变性组(F3组,5例)。
1.5 统计学方法 应用SPSS 23.0软件,符合正态分布的计量资料以±s表示,两组间比较采用独立样本t检验,计数资料组间比较采用χ2检验。不同脂肪变性组间肝脏铁沉积比较采用方差分析,并进行趋势检验。以是否患有NAFLD为因变量,将单因素分析差异有统计学意义的因素纳入自变量,进行Logistic回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 基本资料分析 与T2DM不伴有NAFLD组相比,T2DM伴有NAFLD组的BMI、舒张压、空腹血糖(fasting plasma glucose,FPG)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、白蛋白(albumin,ALB)、总蛋白(total protein,TP)水平明显升高,差异有统计学意义(P均<0.05),两组其他指标差异无统计学意义(P>0.05),见表1。
2.2 T2DM伴有NAFLD组与不伴有NAFLD组R2*值比较 与不伴有NAFLD组相比,T2DM伴有NAFLD组R2*值升高(P<0.01),见表1。

表1 T2DM伴有NAFLD与不伴有NAFLD患者的基本资料及R2*比较
2.3 不同脂肪变性组间肝脏铁沉积的方差分析 F0组、F1组、F2组、F3组R2*值分别为(49.0±10.0)/s、(55.2±12.6)/s、(57.4±6.8)/s、(63.0±11.3)/s。与F0组相比,F1组、F2组、F3组R2*值升高(F=3.126,P<0.05)。趋势性检验结果提示,随着脂肪变性程度加重,R2*值逐渐升高(F=6.312,P<0.05),见图1、2。 2.4 多因素Logistic回归分析 R2*值、ALT、BMI是T2DM伴有NAFLD的独立危险因素(P<0.05),见表2。
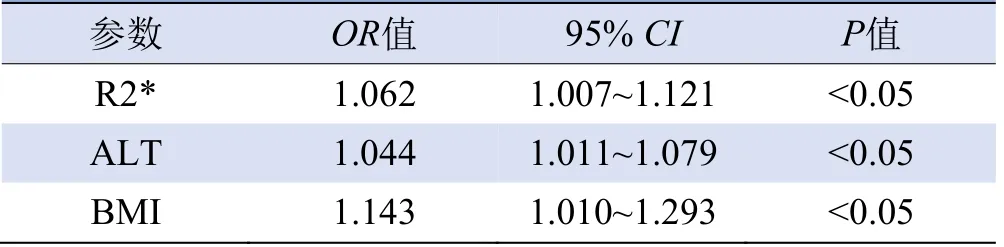
表2 多因素Logistic回归分析T2DM伴NAFLD的影响因素
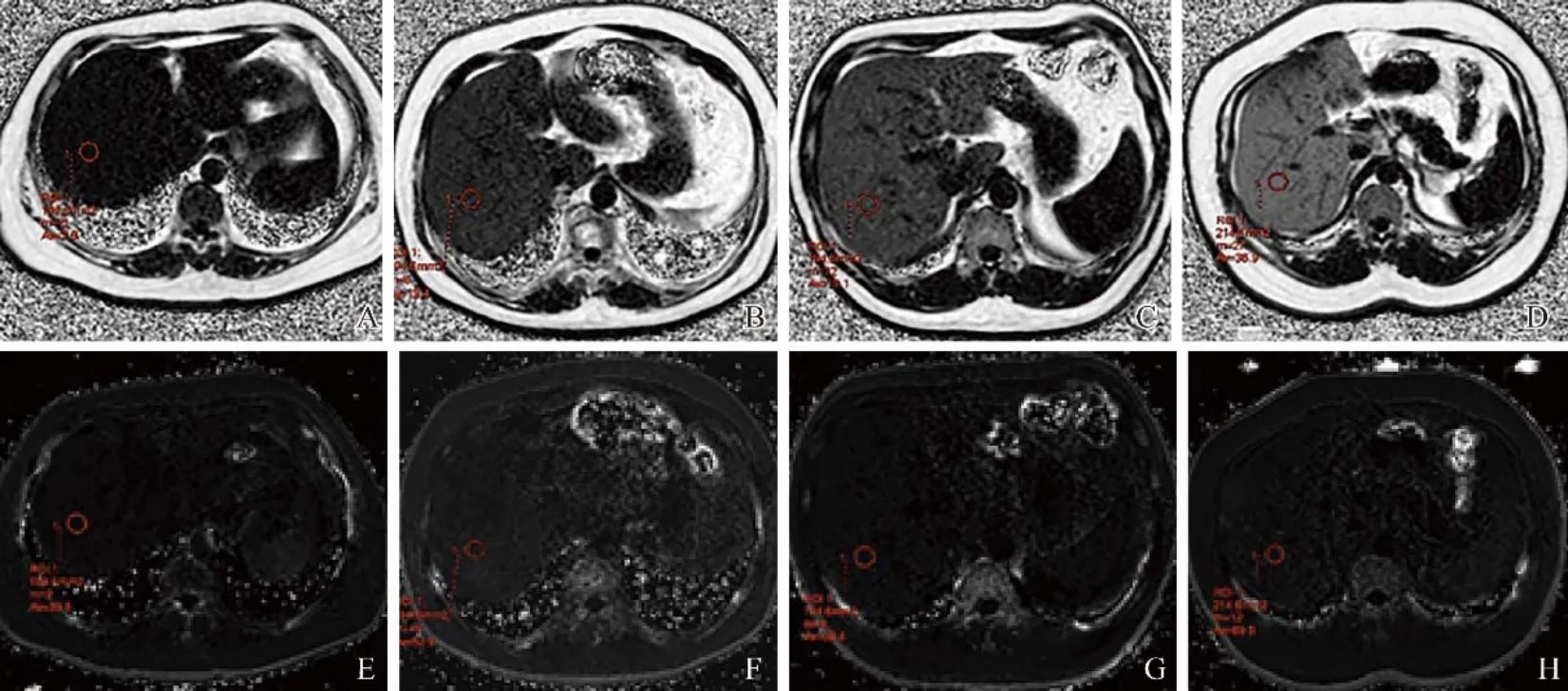
图1 IDEAL-IQ PDFF与R2*图。A~D.F0-F4组 PDFF图示脂肪变性程度逐渐增加,PDFF值分别为2.0%(A)、13.4%(B)、19.1%(C)、36.9%(D);E~H.F0-F4组R2*图示随着脂肪变性程度的加重,R2*值升高,R2*值分别为39.8/s(E)、52.6/s(F)、59.4 /s(G)、69.5/s(H);IDEAL-IQ:最小二乘估算法迭代水脂分离;PDFF:质子密度脂肪分数;R2*:MRI弛豫率
3 讨论
本研究应用MRI IDEAL-IQ技术探讨T2DM合并NAFLD患者肝脏铁沉积与肝脏脂肪变性严重程度的关系,结果显示T2DM伴有NAFLD患者的R2*值高于不伴有NAFLD者,且随着PDFF值的增高,R2*值有增加的趋势。经典的“二次打击”学说认为胰岛素抵抗和氧化应激是NAFLD的主要发病机制[7]。既往研究表明,铁是NAFLD发病机制中的促成因素之一[8]。因此,探讨铁沉积与T2DM合并NAFLD之间的关系,有助于为疾病的临床诊治提供一定的科学依据。目前,超声、CT和MRI已应用于NAFLD的临床诊断与研究,但超声诊断轻度脂肪肝的敏感度低,影响结果的准确性;CT射线对人体有害,不适用于NAFLD的普查、诊断和随
访[9-10]。本研究采用MRI新技术IDEAL-IQ序列,通过采集6个不同TE时间的回波信号,一次扫描可重建获得纯脂肪像、脂肪比像、同相位像、反相位像、纯水像和R2*弛豫图像,在脂肪比像和R2*弛豫图像上直接勾画ROI即可获得PDFF及R2*数值,分别反映脂肪及铁含量水平,操作简单,可重复性强,相关临床研究证实该技术能较为精准地定量分析肝脏脂肪及铁含量,有利于定期监测肝脏铁含量和脂肪的动态变化[11-14]。
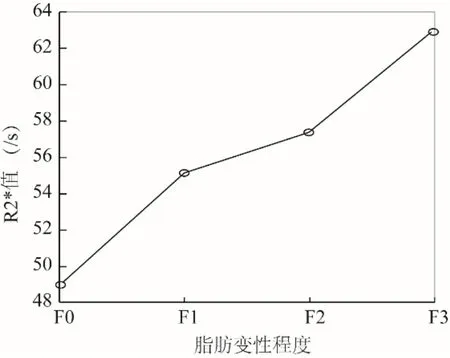
图2 T2DM患者脂肪变性程度与R2*的相关性。随着脂肪变性程度加重,R2*值逐渐升高
3.1 肝脏铁含量与肝脏脂肪变性严重程度的关系 本研究显示,54%(51/94)的T2DM患者伴有不同程度肝脏脂肪变性,即合并NAFLD,与既往报道一致,验证了MRI对肝脏脂肪定量的适用性[14-15]。本研究发现,T2DM伴有NAFLD者肝脏铁含量高于不伴有NAFLD者,与Kim等[16]报道的NAFLD单纯性脂肪变性组代表铁沉积的T2*弛豫时间(1/R2*)比健康对照组短这一结果相符,提示T2DM伴有NAFLD患者普遍存在铁超载现象。Imajo等[17]研究发现,NAFLD患者肝细胞炎症和气球样变程度越重,R2*值越大,提示铁沉积可能参与了NAFLD的进展。本研究也发现,随着肝脏脂肪变性程度增加,铁沉积程度加重。肝脏是铁的主要存储器官,而肝脏内铁过度沉积可启动Fenton反应和Haber-Weiss反应,产生氧自由基,导致脂质过氧化;过量的铁可损伤肝细胞、加剧NAFLD肝脏脂肪变性的严重程度,且肝细胞损伤进一步加重肝脏铁代谢紊乱,两者协同使NAFLD不断发生、发展[8]。
3.2 T2DM合并NAFLD患者的临床特点及危险因素 本研究中T2DM伴有NAFLD患者BMI、舒张压、空腹血糖、ALT、AST、ALB、TP及R2*值均高于不伴有NAFLD者,表明此类患者存在较严重的肥胖、糖脂代谢紊乱及肝功能不同程度损害,与Bian等[18]、Lee等[19]的研究结果一致。Logistic回归分析显示,R2*值、ALT及BMI是T2DM发生NAFLD的独立危险因素,提示肝脏铁含量增加、ALT异常及肥胖共同促进了T2DM合并NAFLD的发生。肝脏内铁沉积干扰胰岛素信号,影响胰岛素的合成和分泌;且铁沉积介导的脂质过氧化加重肝脏损伤,影响肝脏的糖代谢,可能是造成上述结果的主要原因[20-21]。因此,肝脏铁含量可能是T2DM合并NAFLD的有效预测指标或治疗靶点。
3.3 局限性和展望 本研究未能与肝脏穿刺活检的组织学“金标准”进行对照分析;未考虑肝脏纤维化程度对铁沉积和脂肪沉积测量结果的影响,在一定程度上可能影响结果的准确性。随着MRI的发展,精准分离肝脏脂肪、铁和纤维化的干扰,将是今后的研究热点。另外,虽然本研究发现T2DM合并NAFLD患者随着肝脏脂肪变性程度加重,肝脏铁含量升高,但体内铁负荷在T2DM患者NAFLD发生及发展中的机制和因果作用,还需要进行更深入的基础研究和前瞻性研究。
总之,对于T2DM伴有NAFLD患者,肝脏铁含量与肝脏脂肪变性严重程度有很好的相关性。铁是T2DM合并NAFLD的独立危险因素之一,降低铁沉积水平、减少铁介导的氧化应激,可能有助于改善肝脏脂肪变性,有望成为T2DM合并NAFLD的综合治疗方法之一。IDEAL-IQ序列有利于定期监测肝脏铁含量和脂肪的动态变化,便于对T2DM伴有NAFLD患者的病情评估、治疗方案选择和疗效评估提供指导性意见。

