2型糖尿病患者静息态小脑功能连接研究
柳瑞芳,田静,赵莲萍,*,黄刚,,陆亚姗,王玉
1.甘肃中医药大学第一临床医学院(甘肃省人民医院),甘肃 兰州 730000;2.甘肃省人民医院放射科,甘肃 兰州 730000;3.甘肃省人民医院内分泌科(干部病房3),甘肃 兰州 730000;*通信作者 赵莲萍 lianping_zhao007@163.com
2型糖尿病(type 2 diabetes mellitus,T2DM)是一种以进行性胰岛素抵抗和高血糖为主要特征的慢性代谢性疾病[1]。全球约4亿人患有T2DM,预计到2045年患病人数将增加51%[2]。多项研究表明,T2DM是痴呆、脑血管病、抑郁等多种神经系统疾病的危险因素[3-4]。静息态功能磁共振成像(resting-state functional magnetic resonance imagine,rs-fMRI)是评估脑功能活动的有力工具,广泛应用于神经系统疾病的研究[5-7],目前关于T2DM患者神经影像方面的研究主要集中在大脑,对小脑研究甚少。近年研究发现,小脑除调节躯体平衡、调节肌紧张及协调随意运动外,在高级认知和情感加工方面具有重要作用[8-9],小脑损伤患者存在执行功能异常及抑郁症状[10]。此外,小脑不同亚区具有明显的功能异质性[11],部分小脑亚区与大脑皮层的非运动区域之间存在功能协调作用[12]。因此,本研究拟采用rs-fMRI探讨T2DM患者与高级认知加工及情感功能密切相关的小脑亚区[11-14](双侧小脑Crus I、Crus Ⅱ、小叶Ⅸ)与全脑之间的静息态功能连接(functional connectivity,FC)异常模式,为阐明T2DM患者脑损害的神经病理生理机制提供客观的影像学依据。
1 资料与方法
1.1 研究对象 前瞻性收集2017年11月—2020年10月在甘肃省人民医院代谢诊疗中心就诊的T2DM患者83例,招募健康志愿者61名作为对照组。纳入标准:T2DM病程>1年,均符合1999年WHO糖尿病诊断及分类标准[15];年龄18~70岁,汉族,男女不限,均为右利手,受教育程度≥6年。对照组性别、年龄及受教育程度与T2DM组相匹配;随机血糖(指尖采血)<11.1 mmol/L。排除标准:有中枢神经系统或精神心理疾病;有严重的T2DM并发症;有严重头部外伤史及心、肝、肾疾病;有乙醇依赖及物质滥用史;有明显听力或视力障碍;有MRI检查禁忌证。
所有受试者均签署知情同意书。本研究通过甘肃省人民医院医学伦理委员会审批(批号:2017-188)。
1.2 研究方法
1.2.1 临床变量采集 ①临床资料:记录受试者性别、年龄、受教育程度、体质量指数(BMI)、空腹血糖、空腹胰岛素、糖化血红蛋白、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C),其中空腹血糖采用己糖激酶法检测,空腹胰岛素采用化学发光微粒子免疫检测法检测,糖化血红蛋白采用高效液相色谱法检测,HDL-C采用直接法-过氧化氢酶清除法检测。②认知心理量表评定:由经过专业培训的医师对所有受试者进行简易智能精神状态检查量表(mini-mental state examination,MMSE)、蒙特利尔认知评估量表(Montreal cognitive assessment,MoCA)、汉密尔顿焦虑量表(Hamilton anxiety scale,HAMA)、汉密尔顿抑郁量表-24项(Hamilton depression scale-24,HAMD-24)评定。
1.2.2 MRI数据采集 受试者清醒平卧,固定头部,尽量避免做专注思维活动。使用西门子3.0T MR 32通道头线圈采集头颅MR数据。先常规行MRI序列(T1WI、T2WI及T2-FLAIR序列)扫描,排除颅脑器质性病变后,再进行rs-fMRI及三维颅脑容积结构像扫描。rs-fMRI采用血氧水平依赖梯度回波-回波平面成像序列,扫描参数:TR 2 000 ms,TE 30 ms,翻转角90°,视野224 mm×224 mm,矩阵64×64,层厚3.5 mm,间距0.7 mm,层数33,激励次数1次,采集420个时间点,扫描时间848 s。结构像扫描参数:TR 2 530 ms,TE 2.35 ms,反转时间1 100 ms,翻转角7°,视野256 mm×256 mm,矩阵256×256,层厚1.33 mm,间距0.665 mm,激励次数1次,扫描时间323 s,共连续采集192层矢状面图像。
1.2.3 MR 数据预处理 使用基于MATLAB 的SPM12(http://www.fil.ion.ucl.ac.uk/spm)和DPABI_ V4.2(http://restfmri.net/forum/dpabi)软件对rs-fMRI数据行预处理。具体步骤:DICOM→NIFTI数据格式转换、去除前10个时间点、层时间校正、头动校正(剔除头动平移>2.5 mm,或旋转>2.5°的受试者)、空间标准化(体素大小3 mm×3 mm×3 mm)、高斯平滑(半高全宽6 mm)、去线性漂移、回归去除协变量(头动、脑脊液、脑白质信号和全脑均值信号)。
1.2.4 基于种子点的FC分析 通过WFU_PickAtlas软件,提取AAL模板中的双侧小脑Crus I、Crus Ⅱ及小叶Ⅸ分别作为种子脑区,计算其与全脑各体素之间的功能连接,获得功能连接图得到相应的相关系数,采用Fisher转换将计算得到的功能连接值转换为Z值行统计学分析。
1.3 统计学方法 ①一般资料:使用SPSS 25.0软件,计数资料比较采用χ2检验;正态分布的计量资料以±s表示,组间比较采用独立样本t检验;不符合正态分布的计量资料用M(Q1,Q3)表示,组间比较采用Mann-WhitneyU检验,以P<0.05为差异有统计学意义。②基于种子点FC的组间比较:将年龄、性别、受教育程度及头动参数作为协变量,以两样本t检验分别比较双侧小脑Crus I、Crus Ⅱ及小叶Ⅸ为种子脑区的全脑FC的组间差异,经高斯随机场多重比较校正,校正后以单个体素P<0.001,簇大小P<0.05为差异有统计学意义。③相关分析:提取T2DM组差异显著脑区的FC值分别与临床生化指标、认知心理量表评分进行Pearson相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 人口学资料及认知心理量表评定结果 因头动超标,预处理时剔除5例T2DM患者及4名对照,最终纳入78例T2DM和57名健康对照。两组受试者的年龄、性别、受教育程度及BMI差异均无统计学意义(P>0.05)。与对照组比较,T2DM组MoCA、HAMA、HAMD-24评分差异有统计学意义(P<0.05),见表1。
表1 T2DM组与对照组人口学资料及认知心理量表评分比较(±s)
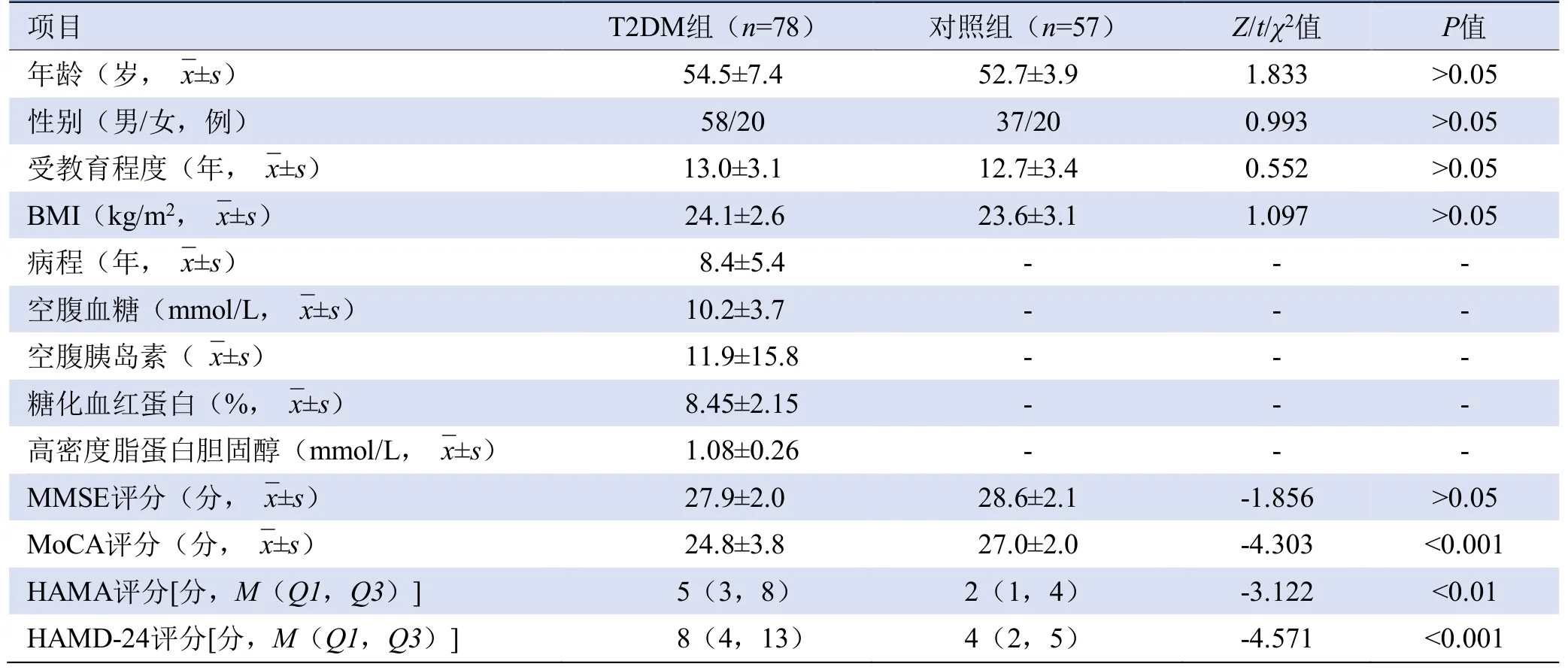
表1 T2DM组与对照组人口学资料及认知心理量表评分比较(±s)
注:BMI为体质量指数,MMSE为简易智能精神状态检查,MoCA为蒙特利尔认知量表,HAMA为汉密尔顿焦虑量表,HAMD-24为汉密尔顿抑郁量表-24项
项目 T2DM组(n=78) 对照组(n=57) Z/t/χ2值 P值 ?年龄(岁,images/BZ_19_687_3009_713_3057.png±s) 54.5±7.4 52.7±3.9 1.833 >0.05 性别(男/女,例) 58/20 37/20 >0.05 受教育程度(年,images/BZ_19_687_3009_713_3057.png±s) 13.0±3.1 12.7±3.4 0.552 >0.05 0.993 BMI(kg/m2,images/BZ_19_687_3009_713_3057.png±s) >0.05 病程(年,images/BZ_19_687_3009_713_3057.png±s) 8.4±5.4 - - - 24.1±2.6 23.6±3.1 1.097 - 空腹胰岛素(images/BZ_19_687_3009_713_3057.png±s) 11.9±15.8 - - - 空腹血糖(mmol/L,images/BZ_19_687_3009_713_3057.png±s) 10.2±3.7 - - - 高密度脂蛋白胆固醇(mmol/L,images/BZ_19_687_3009_713_3057.png±s) 1.08±0.26 - - - 糖化血红蛋白(%,images/BZ_19_687_3009_713_3057.png±s) 8.45±2.15 - - >0.05 MoCA评分(分,images/BZ_19_687_3009_713_3057.png±s) 24.8±3.8 27.0±2.0 -4.303 <0.001 MMSE评分(分,images/BZ_19_687_3009_713_3057.png±s) 27.9±2.0 28.6±2.1 -1.856 HAMA评分[分,M(Q1,Q3)]5(3,8) 2(1,4) -3.122 <0.01 HAMD-24评分[分,M(Q1,Q3)]8(4,13) 4(2,5) -4.571 <0.001
2.2 基于种子点FC的组间差异 与对照组比较,T2DM组左侧小脑Crus I-左侧额下回三角部间FC增强(P<0.05);右侧小脑Crus I-右侧额下回三角部/右侧顶下缘角回间FC增强(P<0.05);左侧小脑小叶Ⅸ-右侧缘上回间FC增强(P<0.05),见表2、图1。

图1 T2DM组与对照组基于种子点功能连接分析的结果。A.种子脑区左侧小脑Crus I区(黄色);B.T2DM组左侧小脑Crus I区较对照组功能连接增强的脑区(左侧额下回三角部);C.种子脑区右侧小脑Crus I区(绿色);D.T2DM组右侧小脑Crus I区较对照组功能连接增强的脑区(右侧额下回三角部);E.T2DM组右侧小脑Crus I区较对照组功能连接增强的脑区(右侧顶下缘角回);F.种子脑区左侧小脑小叶Ⅸ区(红色);G.T2DM组左侧小脑小叶Ⅸ区较对照组功能连接增强的脑区(右侧缘上回)
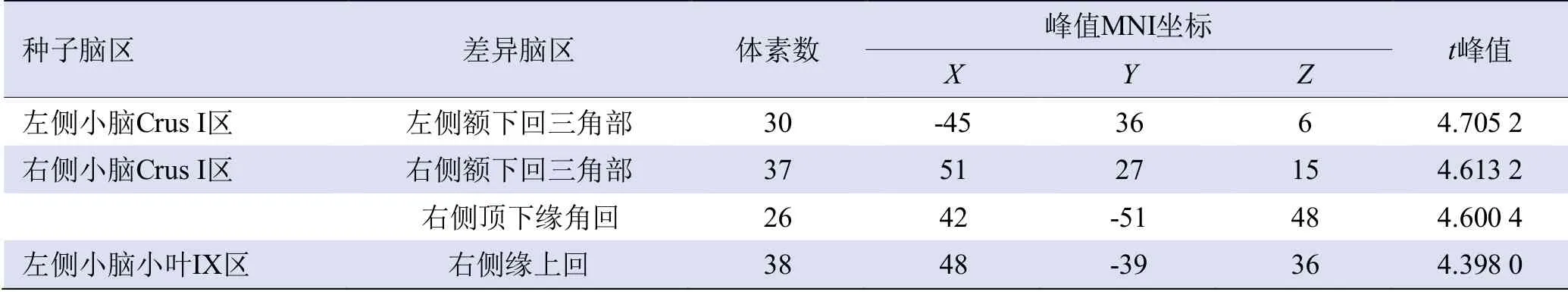
表2 T2DM组和对照组基于种子点功能连接分析的两样本t检验结果
2.3 Pearson相关分析 右侧小脑Crus I-右侧额下回三角部间FC值与HDL-C水平呈正相关(r=0.233,P<0.50),右侧小脑Crus I-右侧顶下缘角回间FC值与糖化血红蛋白呈正相关(r=0.262,P<0.05)(图2)。
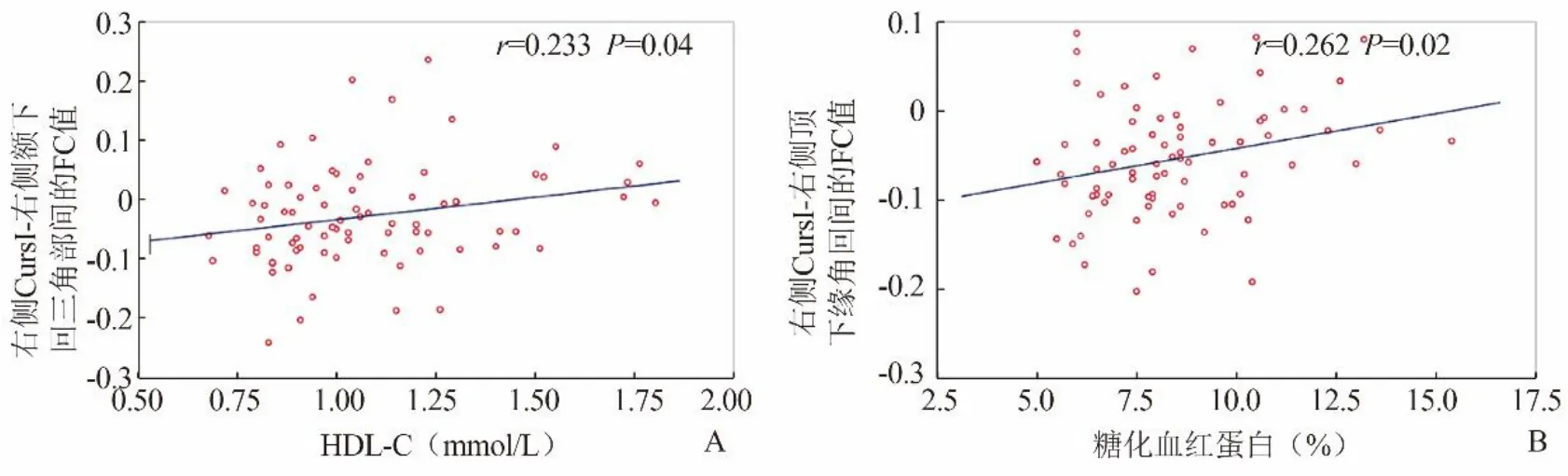
图2 T2DM患者脑功能连接增强脑区的FC值与HDL-C(A)和糖化血红蛋白(B)的相关性
3 讨论
本研究采用静息态功能MRI,探讨T2DM患者小脑-大脑间的功能连接异常模式,基于文献[11-14]报道,选择与认知及情绪相关的双侧小脑Crus I、Crus Ⅱ及小叶Ⅸ为种子脑区,进行功能连接分析,发现T2DM患者双侧小脑Crus I、左侧小脑小叶Ⅸ亚区与大脑默认网络多个脑区间功能连接受损,且与高密度脂蛋白及糖化血红蛋白水平相关。
额叶在认知功能及情感活动中起重要作用[16],额下回三角部位于内侧前额叶,是核心脑区之一,也是认知及情绪处理的关键皮层,主要参与决定作用[17]。一项关于小脑认知和运动功能分离的研究表明,小脑Crus I、Ⅱ存在区通向大脑区域神经纤维束,可随着认知负荷的增加而被激活[18]。神经解剖学研究也揭示了小脑和前额叶皮层间存在双向投射[19],表明人脑中前额叶与小脑间存在神经环路,这也为小脑参与多种认知功能提供了神经基础。本研究中,T2DM患者存在认知功能减退及焦虑、抑郁情绪,其双侧小脑Crus I分别与同侧额下回三角部间的FC显著增强,提示T2DM患者的小脑Crus I与额下回三角部间功能连接紊乱,可能是T2DM认知功能及情绪异常的一种神经代偿机制。额下回是情绪及认知加工的关键脑区,研究发现抑郁障碍患者存在额下回脑功能异常[17],首发未治疗的抑郁障碍患者额下回与前扣带回间的FC增强,治疗后上述脑区间的FC值减低[20],进一步提示情绪异常患者存在额下回与其他脑区间的FC代偿机制,与本研究结果一致。本研究还发现,右侧小脑Crus I-额下回三角部间的FC值与HDL-C呈正相关,即HDL-C水平越高,右侧Crus I-额下回三角部间的功能连接代偿作用越明显,HDL-C可促进胆固醇的代谢,是一种抗动脉粥样硬化的血浆脂蛋白,有研究表明抑郁是HDL-C水平降低的危险因素[21],且低密度脂蛋白胆固醇与HDL-C比值降低在一定程度上可以预测T2DM患者的认知功能下降[22],提示T2DM患者HDL-C水平与认知损伤及抑郁障碍有关,进一步支持本结果。
顶叶功能广泛,可进行多种感觉信息和语言的整合。顶下小叶和顶下缘角回同属。顶下小叶包括缘上回和角回,主要负责执行功能、情绪加工及语言整合[23]。执行功能是高级认知的核心组成部分[24],本研究发现T2DM患者左侧小脑小叶Ⅸ与缘上回间的FC增强,提示T2DM患者认知功能受损与顶下小叶功能紊乱有关。Bangen等[25]研究发现,T2DM患者执行能力下降与顶下小叶的血流量减少有关,顶下小叶与左侧海马的有效连通性的改变是导致T2DM患者记忆较差的原因之一[26],本研究结果与此一致。有研究报道,缘上回不仅与认知的调控有关,也是对负面情绪进行特异性加工的脑区[27]。本研究中T2DM患者HAMD、HAMA量表评分均高于对照组,表明T2DM患者易出现负面情绪,这种负面情绪的出现可能与缘上回的功能异常活动有关。本研究还发现,T2DM患者右侧小脑Crus I与右侧顶下缘角回间功能连接增强。研究发现,顶下缘角回是阿尔茨海默病和轻度认知障碍患者脑功能受损的主要脑区[28],抑郁症患者在识别悲伤表情时,顶下缘角回与扣带回间FC减低[25],提示顶下缘角回功能紊乱与认知功能和抑郁情绪相关。本研究中,右侧Crus I-右侧顶下缘角回间FC值与糖化血红蛋白呈正相关,提示高血糖可以导致T2DM患者的脑功能异常,控制和监测糖化血红蛋白水平对糖尿病脑病的发生及发展具有重要意义。
本研究的局限性:本研究为横断面研究,尚不能明确不同药物治疗前后患者的脑损伤神经康复机制;由于本研究排除了有严重并发症的T2DM患者,因此尚不能明确T2DM并发症是否会加重脑损伤;另外,本研究仅进行了rs-fMRI研究,未进行脑结构分析。因此,今后的研究应增加纵向随访研究、增加病例数,结合结构像进一步探讨T2DM患者脑损害的神经病理生理机制及神经康复机制。
总之,T2DM患者小脑亚区(高级认知加工及情感功能密切相关的脑区)与大脑多个核心脑区间功能连接异常,提示小脑可能参与T2DM患者脑损伤的神经病理生理机制,尤其是与其认知及情绪功能异常密切相关。

