microRNA-185-5p真核表达载体构建及其对胰腺癌Panc-1细胞增殖的影响
燕 婧,冯 芸,李 丹,高 艺,张 静
(延安大学医学院,陕西 延安 716000)
微小RNA(microRNAs,miRNA)在1981年通过秀丽隐杆线虫的遗传筛选被首次鉴定出来[1],在1993年由Lee等[2]进行了分子鉴定,并且很快被人们意识到其在植物和动物生物学的各个方面都有具有高度保守机制和广泛的功能学意义。miRNA是一类平均长度为20~23个核苷酸的非编码小分子RNA,其广泛存在于真核细胞生物中的,来源于带有一个或多个局部发夹的较长的初级转录本(pre-miRNA),这些发夹被RNA裂解酶(Dicer酶)进一步加工成熟miRNA[3]。目前研究表明,miRNA的主要功能是通过结合目标mRNA的3’UTR的互补序列来调节蛋白的翻译,从而负向调节mRNA的翻译[4],进一步参与肿瘤发生发展中的增殖、凋亡、黏附等各种生物学功能[5]。根据GLOBOCAN 2020统计,胰腺癌致死率极高,在世界范围内约有496 000例新发病例和466 000例死亡病例[6]。预测至2025年,胰腺癌将成为癌症死亡的第三大原因[7]。目前,作为一种毁灭性的恶性肿瘤,胰腺癌可选择的有效治疗方法有限,手术切除或中医调理是目前为数不多的保守治疗的方法[8]。miR-185在肿瘤中也具有重要意义,有研究发现,其在胃癌[9]、乳腺癌[10]、肺癌[11]等肿瘤中都具有抑癌作用。此外也有研究报道miR-185在乙肝纤维化中表达上调,通过靶向SREBF1促进肿瘤的发生发展[12]。在本课题中我们首先成功构建了miR-185-5p的特异性过表达载体。同时测定其在人胰腺癌Panc-1细胞系中的表达活性与效率,通过研究miR-185-5p对Panc-1细胞增殖活力的影响,为日后研究miR-185-5p在胰腺癌中的作用机制提供了新的认识。
1 材料与方法
1.1 实验材料 本研究中的人胰腺癌Panc-1细胞以及Topl0菌株由西安交通大学医学部生物医学实验中心提供;氨苄青霉素(Amp)来自新泰生物公司;从TaKaRa公司购买了酶切和链接所用的限制性内切酶EcoR I、Hind Ⅲ及T4DNA连接酶;真核表达质粒pcDNATM6.2-GW/EmGFP-miR从美国英杰生命技术有限公司购买。
1.2 实验方法
1.2.1 miR-185-5p寡聚核苷酸合成。设计序列:首先在miRbase网站中查找miRNA-185-5p的成熟体序列,然后在该序列两端插入两个酶切位点Hind Ⅲ和EcoR I。序列如下:Topoligo:5’-AATTCAGGGGGC-GAGGGATTGGAGAGAAAGGCAGTTCCTGATGG-TCCCCTCCCCAGGGGCTGGCTTTCCTCTGGTCC-TTCCCTCCCAA-3’;Bo-ttomoligo:5’-AGCTTTGGGAGGGAAGGACCAGAGGAAAGCCAGCCCC-TGGGGAGGGGACCATCAGGAACTGCCTTTCT-CTCCAATCCCTCGCCCCCTG-3’,设计完成后由西安擎科生物科技有限公司进行合成。
1.2.2 真核表达载体的构建与鉴定。双酶切:根据真核表达载体质粒pcDNATM6.2-GW/EmGFP-miR,选取Hind Ⅲ和EcoR Ⅰ在目的序列的两端加入酶切位点序列,形成粘性末端;进行胶回收;连接:用T4DNA连接酶将回收产物与进行退火后的双链miR-185-5p DNA序列置于16 ℃过夜连接;转化:用E.Coli Top10(即Top10感受态大肠杆菌);选择培养:采用氨苄青霉素(Amp+)对重组子进行选择性培养;摇菌:选择单克隆菌落,挑取放在LB(Amp+)液体培养基摇床培养12~16 h后;测序:选擎科生物科技公司进行测序。
1.2.3 细胞培养。将人胰腺癌Panc-1细胞置于DMEM培养基(PAA Laboratories)中(含10%胎牛血清),在37 ℃、5% CO2培养箱中进行培养,培养期间换液频率为2~3 d/次。
1.2.4 细胞转染。转染设置为两组:首先在6孔板中接种Panc-1细胞,待其在对数生长期时,转染对照组空载体(pcDNATM 6.2)和实验组pcDNATM 6.2-GW/EmGFP-miR-185-5p表达载体。
1.2.5 实时定量PCR(qRT-RCR) 。首先提取总RNA,使用Trizol裂解液裂解Panc-1细胞,后将RNA用逆转录试剂盒进行逆转录获得cDNA,使用PCR试剂盒Hieff@Qpcr SYBR@Green Master Mix (上海翊圣生物科技有限公司)在iQ5 Optical real-time PCR system machine (Bio-Rad,USA)上进行实时定量PCR。逆转录和PCR引物序列如下:miR-185-5p RT-primer:5’-GTCGTATCCAGTGCGTGTCGTGGAGTCGGCAATTGCACTGGATACGA-CTCAGGAA-3’;miR-185-5p Forward-primer:5’-ATCCAGTGCGTGTCGTG-3’; miR-185-5p Rev-erse-primer:5’-TGCTTGGAGAGAAAGGCAG-3’;U6-Forward-primer:5’-GCTTCGGCAGCACATAT-ACTAAAAT-3’;U6 Reverse-primer:5’-CGCTTCA-CGAATTTGCGTGTCAT-3’。
1.2.6 CCK8试验。使用CCK8试剂盒(Fudebio-tech,杭州,中国)测定miR-185-5p对Panc-1细胞增殖的影响。 首先在96孔板中接种Panc-1细胞,接种密度为3000个/孔。 转染后分别在24、48、72 h进行检测,将10 μl CCK8试剂添加到每个孔中,然后置于细胞培养箱中,待孵育1 h后,使用酶标仪记录光密度(OD)值为450 nm的荧光吸光度(注意避光),最后绘制相关的细胞生长曲线。
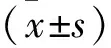
2 结 果
2.1 真核表达载体pcDNATM6.2-GW/EmGEP-miR-185-5p的构建 首先将从公司合成的miR-185-5p DNA单链进行退火连接成双链DNA;然后用琼脂糖凝胶电泳进行鉴定,得出目的条带约90 bp左右(图1A);将大片段的真核表达载体菌株(即pcDNATM6.2-GW/EmGEP-miR)用LB液体培养基进行摇菌扩增,扩增好的菌液提取质粒后进行双酶切(Hind Ⅲ和EcoR I),再次用琼脂糖凝胶电泳鉴定,得出了5000 bp左右的目的条带(图1B),并对大片段进行回收。

A:人工合成miR-185-5p的 DNA oligo退火产物电泳图;B:双酶切pcDNATM6.2-GW/EmGEP-miR后电泳图;M:标记
2.2 pcDNATM6.2-GW/EmGEP-miR-185-5p真核表达载体的鉴定 采用T4DNA连接酶将两个片段连接,进行转化,转化后挑取单个菌落放在含有氨苄青霉素(Amp+)的LB液体培养基中将菌落扩增培养,最后测序,将测序结果与miR-185-5p DNA oligo序列进行比对,可以看出完全相匹配(图2),初步证明构建成功。

图2 pcDNATM6.2-GW/EmGEP-miR-185-5p真核表达载体测序结果
2.3 miR-185-5p真核表达载体在Panc-1细胞中的转染效率检测 将构建成功的pcDNATM6.2-GW/EmGEP-miR-185-5p表达载体转染进Panc-1细胞中,于24 h后进行倒置荧光显微镜检镜观察转染效率(图3A),然后提取RNA,进行实时荧光定量PCR检测(图3B),miR-185-5p的表达量,miR-185-5p的在实验组中的表达水平相对于对照组显著增加(P<0.05)。
2.4 过表达miR-185-5p抑制Panc-1细胞的增殖 将构建成功的pcDNATM6.2-GW/EmGEP-miR-185-5p表达载体转染进Panc-1细胞中,采用CCK8实验检测其对Panc-1细胞增殖能力的影响(图4),发现在Panc-1细胞中过表达miR-185-5p,细胞增殖明显降低(P<0.05),表明Panc-1细胞的增殖能够被miR-185-5p抑制。
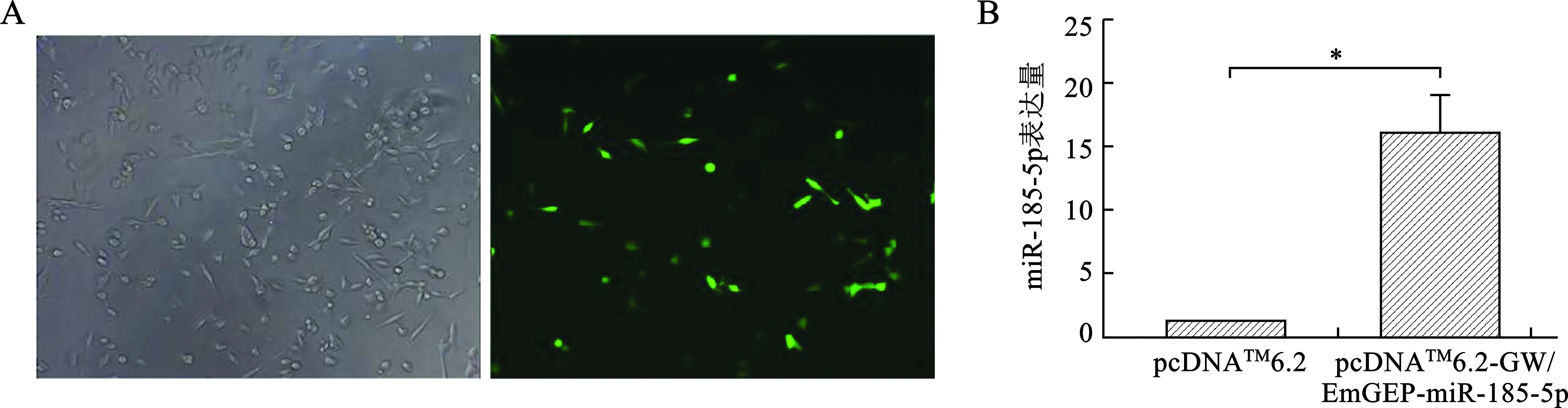
A:荧光观察Panc-1细胞的相差图(右)和荧光图谱(左);B:qRT-PCR验证miR-185-5p的表达(*P<0.05)

注:*P<0.05
3 讨 论
miRNA在肿瘤发生发展中发挥重要作用,它能够通过翻译抑制或着降解信使RNA(mRNA)在动植物中起重要的基因调控作用[13]。广泛性是miRNA的作用特性之一,一种 miRNA 分子可沉默多个靶基因,而这些靶基因可参与调控肿瘤细胞不同的生物学行为,同时它所产生的生物学效应也是多方面的。研究发现,下调miRNA-183能够促进噪声性耳聋发生发展[14]。 有数据表明miR-7-5p、miR-142-3p、miR-221-5p和miR-370-3p具有成为诊断双相情感障碍(BD-Ⅱ)的有用工具的巨大潜力[15]。人们在关于miRNA与癌症发生发展之间的关系研究,在近些年来也取得了很大的进步。例如易亭伍等[16]发现miR-141-3p可以通过靶向KLF9调控鼻咽癌细胞增殖。miRNA 簇是上皮到间质转化(EMT)过程的关键调节器。抑制pro-EMT miRNA簇有利于控制EMT和癌症转移[17]。最新研究发现发现对非侵入性尿液样本中miR-34a-5p和miR-218-5p的表达的评估可以作为宫颈癌早期检测和预后的可靠生物标志物[18]。
miR-185-5p基因位于22q11.21染色体上,同许多功能性的miRNA一致,miR-185-5p也能够参与调节多种生物学功能。有研究发现miR-185-5p可以通过直接靶向CCND2作为口腔鳞状细胞癌OSCC的肿瘤抑制因子[19]。Zhu 等[20]还发现miR-185可以通过靶向Six2来抑制肝细胞癌中的细胞增殖和上皮间质转化。同时miR-185也有促进肿瘤发生的这一相反作用的结果报道。例如,在乙肝纤维化中,miR-185的表达上调,并且可以通过靶向SREBF1来增加Col1A1和α-SMA33的表达[21]。
近几年来研究发现,miRNA和胰腺癌的之间也有相关性。在关于miRNA参与胰腺癌发生发展的研究中发现miR-612作为一种肿瘤抑制因子,能够与5-氟尿嘧啶一起在抑制人Panc-1胰腺癌细胞的生长和迁移以及诱导细胞凋亡方面具有重要作用,被视为胰腺癌治疗的新型治疗方式[22]。同时有学者发现miR-139-3p和miR-196b-5p能够分别通过靶向NOB1和ING5抑制Panc-1细胞凋亡[23]。也有研究表明,miR-448在胰腺癌细胞和组织中下调并且过表达miR-448能够抑制胰腺癌细胞的迁移、侵袭和增殖[24]。
作为一种高度致命的消化系统恶性肿瘤,胰腺癌的发展相关可变风险因素包括肥胖、2型糖尿病和吸烟。据了解,胰腺癌的重要风险因素和先兆之一就是新发糖尿病,相关数据表明,相比长期糖尿病患者,患病时间不到1年的糖尿病患者患胰腺癌几率相对高出大约1~5倍[25]。根治性手术是胰腺癌唯一潜在的治愈性治疗方法。由于与该疾病相关的生存率一直很低,大多数胰腺癌患者的预后仍然严峻。因此迫切需要探索胰腺癌癌变和进展的分子机制以开发有效的胰腺癌治疗方法。
在本研究中,首先我们构建了miR-185-5p的真核表达载体,以真核表达载体pcDNATM6.2-GW/EmGEP-miR为基础,将由公司合成的miR-185-5p的寡聚核苷酸和由Hind Ⅲ和EcoR I双酶切和纯化后的大载体进行连接,将连接产物转化至E.Coli Top10之后,再进行一系列的测序比对,验证出miR-185-5p的体外真核表达载体构建成功;然后构建成功的过表达载体被我们经脂质体转染到Panc-1细胞中,24 h之后,通过倒置荧光显微镜中进行观察,并提取RNA进行qRT-PCR验证转染效率,我们发现转染了真核过表达载体后的Pan-1细胞中miR-185-5p的表达明显增高;通过CCK8实验表明过表达miR-185-5p会抑制人胰腺癌细胞Pan-1的增殖,提示miR-185-5p在胰腺癌中可能发挥抑癌作用。
总之,在本课题中,我们首先成功构建了miR-185-5p的真核表达载体,发现过表达miR-185-5p可能抑制胰腺癌细胞生长,为后续关于胰腺癌的研究奠定了基础。

