射频消融术治疗原发性肝癌患者接受胸腺素α1维持治疗临床价值探讨*
周 颜,李国平,邓 俊,杨美蓉,吴晓霞,张 英,朱宏英,陈 卫
射频消融术(radiofrequency ablation,RFA)对小肝癌的治疗疗效肯定,已被广泛应用于临床[1-3],但治疗后仍存在一定的肿瘤复发率。如何降低RFA术后肝癌的复发是近年来研究的热点。本研究采用经皮超声引导下RFA治疗单个直径≤5 cm的原发性肝癌(PLC)患者,并在术后给予胸腺素α1维持治疗,观察了术后肿瘤复发和生存情况,现将结果报道如下。
1 资料与方法
1.1 一般资料 2012年7月~2016年6月我院诊治的PLC患者75例,男56例,女19例;平均年龄为(54.4±11.3)岁。诊断符合《原发性肝癌诊疗规范(2017年版)》[4],经临床和组织病理学明确诊断,巴塞罗那分期(Barcelona Clinic Liver Cancer staging system)为A期。纳入患者为既往未行手术或放化疗等抗肿瘤治疗的初治患者,为肝内单个病灶且肿瘤最大径≤5 cm,肿瘤分期为Ia期,影像学检查除外门脉或肝静脉等血管侵犯,排除肝外淋巴结或器官转移,有介入手术禁忌或不愿接受手术治疗者。所有受试者签署知情同意书,本研究经我院医学伦理委员会审核通过。
1.2 RFA术 使用上海迈德医疗科技有限公司生产的迈德S-1500肿瘤射频治疗仪,在B超引导下完成射频消融术。局部麻醉,将外科电极经皮插入肝癌病灶,行射频消融。设置消融温度为90~95℃,消融10 min。术中,给予常规镇静、止痛、护肝和对症处理。
1.3 胸腺素α1治疗 在RFA治疗后,给予35例患者胸腺素α1(意大利蒙莎Patheon ltalia S.P.A.培森药厂)1.6 mg皮下注射,1次/d,连续1 w,以后1次/2 d,连续3月。
1.4 随访与近期疗效评估 在RFA术后1月行增强CT和MRI检查,评估疗效。完全消融(CR)是指原病灶坏死完全,肝内无存活病灶。术后每1~2月复查肝脏B超,每3~4月复查肝脏增强CT或MRI。判断肿瘤复发的标准是以发现新生肝癌结节、活动性病灶或者肝内外转移病灶。在治疗后随访36个月。
1.5 外周血淋巴细胞亚群和血清细胞因子检测 使用贝克曼库尔特FC500型流式细胞仪检测外周血CD3+、CD4+、CD8+和NK细胞百分比;采用ELISA法检测血清IL-2、IL-4、IL-10和IFN-γ水平(上述试剂均购自上海信帆生物科技有限公司)。
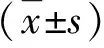
2 结果
2.1 两组临床资料比较 两组性别和年龄(为列出)、是否存在肝硬化、肝功能Child-Pugh分级、肿瘤大小和肿瘤部位比较,差异无统计学意义(P>0.05,表1),具有可比性。
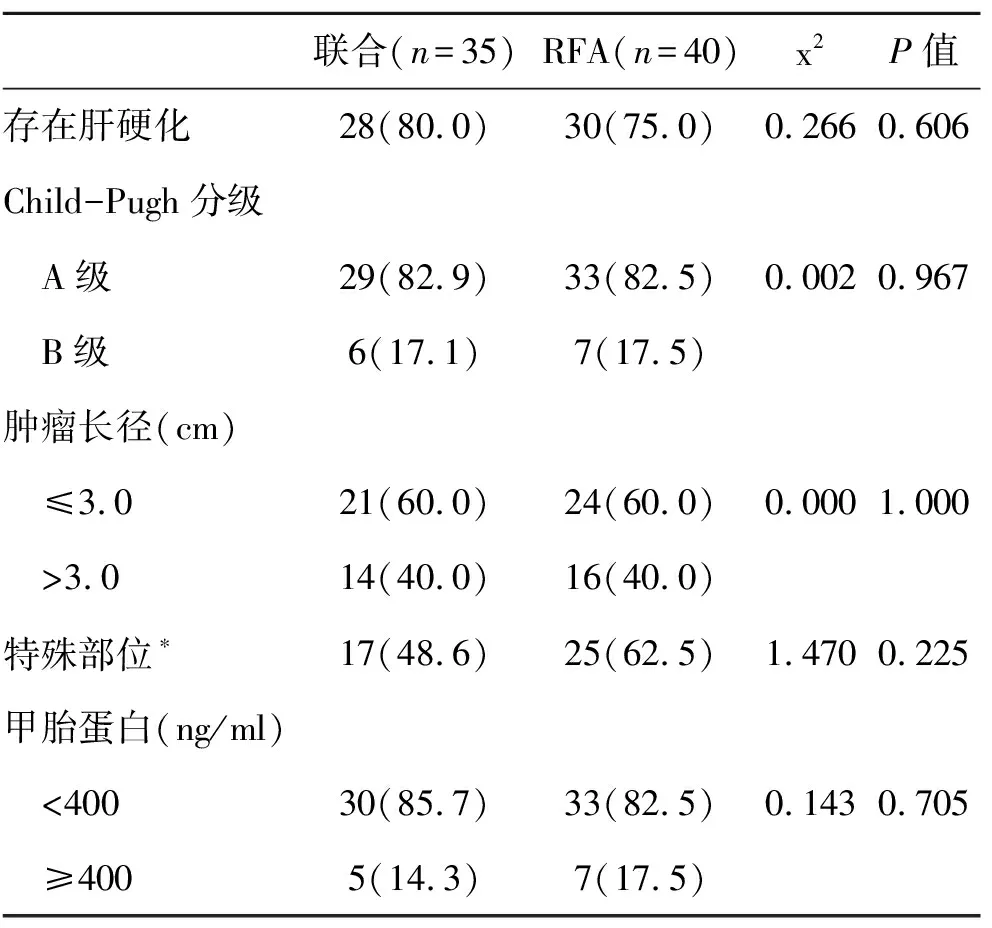
表1 两组临床资料【(n)%】比较
2.2 近期疗效情况 在联合组35例患者中,术后4周经增强CT检查证实28例(80.0%)达到肿瘤完全消融(图1、图2),7例(20%)未完全消融。在一个月内完成补救治疗,结果6例(17.1%)达到完全消融,另1例经肝动脉化疗栓塞术(TACE)治疗后达到完全缓解;在RFA治疗的40例患者,术后两周经增强CT或MRI检查证实33例(82.5%)达到完全消融,7例(17.5%)未完全消融。在一个月内完成补救治疗,经再次消融均达到完全缓解。两组间疗效比较无显著性差异(x2=0.077,P=0.782)。术后,所有患者均未发生出血、感染、胸水等严重并发症。

图1 PLC患者腹部CT表现1:射频消融前;②射频术治疗中;③术后一月,CT检查显示病灶被完全消融

图2 PLC患者腹部影像学表现①射频消融前;②肝穿刺检查;③射频消融术进行中;④射频消融术后一个月复查MRI,提示病灶被完全消融
2.3 两组外周血T细胞亚群和血清细胞因子变化比较 治疗前后,两组外周血T细胞亚群和血清细胞因子水平无显著性统计学差异(P>0.05,表2);在治疗3月末,联合组血清IL-2和IFN-γ水平显著高于RFA治疗组,差异存在统计学差异(P<0.05,表3)。
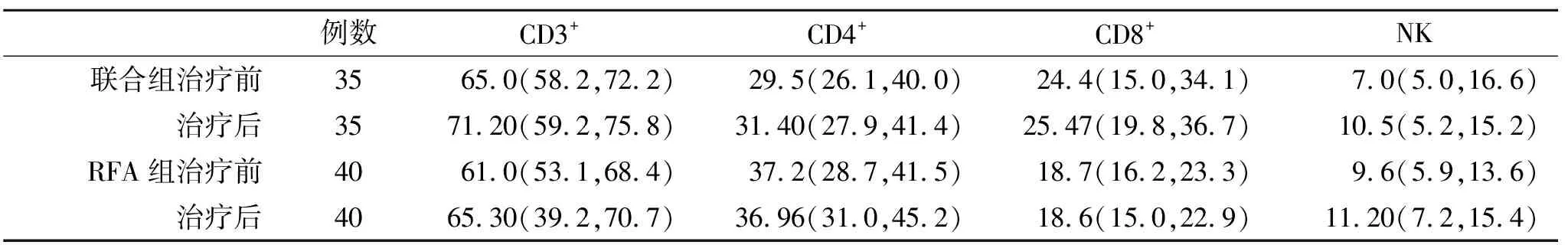
表2 两组T细胞亚群【%,M(P25,P75)】比较

表3 两组血清细胞因子水平【M(P25,P75)】比较
2.4 两组预后比较 联合组中位无复发生存(relapse-Free Survival ,RFS)期为26个月,RFA治疗组为23个月。经Kaplan-Meier生存分析提示两组患者无复发生存率差异无统计学意义(图3)。联合组1 a、2 a和3 a无复发生存率分别为62.9%、28.6%和5.7%,而单行RFA治疗组分别为55.0%、17.5%(P<0.05)和0.0%,提示在RFA术后应用胸腺素α1治疗有一定的效果。多因素分析显示是否应用胸腺素α1治疗、病灶大于3 cm、特殊部位的病灶和治疗后是否获得CR等影响RFA治疗后患者的预后(表4)。
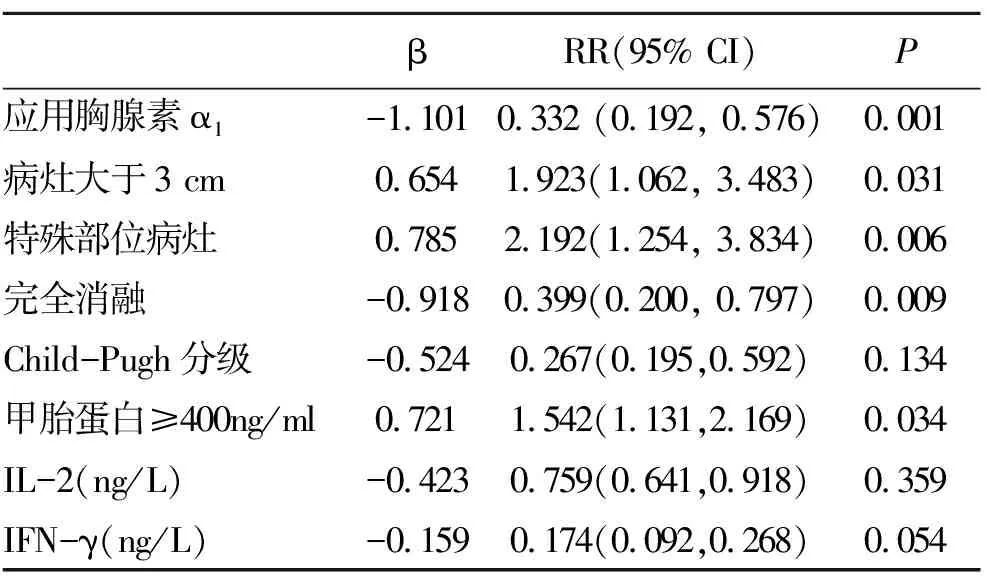
表4 影响RFA治疗的原发性肝癌患者预后的多因素COX回归分析

图3 两组无复发生存曲线
3 讨论
早期肝癌的治疗首选外科手术[5],但由于我国肝癌患者大多有慢性肝病或肝硬化基础,手术切除治疗受到限制,局部消融治疗已被作为这些患者的一线方案[6]。在超声引导下经皮穿刺射频消融治疗因其便捷、微创、安全性高、费用低和恢复时间短等优势得到广泛应用,但仍存在一定的肿瘤复发率。在影响射频消融疗效的因素中,包括肿瘤大小、位置、数量、肝脏的基础情况和手术者的经验等。在如何提高射频消融的治疗效果、降低复发率、延长生存期方面,国内外研究大多主张与其他局部治疗手段联合[7]。研究发现射频消融术后进行替吉奥节拍化疗治疗肝癌可以减缓肿瘤进展,延长肝癌患者的无疾病进展时间[8]。
目前,大量研究表明RFA治疗除了直接灭活肿瘤以外,还通过多种机制提高机体抗肿瘤免疫能力[9,10],包括肿瘤经消融后免疫抑制被缓解、坏死的肿瘤细胞形成“疫苗”[11,12]和诱导特异性细胞毒性T细胞(CTL)的产生等[13]。RFA的热效应使肿瘤抗原发生改变,从而增强肿瘤抗原性[14]。产生HSP70等热休克蛋白,参与肿瘤抗原递呈,从而激发T淋巴细胞介导的机体细胞免疫反应[15],还可能通过局部炎症反应导致免疫反应增强[16]。在此基础上,如何更进一步激发患者抗肿瘤免疫机制以提高疗效、降低复发率、延长生存期,还需要研究。胸腺素α1是人工合成的28个氨基酸的多肽,可以促进T淋巴细胞成熟,诱导成熟T细胞分化为各种不同的T细胞亚群,刺激T淋巴细胞分泌不同种类的淋巴因子增加[17,18],比如干扰素和IL-2等,与多种淋巴因子相互协同增强T淋巴细胞的免疫反应。有研究[19,20]发现经手术或介入等局部治疗的肝癌患者,在联合胸腺素α1维持治疗能不同程度地提高疗效,预防肿瘤复发,延长患者生存期。
在本研究中,联合组共有35例患者在射频消融术后应用胸腺素α1,经三个月的治疗,结果显示,两组近期疗效无显著性差异(x2=0.077,P=0.782)。术前术后两组T细胞亚群无显著性统计学差异,而联合组射频消融术后血清IL-2和IFN-γ水平显著高于RFA治疗组,差异有统计学意义(P<0.05)。IL-2和IFN-γ作为Th1型细胞因子可刺激NK细胞和CTL细胞活化,并促进肿瘤细胞凋亡,具有正性抗肿瘤免疫作用。在射频消融治疗后给予免疫调节治疗可以提高机体抗肿瘤免疫,进一步提升抗肿瘤细胞免疫功能。经随访,免疫治疗患者1 a、2 a和3 a无复发生存率高于未进行免疫治疗者,提示联合使用胸腺素α1治疗通过增强机体的抗肿瘤免疫反应显著降低了射频消融术后肿瘤复发率。
射频消融治疗作为早期肝癌患者的有效治疗手段已被广泛应用。本研究结果显示联合使用胸腺素α1可以进一步提升机体抗肿瘤免疫功能,从而降低射频消融术后肿瘤复发率,延长生存期。当然,本组资料仅为小样本研究,尚有诸多因素可能影响研究结果的可靠性,因此存在较大的局限性,尚需更多更深入的研究观察。

