晶状体蛋白识别互作与白内障的研究进展
林宁钦,姚 克,陈祥军,
(1.浙江大学医学院转化医学研究院,杭州310020;2.浙江大学附属第二医院眼科中心,杭州310009)
白内障是晶状体浑浊导致视力障碍的眼科疾病,是全球致盲的高危因素.2019年,世界卫生组织发布《世界视觉报告(2020)》显示,全球约6520万患者由白内障导致中度、重度远视力损伤或致盲症,且随着全球人口老龄化加速,白内障患病率急剧增加[1].白内障根据晶状体发生浑浊的病理因素,可分为先天性、年龄相关性、代谢性、中毒性和辐射性白内障等.目前,针对不同的病因使用相应的药物治疗未能延缓或者逆转晶状体浑浊,唯一有效的治疗方案仍然是手术治疗.尽管随着显微手术和人工晶状体植入术的日趋成熟,白内障手术已取得显著的疗效[2].但是对于有手术指征的白内障患者,需尽早选择合适的手术时机,特别是小儿白内障,一旦错过最佳治疗时机,可能导致终生视力受损[3].同时,白内障手术也可能会引起各种并发症,如前房出血、后囊膜浑浊及眼内炎等,导致术后视力没有恢复[4].单纯依靠手术治疗将难以应对老龄化造成的白内障盲人日益增多的挑战.因此,研究白内障的发病机理对于发现新的药物靶点、研制新的防治策略具有重要的临床意义.
白内障的发病组织是晶状体.晶状体为透明组织,是眼内唯一具有调节功能的屈光介质.晶状体纤维细胞是晶状体的主要组成部分,其内含有大量的晶状体蛋白.晶状体蛋白可分为α-,β-和γ⁃晶状体蛋白3大亚家族.α⁃晶状体蛋白包括αA和αB晶状体蛋白,属于小热休克蛋白家族,具有分子伴侣功能,可识别晶状体内错误折叠蛋白质,保护β⁃、γ⁃或其它晶状体内蛋白质的正确折叠,抑制蛋白质异常聚集[5].β⁃和γ⁃晶状体蛋白在结构上具有同源性,均由2个结构域组成,每个结构域含有4个“Greek key”基序;在晶状体内作为主要结构蛋白质,β⁃/γ⁃晶状体蛋白高度有序的空间排布在维持晶状体结构功能上发挥关键作用[6].其中,β⁃晶状体蛋白包括3种碱性蛋白质(βB1,βB2和βB3)和4种酸性蛋白质(βA1,βA2,βA3和βA4),以同源或异源寡聚体形式存在;γ⁃晶状体蛋白包括γA,γF和γS,通常以单体形式存在,结构稳定性高于α⁃和β-晶状体蛋白,与晶状体核的硬度相关.晶状体蛋白在晶状体内呈短程有序的空间分布,通过精准识别、分子内或分子间相互作用动态调控晶状体内蛋白质稳态,维持晶状体透明性.
晶状体纤维细胞高度分化,细胞核、细胞器退化,细胞内大分子生物代谢低,因此,物理化学调控的分子识别、蛋白互作在维持晶状体正常生理功能中发挥重要作用.晶状体蛋白半衰期长,且翻译合成后不再更新,广泛受晶状体细胞内外环境因素干扰,影响分子识别、相互作用介导的细胞稳态[7].任何影响晶状体内蛋白质稳态的物理化学因素均会引起晶状体蛋白分子识别、相互作用及生物活性的改变,导致晶状体内蛋白质异常聚集.如酸碱平衡紊乱(pH异常)会导致晶状体蛋白带电性质和空间构象的显著改变[8];氧化还原紊乱或紫外辐射等会诱导超氧化产物和自由基使晶状体蛋白发生氧化变性[9];蛋白质翻译后修饰调控晶状体蛋白的亲疏水性和空间结构等能介导分子识别、相互作用[10].此外,蛋白质液-液相分离是细胞在拥挤环境下调控生物大分子相互作用、生物活性的有效方式[11].晶状体蛋白可通过分子内或分子间相互作用有序调控生物大分子凝聚体动态组装.晶状体细胞内外环境干扰将导致正常液-液相分离进展到液-固相转化,形成不可逆的晶状体蛋白沉积物,与白内障发病机制密切相关[12].因此,针对化学调控晶状体蛋白识别互作的研究将有助于解析晶状体蛋白分子变性、聚集的动态调控网络,理清白内障的致病机制,基于调控晶状体蛋白识别互作的化学因素探索将挖掘有效防治白内障的创新策略.
目前,白内障发病机制的研究大多围绕晶状体蛋白的结构功能和聚集机制等方面[10,13,14],关于晶状体蛋白分子识别互作与白内障发病机制尚未有综合评述.基于此,本文将重点阐明白内障发生发展过程中,晶状体蛋白相互作用介导蛋白质聚集的调控网络,及受pH值、金属离子、辐射损伤、蛋白质翻译后修饰等化学因素影响的动态调控.同时,本文将从晶状体蛋白的分子识别、相互作用的方式、调控因素及研究技术创新等方面进行系统阐述,全面理清晶状体蛋白分子相互作用与白内障发病机制的相关研究.最后,展望了晶状体蛋白识别互作调控网络在白内障药物研发领域的应用价值与挑战.
1 晶状体蛋白识别互作机理
根据晶状体蛋白识别互作对象分类,可以分为晶状体蛋白分子内识别互作、晶状体蛋白分子间识别互作、晶状体蛋白与非晶状体蛋白识别互作.
1.1 晶状体蛋白分子内识别互作
β⁃/γ⁃晶状体蛋白分子内相互作用赋予其极高的溶解度.β⁃/γ⁃晶状体蛋白结构相似,均由2个结构域组成,每个结构域含有4个“Greek key”基序,氢键网络维持β-sheet片层规则排布,稳定“Greek key”基序;分子内部由非极性氨基酸构成紧密的疏水核心,而外部由极性带电氨基酸围绕蛋白质表面形成亲水层,显著提高了蛋白质的溶解度[10].β⁃/γ⁃晶状体蛋白2个结构域间的Loop结构能调控“Greek key”基序间相互作用,在维持自身结构稳定性方面具有重要功能.βB1晶状体蛋白的N端延伸结构域具有分子内伴侣蛋白活性,可保护自身结构稳定及其它蛋白间相互作用[15].βA3晶状体蛋白具有水解酶活性,通过分子内识别互作调控自身水解及蛋白酶活性[16].另外,晶状体蛋白均含有一定数目的半胱氨酸,巯基基团在维持晶状体内氧化还原平衡方面发挥重要作用.同时,半胱氨酸易被氧化生成分子内二硫键,错误二硫键的形成也会导致蛋白质聚集和沉淀,引发晶状体浑浊[17].
1.2 晶状体蛋白分子间识别互作
在晶状体内拥挤的环境下,晶状体蛋白致密、有序排列,蛋白质-蛋白质精准识别互作在维持蛋白质稳态方面扮演着重要角色.α⁃晶状体蛋白由αA和αB亚单位以约3∶1的方式组成异源寡聚体.同时,α⁃晶状体蛋白通常以大寡聚态形式存在发挥分子伴侣活性,识别错误折叠晶状体蛋白,维持晶状体蛋白正确结构[5].对于β⁃晶状体蛋白,晶状体蛋白常形成复杂的寡聚结构,可以是同源寡聚体,也可以是酸性和碱性亚单位之间组成的异源寡聚体.β⁃家族晶状体蛋白形成寡聚体的过程是可逆的,通过分子间亚基交换来实现动态平衡,这种结构的灵活性有助于维持晶状体的稳定性[18].γ-晶状体蛋白通常以单体形式存在.这3种晶状体蛋白家族彼此之间平衡的相互作用是维持晶状体透明性的分子基础(图1).
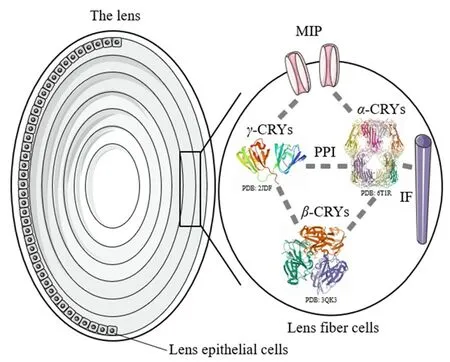
Fig.1 The eye lens structure and examples of the intracellular crystallins recognition and protein⁃protein interaction(PPI)
1.3 晶状体蛋白与非晶状体蛋白识别互作
晶状体内非晶状体蛋白主要包括细胞骨架蛋白和细胞膜蛋白等,这些非晶状体蛋白与晶状体蛋白存在识别、互作,形成复杂而精确的蛋白质相互作用网络,共同维持晶状体细胞结构稳定(图1).其中,细胞骨架蛋白[如肌动蛋白(Actin)、肌球蛋白(Myosin)和中间纤维(IF)等]参与保持细胞正常形态.α⁃晶状体蛋白与细胞骨架蛋白识别互作可调控晶状体细胞骨架的装配和解装配过程[19].αB晶状体蛋白与肌动蛋白结合可有效防止细胞应激诱导的蛋白聚集,其结合能力强弱取决于其磷酸化状态[20].在高温等应激条件下,αB晶状体蛋白可与中间纤维直接互作来维持细胞骨架的稳定性[21].主要内在蛋白(MIP)在晶状体纤维细胞中表达丰富,是细胞膜上的一类具有选择性运输水分的特异孔道蛋白,是调控水分进出晶状体的最主要的途径,维持其透明性[22].MIP与γE晶状体蛋白具有特异性相互作用,可将γE晶状体蛋白募集至细胞膜上,为MIP与γ⁃晶状体蛋白之间的功能联系提供了证据[23];同时,γ⁃晶状体蛋白不仅存在于晶状体的核区,还存在视网膜上,表明γ⁃晶状体蛋白可能还具有除了结构蛋白以外的功能[24].
1.4 晶状体内蛋白质液-液相分离
蛋白质液-液相分离(LLPS)指的是在溶液中,蛋白质分子之间不断聚集,当达到溶解极限时,分子就会以液滴的形态从溶液中析出,这是一种细胞内蛋白质的高效聚集方式,也是无膜细胞器和生物分子凝集体形成的重要机制[11].晶状体中蛋白质占湿重的35%,是机体内蛋白质浓度最高的组织,纤维细胞内微环境极其拥挤,并且细胞内的核和其它细胞器都已退化,相分离驱动的无膜细胞器有助于维持晶状体纤维细胞正常代谢.研究表明,在一定温度和压力等外界条件下,晶状体蛋白分子通过多价相互作用,可特异性聚合成非共价结合物,生成无膜的蛋白液滴体系,以适应外界环境变化.在低温条件下,牛γB晶状体蛋白会发生相分离,可以观察到晶状体蛋白相互聚集形成高浓度的球形蛋白液滴[25].此外,在磷酸盐缓冲液中加入聚乙二醇,以模拟细胞内拥挤环境,会促进牛γS晶状体蛋白产生相分离现象[26].在含有γD和βB1晶状体蛋白的水溶液中会出现这2种蛋白的相分离现象,并且随着βB1晶状体蛋白的浓度增加,相分离临界温度降低,表明可以通过调控γD和βB1晶状体蛋白分子间相互作用来影响相分离的形成[27].最近,Cinar等[28]发现在低温和高压条件下,γD晶状体蛋白的相分离液滴会发生解聚,恢复均一的溶液状态(图2).这可能是深海鱼类预防冷致白内障的机制,并且在这些鱼类体内中发现的氧化三甲胺(TMAO)能够调控相分离的形成,维持相分离液滴的稳定性.

Fig.2 Pressure⁃dependent droplet formation and dissolution in the LLPS process[28]
2 晶状体蛋白识别互作的化学调控
2.1 酸碱平衡
酸碱平衡是几乎影响到所有蛋白质分子表面电荷分布和构象变化的关键因素,许多蛋白质-蛋白质相互作用都会受到pH值的调控.正常情况下,晶状体细胞内的pH值维持在7.4左右,越靠近晶状体核,pH值越低.这是因为晶状体核内无氧糖酵解产生H+,晶状体内存在离子交换系统,如Na+-H+和Cl−-HCO3−等有助于调节晶状体内的pH值[29].Wang等[30]发现,在pH=3条件下,γC晶状体蛋白的聚集过程是通过诱导形成部分未折叠中间体,再聚集形成蛋白沉淀.Mohr等[31]探究了pH值变化对γD和γS晶状体蛋白的影响.当pH值高于其等电点时,晶状体蛋白表面带有负电荷,使蛋白分子间产生静电排斥作用力,不易形成聚集体.在酸性条件下,与晶状体细胞膜结合的αA和αB晶状体蛋白量会增加,导致晶状体内可溶性α晶状体蛋白含量逐渐减少[32].
2.2 金属离子
晶状体内的Na+,Ca2+和Cu2+等必需金属元素的含量均随着晶状体的老化而增加,这些金属离子平衡浓度的破坏对晶状体蛋白分子相互作用具有一定的影响,并且Zn2+和Hg2+等重金属离子对晶状体有毒性作用,可以使晶状体蛋白解折叠,暴露其内部的疏水性基团,从而增大分子间疏水相互作用,长期接触这类金属容易发生白内障[33].研究表明,β⁃/γ⁃家族晶状体蛋白属于钙结合蛋白,对维持细胞内钙离子平衡具有重要作用[34].Quintanar等[35]探究了Cu2+和Zn2+对γD晶状体蛋白稳定性的影响,结果显示,Cu2+和Zn2+能够诱导γD晶状体蛋白聚集形成蛋白沉淀.Ramkumar等[36]也报道了类似的结果,认为Cu2+主要通过氧化半胱氨酸残基诱导γD晶状体蛋白发生交联聚集.Calva等[37]发现Hg2+可以诱导γC和γS晶状体蛋白变性,破坏蛋白质的二级结构,通过分子间二硫键交联形成不溶性蛋白聚集体.
2.3 辐射损伤
辐射损伤主要包括来自γ射线、X射线和紫外线等的电离辐射,晶状体对紫外线的透过率较低,可降低视网膜的光损伤,但晶状体对紫外线的吸收随年龄的增长而增加,紫外线辐射对晶状体蛋白产生损伤的机制主要是通过光化学反应生成自由基引起的氧化损伤[38].Kim等[39]报道低剂量γ射线辐射可以使γE和γF晶状体蛋白上的色氨基酸和甲硫氨酸残基发生氧化,导致晶状体蛋白的相互作用改变,诱发辐射性白内障.紫外线辐射也会使α晶状体蛋白上色氨酸残基大量被氧化,降低α晶状体蛋白的分子伴侣活性[40].Honisch等[41]研究了紫外线辐射对猪水溶性晶状体蛋白稳定性的影响,紫外线辐射可诱导产生活性氧,致使水溶性蛋白分子间形成二硫键,并聚集形成高分子量不溶性蛋白沉淀(图3).
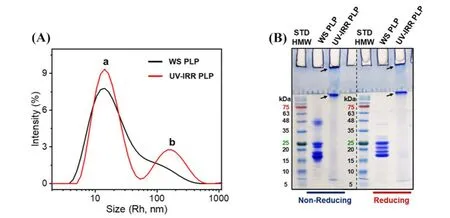
Fig.3 Aggregation of UV⁃irradiated water⁃soluble lens proteins[41]
2.4 晶状体蛋白翻译后修饰
由于晶状体蛋白的半衰期长,合成后的晶状体蛋白会终身存在于细胞内,容易发生脱酰胺化、氧化损伤、糖基化和磷酸化等化学修饰,这些不同类型的蛋白质翻译后修饰会改变蛋白质的电性、疏水性和空间结构等属性,导致蛋白质溶解性降低,蛋白发生交联,最终形成蛋白沉淀、晶状体混浊.
2.4.1 脱酰胺化 脱酰胺化是指天冬酰胺或谷氨酰胺残基侧链上的酰胺基被带负电荷的羧基取代的过程.脱酰胺化修饰会引入负电荷,改变晶状体蛋白表面的电荷分布,破坏蛋白-蛋白间的相互作用,导致晶状体蛋白溶解度下降.研究表明,脱酰胺化会降低αA和αB晶状体蛋白的分子伴侣活性,同时抑制两者互作形成异源寡聚体[42].在βB2晶状体蛋白中,脱酰胺化修饰会降低蛋白结构的稳定性,并使αA晶状体蛋白无法与其识别结合形成可溶性高分子聚合物[43].脱酰胺化修饰也会影响βA3和βB1等晶状体蛋白的稳定性,破坏正常的蛋白-蛋白相互作用[44,45].脱酰胺化修饰还会破坏γS和γD晶状体蛋白结构的稳定性,导致分子间相互作用的失衡,出现核性白内障[46,47].
2.4.2 氧化损伤 目前公认的白内障主要病理因素之一是氧化应激.在正常人的晶状体和房水中均存在一定含量的氧化物质,如过氧化氢、氧的某些代谢产物超氧阴离子自由基和羟自由基等.同时,晶状体内也含有相应的抗氧化物质保护其免受氧化损伤,如还原型谷胱甘肽(GSH)中的巯基能保护晶状体蛋白的巯基不被氧化成二硫键,超氧化物歧化酶和过氧化氢酶等参与将自由基和过氧化氢还原成水,生理状态下二者处于动态平衡[48].此外,α晶状体蛋白在氧化应激条件下可发挥分子伴侣功能,保护其它晶状体蛋白免受氧化损伤.当晶状体内氧化物质产生过多或清除这些物质的能力下降时,会破坏晶状体的抗氧化屏障,并产生各种自由基,氧化晶状体蛋白氨基酸残基中的巯基,在蛋白分子内部或者分子间形成二硫键,导致蛋白质发生共价交联、聚集成不溶性蛋白沉淀[13].αA晶状体蛋白含有2个半胱氨酸,可被氧化形成分子内二硫键,交联形成更大的寡聚体,氧化后的寡聚体仍具有分子伴侣活性[49].Fan等[50]在谷胱甘肽基因敲除小鼠模型中探究了氧化应激在白内障发生中的机制,发现在βB2晶状体蛋白中的Cys38和Cys67以及γD晶状体蛋白中的Cys19被氧化形成分子间二硫键,证实了二硫化物交联形成与晶状体蛋白聚集机制有关.Zhao等[51]报道了γD和γC晶状体蛋白在紫外线或过氧化氢等处理后,半胱氨酸残基易被氧化,使晶状体蛋白发生交联聚集.γS晶状体蛋白发生氧化损伤后,通过分子间或者分子内二硫键共价结合成二聚体,进而使γS晶状体蛋白聚集[52].
2.4.3 非酶促糖基化 蛋白质糖基化修饰是一种非酶促的翻译后修饰过程,由低聚糖以糖苷的形式与晶状体蛋白的赖氨酸残基发生共价结合,晶状体蛋白被糖基化的程度同时取决于其内所含赖氨酸的数量和位于蛋白分子表面位置的可接触性,在年龄相关性白内障和糖尿病性白内障的发病进程中起着重要作用[10].糖基化反应最终形成的糖基化终末产物会导致非色氨酸荧光的生成和非二硫键共价交联形成,可引起晶状体蛋白发生交联反应,形成二聚体、三聚体、四聚体乃至高分子量聚合物[53].糖基化修饰会导致α⁃晶状体蛋白的结构发生改变,降低其分子伴侣活性,使其抑制变性蛋白聚集的功能减弱[54],并且糖基化后的αA晶状体蛋白与γD晶状体蛋白结合后会促进糖基化终末产物的交联聚集[55].高糖条件可诱导γB晶状体蛋白发生糖基化修饰,并促进其非二硫键共价结合成二聚体,但晶状体蛋白的结构没有明显改变[56].同样地,γD晶状体蛋白也容易发生糖基化修饰,引发蛋白质聚集[57].
2.4.4 磷酸化 蛋白质磷酸化是指由蛋白质磷酸化酶将ATP或GTP的γ位磷酸基转移到底物蛋白质的氨基酸残基上,这是一个可逆的修饰过程,可调控信号转导及细胞周期等生命活动.由于在磷酸化过程中,蛋白质氨基酸侧链引入了一个带负电的磷酸基团,会诱导蛋白质的空间构象发生改变,进而改变与其它蛋白分子的相互作用.研究表明,晶状体蛋白的磷酸化与去磷酸化过程的失调与白内障的形成相关[58].当αB晶状体蛋白的Ser45基团发生磷酸化,会影响二聚体的形成,导致其分子伴侣活性降低,且与底物蛋白的结合增强,形成高分子量的聚集体[59].在白内障患者的晶状体中,β家族晶状体蛋白发生磷酸化修饰的比例最高,以βB1和βB2晶状体蛋白为主,提示人晶状体蛋白磷酸化修饰会导致晶状体蛋白聚集沉淀[60].
表1汇总了白内障中常见的晶状体蛋白质翻译后修饰类型[36,43~46,49~52,54,56~71].
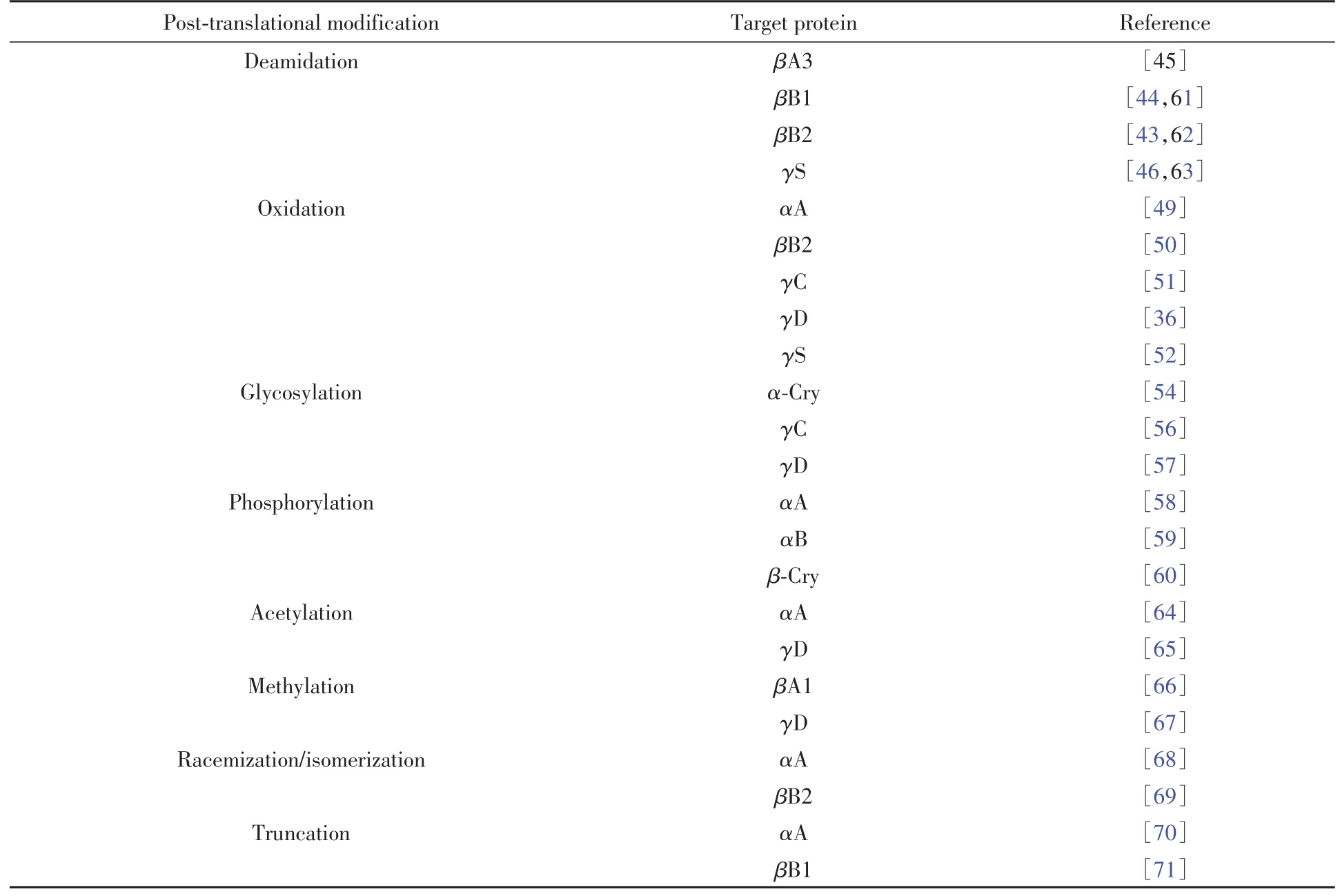
Table 1 Examples of post-translational modifications and their target protein in cataract
3 晶状体蛋白识别互作的研究技术
晶状体蛋白识别互作过程较为复杂,需要通过多种技术进行联合解析.目前常用的技术包括荧光光谱法、圆二色光谱法、核磁共振光谱法及分子对接等.
3.1 荧光光谱法
荧光光谱法是研究晶状体蛋白识别互作的重要手段,可以分为2种:(1)通过测定蛋白质分子本身的内源性荧光,如色氨酸、酪氨酸、苯丙氨酸残基等具有固有发射荧光;(2)通过非共价或者共价作用向蛋白质分子内引入荧光探针,通过检测外源荧光的变化来推断蛋白质构象的改变.Wang等[72]利用内源性色氨酸荧光光谱分析了γS-F30S晶状体蛋白突变体的结构变化.突变导致γS晶状体蛋白上色氨酸残基周围的微环境发生变化,降低了晶状体蛋白的稳定性,并更容易发生蛋白聚集.Liang等[73]使用荧光共振能量转移的方法研究了αA晶状体蛋白与γC-T5P晶状体蛋白突变体之间的相互作用,发现αA晶状体蛋白能够识别结合由热应激诱导的γC蛋白聚集体,形成可溶性晶状体蛋白聚合物.Khago等[74]使用ANS荧光探针法比较了γS-WT晶状体蛋白和γS-G18V晶状体蛋白突变体疏水面暴露的状态.研究发现,与γS-WT晶状体蛋白相比,γS-G18V突变体的N端结构域的疏水面暴露增加,分子间疏水相互作用力增强,导致蛋白分子异常聚集.
3.2 圆二色光谱法
远紫外圆二色光谱主要反映蛋白质二级结构的信息,包括α-螺旋、β-折叠及β-转角的含量等;而近紫外圆二色光谱则提供蛋白质三级结构的信息.圆二色光谱法也常被用于表征晶状体蛋白的相互作用.Liang等[75]使用圆二色光谱法研究了热变性对αA晶状体蛋白聚集的影响,发现αA晶状体蛋白分子表面的β-折叠数量增加,导致蛋白分子之间疏水相互作用增大而聚集形成蛋白沉淀.Fu等[76]通过圆二色光谱法分析了Hsp27蛋白对αB晶状体蛋白的保护作用,发现Hsp27蛋白能够结合热应激诱导条件下的αB晶状体蛋白,维持αB晶状体蛋白的稳定性.
3.3 核磁共振波谱法
核磁共振波谱法通过检测分子结构中标记的碳元素的化学移位,可直接分析晶状体蛋白分子是否发生相互作用或构象改变.Barnwal等[77]使用核磁共振波谱研究了不同温度下晶状体蛋白的聚集过程.当温度降低至15℃时,β⁃/γ⁃晶状体蛋白之间相互作用发生改变,诱发冷致白内障.Kingsley等[78]应用核磁共振波谱分析了αB晶状体蛋白与γS-WT和γS-G18V晶状体蛋白之间的相互作用,研究发现,与γS-WT晶状体蛋白相比,αB晶状体蛋白与γS-G18V突变体的结合力更强,有利于防止突变体蛋白聚集形成蛋白沉淀.最近,He等[79]借助核磁共振波谱法表征了γS晶状体蛋白的构象变化,发现ATP能够增加γS晶状体蛋白构象的稳定性,抑制晶状体蛋白在高浓度条件下发生异常聚集.
3.4 分子对接和分子动力学模拟
分子对接是一种模拟分子间相互作用的方法,通过几何匹配和能量匹配来确定配体与受体结合的最佳构象,补充了晶状体蛋白分子间作用的实验数据.分子动力学模拟是在原子水平上研究蛋白质的空间结构随时间动态变化的过程,可以得到构象变化和蛋白质折叠的信息[80].Das等[81]应用分子动力学模拟来研究γD晶状体蛋白二聚体的聚集过程,发现γD晶状体蛋白分子通过连续域交换C端β链,导致蛋白异常聚集.Chang等[82]使用分子对接和分子动力学模拟等技术进一步探讨了酸性条件对γD晶状体蛋白聚集过程的影响.结果显示,在酸性条件下,γD晶状体蛋白表面的电荷分布发生变化,并在C端柔性环区域产生反向平行的β链,改变蛋白质分子之间的相互作用,导致晶状体蛋白出现不可逆聚集.
3.5 蛋白质液-液相分离跟踪技术
用于跟踪蛋白质液-液相分离现象的主要是荧光漂白恢复技术(Fluorescence recovery after photo⁃bleaching,FRAP).该技术的原理是利用荧光物质标记蛋白后,使用高能量激光束将细胞内某一特定区域的荧光猝灭;由于细胞质中蛋白质呈自由运动状态,邻近的荧光标记物会不断向光漂白区迁移,使荧光漂白区的荧光强度逐渐恢复,因而FRAP技术能够用于定量研究液滴组分重建的动力学过程[83].此外,还需要其它方法来表征液滴的基本性质:(1)液滴的形貌.通过显微镜来直接观察液滴的形态是否为光滑球形,大小是否为微米级别,以及测量溶液中液滴产生的浊度变化;(2)液滴融合.同样通过显微镜在活细胞中观察到小液滴融合成大液滴的现象,或者液滴分离的现象.随着越来越多的参与相分离的蛋白质被发现,基于这些蛋白质都含有固有无序区域(Intrinsically disordered region,IDR)等结构特征,研究人员开发了多种用于预测相分离蛋白质的分析工具,如PSPer[84,85],有助于在较短周期内筛选获得能够在细胞内发生相分离的蛋白质.
4 总结与展望
晶状体蛋白是晶状体纤维内唯一稳定的结构蛋白,且其半衰期长,存在于整个生命过程中.晶状体内部的分子结构主要是由晶状体蛋白之间的瞬时短程相互作用参与构筑及维持,通过在时空上精确调控蛋白相互作用的动态变化,形成一个蛋白浓度由中心向两边逐渐降低的空间分布,从而维持晶状体的屈光功能.因此,晶状体蛋白之间复杂的识别互作网络一旦受到细胞内外因素的干扰,极易导致晶状体蛋白的有序排列发生紊乱.晶状体蛋白受到诸多物理化学因素的干扰(图4),pH值是影响蛋白质分子表面电荷分布和构象变化的重要因素,参与调控蛋白相互作用的过程.晶状体蛋白与金属离子结合或者受到辐射损伤后会使晶状体蛋白暴露其疏水面,降低晶状体蛋白的稳定性.常见的蛋白质翻译后修饰包括脱酰胺化、氧化损伤、糖基化和磷酸化等化学修饰,其中氧化损伤会导致蛋白质发生共价交联,聚集成白色沉淀,使晶状体出现浑浊.此外,蛋白质液-液相分离是近年来在生命科学领域迅速发展起来的新概念,是一种细胞内蛋白质的高效聚集方式.在低温和高压的条件下,γ⁃晶状体蛋白会自发驱动产生相分离现象,可能参与晶状体内代谢调控,一旦环境因素干扰蛋白分子之间相互作用的精准性、动态性,将导致晶状体蛋白沉积形成固体状.
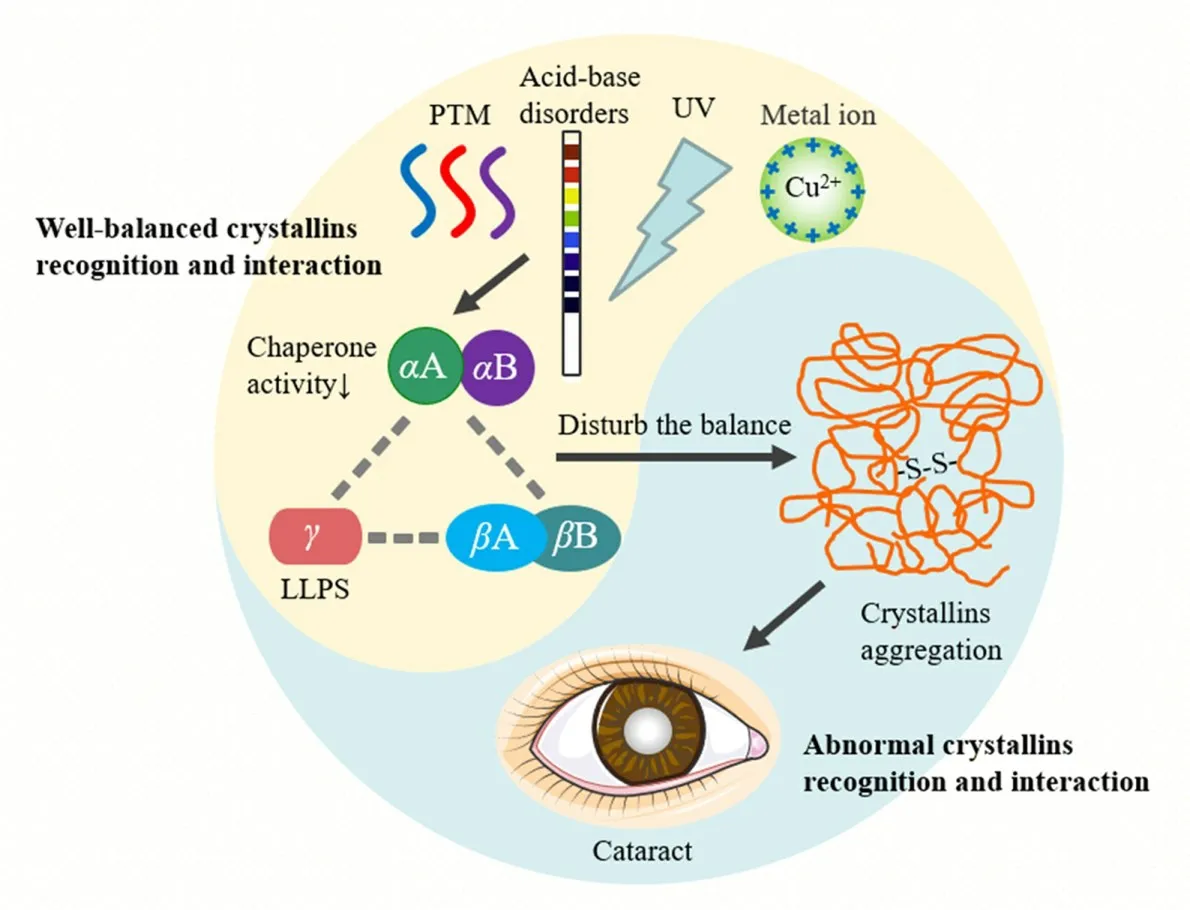
Fig.4 Chemical factors disturb the well⁃balanced crystallins recognition and interaction and lead to the aggregation of the crystallins
晶状体内的晶状体蛋白通过相互作用形成一个精确调控的多维、动态的网络,以维持细胞内蛋白质稳态及晶状体的高度透明性.利用化学调控晶状体蛋白相互作用能够模拟白内障发生时晶状体蛋白的生化改变,用以揭示介导这些蛋白相互作用的关键结合区域.全面了解晶状体蛋白相互作用网络,不仅能够在晶状体内复杂环境中识别晶状体蛋白相互作用的对象,还可以精确定位蛋白质的结合区域,促进发现调控蛋白相互作用的关键环节,为寻找药物治疗白内障的靶点提供新的途径.目前,已报道一些针对调控蛋白相互作用的药物,如羊毛甾醇通过范德华力结合γD晶状体蛋白的疏水界面,使蛋白聚集体发生解聚[86]及提高α晶状体蛋白的分子伴侣活性.然而,蛋白质相互作用的方式和调控网络极其复杂,依靠现有的分析技术得到的信息仍有限,需要有更先进的方法来捕捉晶状体蛋白之间的瞬时相互作用.随着识别蛋白相互作用结合区域新技术的不断出现[87,88],整合运用生物信息学方法,深入研究晶状体蛋白相互作用网络的精确调控机制,将有助于开发有效的潜在抗白内障药物,从而开拓防治晶状体浑浊的创新策略.
感谢浙江大学附属二院眼科中心吴炜、徐靖杰和浙江大学附属儿童医院胡丽丹对本论文的宝贵建议.