基于核酸适体的外泌体分子识别研究进展
黄 玲,庄梓健,李 翔,石沐玲,刘高强
(中南林业科技大学林业生物技术湖南省重点实验室,森林资源生物技术湖南省国际科技创新合作基地,长沙410004)
外泌体(Exosomes)是活细胞分泌的包含内腔的脂双层膜结构的球形小体(直径30~150 nm).细胞通过内体膜的向内出芽,形成含有多个内囊泡的多泡体,然后通过细胞内的微管转运与膜锚定过程,最终质膜融合并释放内囊泡到胞外从而形成外泌体(图1).
外泌体是细胞间信息的重要传递者,可通过传递各种蛋白质、生物活性脂质和遗传信息来改变受体细胞的表型和功能[1].纳米尺寸的外泌体所携带的物质的多样性、外泌体内包装分子的性质以及外泌体与靶细胞或组织之间的强大相互作用已使其成为内环境平衡和疾病发病机制中的关键角色.此外,肿瘤衍生的外泌体包含各种有用的生物学信息,其医学鉴定依赖于膜表面蛋白的特定识别,被视为癌症诊断和预后评估的非侵入性生物标志物.

Fig.1 Biogenesis and composition of exosomes
1 外泌体的化学组成
外泌体通常携带来自母细胞的大量生物分子,包括蛋白质、脂质和核酸,并在多种体液环境中存在,如尿液、血液、母乳、脑脊液、唾液、胆汁、腹水、眼泪、精液和羊水等[2].外泌体曾一度被认为是细胞外DNA分泌的载体.2019年,Jeppesen等[3]在前人研究的基础上,对外泌体组成进行了重新评估,明确蛋白质、RNA和DNA在外泌体和非外泌体性胞外物质之间的分布差异,确定了小型外泌体不是活性DNA释放的载体[3].并提出了不依赖外泌体而依赖自噬和多泡内体的细胞外dsDNA和组蛋白的主动分泌机制.因此,下文以学界得到广泛认可的蛋白质、脂质、RNA 3类物质为代表,讨论外泌体的化学组成.
1.1 蛋白质
蛋白质是组成外泌体的重要分子之一.外泌体的蛋白质组分分为2类:一类是维持外泌体的结构和基本功能的普遍存在的蛋白质,大部分与细胞内吞网络和多泡体生物合成相关,反映了外泌体生物发生过程,例如细胞骨架蛋白、膜转运和融合蛋白、热休克蛋白、四次跨膜蛋白超家族(如CD63、CD81)等.通常认为四次跨膜蛋白超家族是外泌体特有的标记蛋白,有一些常用的内参标记蛋白也广泛存在于各类细胞的外泌体中,如Alix蛋白[4~7]和HSP70蛋白[8]可用于鉴定分离出的外泌体的粗产物.2021年,Kugeratski等[9]在鉴定外泌体的核心蛋白质组时发现Syntenin-1蛋白为外泌体中最丰富的蛋白质(图2),可作为外泌体潜在的生物标志物.
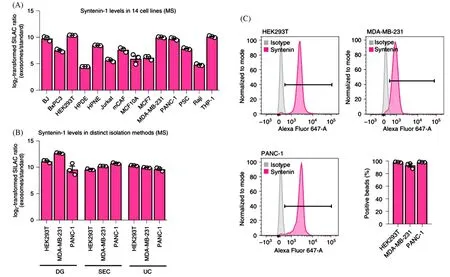
Fig.2 Representative results of the identification of Syntenin⁃1 as a consistently abundant protein in exosomes from different species and biofluids[9]
外泌体的另一类蛋白质具有功能特异性,具体的蛋白种类与外泌体的细胞来源有关.外泌体蛋白提供了关于微环境的发展和转移的重要特定信息,如最近的研究证明TSG-101存在于几乎所有来自尿液的外泌体中[10].Lyden等[11]发现肿瘤源外泌体被器官特异性细胞吸收,为肿瘤转移做好准备,而且外泌体整合素可用于预测肿瘤在器官中的特异性转移.Zhang等[12]研究发现,来自于鼻咽癌(NPC)细胞且呈LMP1-阳性的外泌体可诱导受体NPC细胞增殖和侵袭并抑制凋亡,尤其是促进放射抗性.这使得少数表达LMP1的细胞可以通过潜在影响感染宿主和调节肿瘤微环境来增强NPC细胞的放射抗性.
外泌体表面的蛋白质在免疫应答、细胞迁移、细胞分化和肿瘤侵袭中起着重要作用,因此,它们可以作为非侵入性诊断的生物标志物[13].一些特异性蛋白如GPC-1在胰腺癌细胞的外泌体上过度表达,且具有优秀的特异性,这使得对GPC-1阳性循环外泌体的检测可用于区分健康人、胰腺良性疾病患者和早期、晚期胰腺癌患者疾病并监测治疗反应.因而GPC-1被认为是用于胰腺癌诊断的新生物标记[14].CD109蛋白在NPC细胞系和肿瘤组织源外泌体中都观察到高水平的表达,但在正常组织中没有,因此可作为一种优秀的NPC诊断生物标记[4].酪氨酸激酶7(PTK7)仅在人急性淋巴细胞白血病细胞源外泌体表面会出现高水平的表达,因而可作为一种很有前景的液体活检生物标记[15].非小细胞肺癌细胞系A549细胞源外泌体上的CD81和CD9蛋白可作为此病症诊断的特异性蛋白[16].Goel等[17]在结直肠癌SW480细胞源外泌体中发现,标记蛋白A33会在患者体内富集,因此其可作为判断结直肠癌的特异性生物标记.
一些蛋白质并不会只存在于一种源外泌体中,而会普遍存在于一类相似的外泌体中.研究发现,CD63和CD9是癌细胞源外泌体上普遍存在的跨膜蛋白.EpCAM广泛存在于乳腺癌MCF-7细胞、宫颈癌HeLa细胞和非小细胞肺癌A549,H460和H1299细胞的外泌体中[18],且尤其在在乳腺癌细胞系和HeLa细胞外泌体中进行高丰度表达.CD63是在乳腺癌细胞系中普遍存在的外泌体生物标志物,与EpCAM和MUC1相比,CD63的表达更丰富[8].此外,MCF-7、HepG2、HeLa和Ramos细胞衍生外泌体表面还存在一种HER2蛋白,但与其它EpCAM、CD63和MUC1相比,表达此蛋白的水平较低[19].这些特性使得初步鉴定病症变得更加便捷,且通过外泌体各类蛋白表达丰度的不同,可区分不同的细胞系或细胞,并可在靶向治疗时作为潜在的靶点.
1.2 脂 质
外泌体的膜结构决定其富含磷脂类、鞘脂类、胆固醇类等相关脂质.同时,外泌体含有的脂质载体(如脂肪酸结合蛋白)能够辅助外泌体运输具有生物活性的脂质.外泌体的脂质成分与其来源细胞的种类相关,但不同脂质成分的比例与来源细胞相比有一定差异.外泌体所含鞘磷脂和胆固醇的比例较其来源细胞更高,提示外泌体可能具有调节受体细胞内稳态的功能[20].Nishida-Aoki等[21]从细胞中的19类脂质中鉴定出484种脂质,从外泌体中鉴定出229种脂质,并揭示了特定脂质种类的选择性富集.通过比较细胞和外泌体之间以及具有不同转移频率的细胞之间的脂质成分,发现低转移MDA-MB-231-luc-D3H1(D3H1)和高淋巴结转移MDA-MB-231-luc-D3H2LN(D3H2LN)的外泌体中胆固醇和鞘磷脂的摩尔分数较高,而磷脂酰胆碱的摩尔分数较低.同时发现D3H2LN-外泌体中的不饱和二酰甘油物种比D3H1-外泌体中的不饱和二酰甘油物种上调,而细胞中的不饱和二酰甘油物种的数量没有增加.这进一步证实了富含二酰甘油的外泌体具有诱导内皮细胞PKD/PKC和PKCδ磷酸化的生物活性,从而刺激新生血管生成.越来越多的研究表明,外泌体的生物活性不仅存在于其蛋白质和RNA中,还存在于其脂质分子中.
1.3 RNA
2007年,Valadi等[22]发现外泌体介导的mRNAs和microRNAs的转运,从而揭示了细胞之间基因交流的新的机理,并以此引发了外泌体内含RNA研究的热潮.外泌体中含有丰富的RNA,包括mRNAs、miRNAs和其它非编码RNA.外泌体RNA可以随着外泌体在体循环时被吸收,最终改变受体细胞的基因表达和生物学功能.外泌体内含RNA的分布不是随机的,而是有高度特异的分选机制,并受内源目标序列调控.特定序列的mRNA会选择性地包载进外泌体,使细胞内和外泌体内的mRNA种类不同.部分类别的miRNA会优先装载到外泌体中,如miR-320和miR-150.在生理或病理条件下,外泌体miRNA表达可能发生改变.且RNA组研究表明不同来源外泌体内含的RNA的种类存在较大差异.外泌体RNA不仅具有生物标记特性,而且外泌体结构可为其内含的miRNA提供保护作用,抵抗来自RNAase的降解,从而稳定地存在于循环中的血浆和血清中,因此外泌体RNAs作为一种理想的临床诊断的生物标志物得到了大量研究[23].
Pasini等[24]用外泌体RNA定量EGFR谱揭示了非小细胞肺癌患者的突变动力学,通过比较研究27例非小细胞肺癌患者的外泌体RNA,证明了外泌体RNA可作为临床研究接受TKIs治疗的非小细胞肺癌患者的EGFR突变的动态变化的有效工具.Walravens等[25]在心球源性细胞(MSCs)和间充质干细胞(CDCs)源外泌体中检测到了非编码RNA,包括miR-10b、miR-146a和Y RNA片段.其中相对于MSC细胞外泌体,CDC细胞外泌体含有更高丰度的miRNA和Y RNA片段.Xu等[6]发现了胆管癌相关环状RNA circ-CCAC1在胆管癌患者胆汁中的外泌体上高丰度表达,具有作为诊断性生物标记的功能,而且circ-CCAC1可促进胆管癌的恶化,因而抑制其表达或阻断外泌体circ-CCAC1的传播具有作为新的胆管癌治疗方法的可能.Zhou等[26]在乳腺癌MCF-7和MDA-MB-231细胞外泌体中发现了一种新的核限制性和癌症相关的lncRNA,即NEAT1.NEAT1在血清中外泌体的高表达促进了更高的淋巴结转移率,并促进了乳腺癌细胞的侵袭、迁移、化疗耐药性和体内转移.此发现有助于乳腺癌治疗方式的创新与发展.
1.4 小 结
外泌体的组成较复杂,根据外泌体数据库Exocarta最新的数据显示,不同组织细胞所产生的外泌体中含有9769种蛋白、1116种脂质、3408种mRNA和2838种miRNA(http://exocarta.org/).外泌体的化学组成初步决定了其作用的功能和途径.不同外泌体之间具有各自独特的生物标志物.因此,对于外泌体的研究中,对生物标志物的研究尤为重要.上述工作中对一些具体和典型的外泌体化学组分进行了一定的研究,但对外泌体的认识随着组学等分子谱分析技术的进步还在不断深化与更新.
2 基于核酸适体的外泌体分子识别
分子识别是指分子选择性相互作用,例如抗体与抗原之间、酶与底物之间及激素与受体之间的专一结合.分子识别是一种普遍的生物学现象.糖链、蛋白质、核酸和脂质各自间以及相互之间都存在分子识别.分子识别作用在生命体系中至关重要,是生物分子的生理功能的根本基础.分子识别是通过2个分子各自的结合部位来实现的.在此过程中,可以与靶标物质进行特异性结合的分子被称为识别单元.在生物学研究中,最常用的分子识别单元是抗体,而核酸适体(Aptamer)作为“化学家的抗体”,在外泌体的分子识别研究中占有一席之地.
2.1 核酸适体的来源与特性
核酸适体是指利用体外筛选——指数富集的配体系统进化技术(SELEX)从特定的寡核苷酸文库中筛选出的能与靶标物特异性结合的寡核苷酸序列——脱氧核糖核酸(DNA)或核糖核酸(RNA)[27].核酸适体在20世纪90年代初由Ellington和Szostak、Robertson,Tuerk和Gold及其同事初步研究[28~30].核酸适体是有意设计的寡核苷酸序列,不同于天然存在的配体.
核酸适体具有多靶点、低免疫原性和毒性、易于准确合成和修饰、高化学稳定性、低分子量等特点,其特异性和亲和力与抗体相当[31].核酸适体可以折叠成独特的三维构象,通过分子间相互作用(范德华力、氢键、静电相互作用、扁平部分的堆叠和形状互补)与目标物结合,靶标包括小分子、蛋白质,甚至细胞,结合功能类似于抗体,也被称为化学抗体.核酸适体的独特性质使其成为生物识别和信号转导的理想载体.因此在核酸适体应用中最具代表性的方式为利用核酸适体的分子识别特性开发基于核酸适体的生物传感器,用于外泌体检测.
对于研究和医学诊断中的分子分析,核酸适体由于具有可编程的碱基序列和结构,且在低免疫原性和批次间差异、高特异性和敏感性以及更深的肿瘤穿透方面优于常规抗体,已被用于在细胞、亚细胞和分子水平上跟踪肿瘤,成为生物医学研究、诊断和治疗学中一类重要的亲和配体.为了靶向癌细胞,Zhang等[32]使用核酸适体作为指导,将粘蛋白1(MUC1)在人乳腺腺癌细胞上的核酸适体整合到纳米片中,显著提高了乳腺腺癌细胞的抗肿瘤活性.针对外泌体特定的标志物(包括蛋白质、脂质、RNA),研究者可以选择相应的核酸适体特异性地与标志物结合,从而识别外泌体,达到检测、诊断治疗的目的.当前已报道的能够特异性分子识别外泌体的核酸适体主要是DNA核酸适体,详见表1.

Table 1 Reported aptamers with exosome recognition function

Continued
2.2 核酸适体识别外泌体普遍存在的CD63生物标志物
通过识别外泌体膜上的特异性蛋白来进行外泌体的检测已有较多应用,其中最有代表性的蛋白为四跨膜蛋白家族(CD9、CD63和CD81).CD63是四跨膜蛋白超家族的一员,是一种高度n-糖基化的III型溶酶体膜蛋白.目前主要采用的CD63核酸适体是由Base pair生物公司针对靶蛋白CD63从随机文库筛选得到,它包含32个碱基,通过微尺度热泳分析得出其亲和力(Kd)为17.1 nmol/L.
2016年,CD63核酸适体即已被用于外泌体的检测[66].此后,研究者发展了基于CD63核酸适体的外泌体捕获、鉴定、检测等工作.Zhang等[56]利用CD63核酸适体结合外泌体表面过表达的CD63蛋白,从细胞培养基和血浆中捕获并分离外泌体,同时保持所捕获外泌体的高纯度,也可以从临床样本中分离外泌体.此外,CD63核酸适体可以通过识别外泌体的CD63表面蛋白来执行外泌体的医学鉴定.Yu等[67]基于针对外泌体膜上CD63蛋白的核酸适体,成功开发了使用金纳米颗粒(AuNPs)作为可视化探针的低成本侧流核酸适体分析(LFAA)测试条,用于方便地鉴定从人肺癌细胞分离的A549外泌体.CD63核酸适体还被用来开发外泌体表征和定量的方法.Zhao等[68]提出一种用于在双探针策略中准确识别外泌体的核酸适体-胆固醇介导的邻近连接分析方法.在此工作中,CD63核酸适体探针用来识别外泌体先天表面蛋白CD63,另一种胆固醇探针用来生物脂层靶向,可以极大地消除从游离CD63蛋白中广泛识别的潜在非特异性荧光信号.作者开发的外泌体表面方法不仅可以对外泌体进行定量,还可以用于追踪,实现特异性外泌体的分离和准确鉴定.Miao等[69]也通过引入CD63核酸适体实现了特异性识别,结合磁性Fe3O4@AuNPs易于分离的优势,制作了一种基于多足DNA步行器的超灵敏和选择性的生物传感器,通过定量分析可以评价目标外泌体水平.为了适用于基于肿瘤外泌体的液体活检,Li等[70]开发了一种低成本、易于处理的集成外泌体纳米传感器.此传感器通过GPC-1抗体包被的磁珠来特异性捕获来自乳腺癌的外泌体,通过用延伸的CD63核酸适体特异性识别外泌体,形成“三明治”状复合物珠-外泌体-核酸适体,结合信号扩增反应,可实现在跨越5个数量级的动态范围内高特异性地检测外泌体.由于近些年来CD63作为一种经典的外泌体标志物的重要作用得到了众多学者的认可,最近Song等[41]为了实现基于CD63的外泌体分离,通过设计的竞争性SELEX程序,同时引入NaCl作为洗脱系统,筛选出了新的CD63蛋白靶向核酸适体序列CD63-1.CD63-1显示了与CD63蛋白的特异性结合能力,结合亲和力中等(Kd≈100 nmol/L).Wang等[57]还比较了4种不同肿瘤细胞(MCF-7,HepG2,HeLa,Ramos)源外泌体上CD63表达的细微差异,结果显示CD63蛋白在HepG2外泌体上的表达最高,这为根据CD63表达水平区分不同的外泌体奠定了基础.而在研究了在MCF-7衍生外泌体上的4种不同膜蛋白的表达水平后,发现CD63蛋白仍然具有最高的表达水平.
2.3 核酸适体检测癌细胞来源外泌体蛋白
外泌体携带其来源细胞的信息,因此可以在一定程度上代替来源细胞作为蛋白质标记的载体.而且外泌体在体液中分布,是比细胞更易获得的诊断样本.通过对外泌体的分析不仅能显示出来源细胞的不同,还能在一定程度上区分癌细胞与非癌细胞.虽然肿瘤源外泌体含有来自母癌细胞的多种蛋白质,已成为癌症诊断的生物标志物,但是肿瘤外泌体在生物液体中的浓度较低.研究者们基于DNA核酸适体和外泌体表面生物标志物之间的分子识别,设计了外泌体的高度敏感和特异性感测平台.Chen等[61]基于DNA核酸适体sgc8和外泌体表面生物标志物PTK7之间的分子识别,设计了一种策略用于外泌体的高度敏感和特异性感知.在相同浓度下,CEM细胞产生的外泌体的强度远高于Ramos和HL-7702细胞,略高于B16F1细胞和HeLa细胞,与其它文献报道的结论一致[35,62].此策略具有高度的特异性来区分来自不同细胞系(CEM,B16F1,Ramos,HeLa和HL-7702)的外泌体,并已成功地在患者和健康的血浆样本中得到验证.Xu等[39]利用CD63和PMSA的核酸适体设计了外泌体触发的酶驱动DNA马达,并用其实现了不同癌细胞来源的外泌体的荧光检测.Li等[71]开发了一种用于肿瘤源外泌体超痕量膜蛋白的高灵敏度分析方法.该方法通过结合鼻咽癌(NPC)生物标志物CD109和EGFR的核酸适体,基于PCR的指数扩增和CRISPR/Cas12a实时DNA检测,用于检测细胞系和复杂生物流体中的CD109+和EGFR+肿瘤源外泌体.临床血清样本分析证实,通过外泌体水平可获得较高的诊断准确性,用于区分NPC与健康对照.Wang等[72]利用CD63的核酸适体作为外泌体捕获单元,通过双AuNPs辅助信号放大的表面等离子体共振(SPR),报导了一种可用于外泌体检测的灵敏的感应体传感器.该方法与商业酶联免疫吸附法(ELISA)相比,检出限(LOD)提高了104倍,能够区分MCF-7乳腺癌细胞和MCF-10A正常乳腺细胞源外泌体.
外泌体还携带特定疾病的进展和预后的信息.例如,癌细胞衍生的外泌体可以携带参与癌症进展的膜蛋白,所以某些外泌体蛋白可以作为表征不同疾病阶段的标志物.Xing等[58]开发了一种利用靶向核仁素和PD-L1的核酸适体直接高灵敏度检测肿瘤源外泌体蛋白的传感器分析方法.通过构建的检测方法进行了临床分析,结果显示早期NPC患者的核仁素+外泌体水平明显高于健康对照组,晚期NPC组的水平高于早期NPC组[图3(D)];他们还对8名NPC和2名肺癌患者进行抗PD-1/PD-L1治疗,发现临床应答者的循环外泌体PD-L1水平显著降低,但无应答者的循环外泌体PD-L1水平则没有显著降低.该工作初步证实血清核仁素+肿瘤源外泌体是鼻咽癌检测的潜在生物标志物,PD-L1+肿瘤源外泌体水平的变化是免疫检查点封锁治疗反应的潜在预测生物标志物.Li等[50]选择了一组3种核酸适体(AptEGFR,AptEpCAM和AptHER2)靶向外泌体表面的肿瘤相关蛋白EGFR、EpCAM和HER2,通过开发的荧光适体传感器对其进行分析,发现EGFR是3种选定乳腺肿瘤群体相关蛋白标志物中预测恶性乳腺癌的最佳标志物,3种蛋白标志物的组合在区分乳腺肿瘤患者(良性和恶性)和健康对照方面显示出比单一标志物更高的准确性.EGFR核酸适体传感器能以较高的效率诊断乳腺肿瘤,且分别以97.37%、92.31%的灵敏度来区分恶性乳腺癌和检测到Ⅰ期病例,有望用于液体活检中对肿瘤源外泌体蛋白的早期诊断.癌症源外泌体的定量在癌症的初始阶段具有微创诊断的强大潜力,Kashefi⁃Kheyrabadi等[46]介绍了一种基于EpCAM核酸适体设计的定量检测外泌体的电化学核酸适体传感器(DeMEA),量化了乳腺癌患者不同疾病阶段血浆样本中的外泌体.利用核酸适体技术,DeMEA可以在来自其它癌细胞的外泌体存在的情况下特异性检测出EPCAM阳性的外泌体,还能够对乳腺癌患者进行特定阶段的分析,在Ⅰ~Ⅳ期疾病进展方面与酶联免疫吸附分析保持很好的一致性.基于外泌体检测和外泌体蛋白质分析而开发的传感平台在癌症诊断中都具有潜在的应用价值.

Fig.3 Serum sample detection of nucleolin+EVs with the apta⁃HCR⁃CRISPR assay[58]
2.4 核酸适体探究外泌体蛋白谱系的异质表达
外泌体的多重膜蛋白的表达可以精确地描绘外泌体的生物学信息,而且外泌体与来源细胞以及疾病发展的密切联系使科研工作者对比较分析来自某些特定来源的外泌体的蛋白谱系产生了兴趣.Liu等[48]将一种价格低廉、反应快速且只需要较小血清量的热泳核酸适体传感器(TAS)分析扩展应用到临床血清样本中的外泌体,发现淋巴瘤患者血清外泌体中表面蛋白CD63、LZH8、HER2和PSA的表达水平明显高于健康对照组.又通过TAS对7个荧光核酸适体(AptPTK7,AptLZH8,AptHER2,AptPSA,AptCA125,AptEpCAM和AptCD63)标记的血清细胞外泌体表面蛋白进行了癌症诊断分析,发现每种癌症都显示出不同水平的外泌体蛋白质标志物,而健康对照组的外泌体表面蛋白质几乎没有表达.与健康对照组相比,癌症外泌体个体标志物(PSA除外)及其总和信号显著升高.此分析方法在临床验证中区分癌症与健康个体的准确率为99%,可能有助于癌症的筛查、分类和监测.
Jin等[59]报道了一种基于核酸适体纳米探针的面向外泌体的分析方法(ExoAPP).该方法将氧化石墨烯与目标响应核酸适体结合,通过与酶抵抗的外泌体再循环互补,描绘不同细胞类型的外泌体标记,以一种简单的混合和检测方式显示表面蛋白质的表型并定量癌性外泌体.用基于CD63和EpCAM的核酸适体作为分子识别单元,发现在相同浓度下,乳腺癌MCF-7细胞系外泌体显示出比良性MCF-10A细胞系外泌体EpCAM和CD63的丰度分别增加了大约5倍和2倍.作者又选择7种针对不同外泌体表面蛋白(CD63,AFP,CEA,EpCAM,PTK-7,PSMA和PDGF)的核酸适体作为分析探针,研究了5种细胞类型中外泌体的表型,揭示了外体表面蛋白的异质性表达.ExoAPP方法观察到前列腺癌患者样本的外泌体CD63,EpCAM和PSMA表达比健康对照组分别平均增加170%,200%和230%.乳腺癌是一种异质性疾病,其缺乏特殊的肿瘤标志物.因此,An等[44]开发了一种磁介导的电化学传感器来分析乳腺癌细胞衍生的外泌体中的蛋白质标记信息.该传感器利用核酸适体特异性识别4种外泌体蛋白(MUC1,HER2,EpCAM,CEA),并结合SPCE技术基于宿主-客体识别的同时检测,可以区分4种不同乳腺细胞亚型间外泌体蛋白的细微差异.分析发现乳腺癌患者源外泌体中MUC1,HER2,EpCAM和CEA蛋白的表达水平都高于健康个体源外泌体,在检测乳腺癌患者血清中的外泌体方面具有较高的准确性和易操作性.
Shi等[63]利用核酸适体作为识别部分和保护AuNPs免于聚集的双重特性,报道了一种新型的多重传感器平台,该平台是通过将AuNPs与一组针对普遍存在或推定的胞外表面蛋白的核酸适体组装而成的.根据特定的核酸适体-外泌体表面-蛋白质相互作用,核酸适体/抗体可以通过视觉和定量检测,从而产生能够识别不同癌细胞外泌体上多种蛋白质(CD63,EpCAM,PDGF,PTK7,PSMA)的模式(图4).此平台可以在几分钟内区分和描述微小的外泌体表面蛋白差异,使这一策略适用于大规模高通量筛查,特别是护理点的临床标本分析中.

Fig.4 Molecular profiling of exosomal proteins using aptamer/AuNP sensor[63]
不同类型细胞外泌体膜蛋白水平的工作为区分不同的外泌体奠定了基础,为肿瘤细胞的无创分类提供了可能,为基于外泌体膜蛋白鉴定的外泌体分子信息的准确分析铺平了道路,还为联合检测肿瘤标志物实现癌症的早期诊断提供了可能.
3 化学调控核酸适体用于外泌体识别
常规核酸适体存在着生物稳定性差、组织穿透能力弱等局限性,限制了其从实验到临床的成功转化,其主要表现为易被核酸酶降解、自身分子量小易通过肾脏快速清除、低热稳定性和有限的官能团多样性.克服这些限制的办法在于通过序列设计以及共价修饰等化学调控手段对核酸适体进行功能化改性以识别不同应用场景下的外泌体.核酸适体的高度可编程性和灵活性为基于分析识别的外泌体研究开启了一个新的视角.
3.1 核酸适体嵌合DNA纳米结构
DNA纳米技术的进步使得许多动态DNA纳米结构的构建成为可能,DNA四面体(图5)凭借其优异的机械刚性和几何稳定性,已经在生物传感表面工程中得到了应用.核酸适体序列可以通过序列设计嵌合入DNA四面体的构成序列中,成为顶端带有核酸适体序列、能够对外泌体进行识别与捕获的DNA四面体.嵌合于DNA四面体的核酸适体具有更好的取向性,其识别与捕获外泌体的效率更高.例如Wang等[73]结合先进的核酸适体技术,基于DNA的纳米结构和便携式电化学设备的优势,开发了一种纳米四面体(NTH)辅助的核酸适体传感器,用于直接捕获和检测肝细胞外泌体.定向固定化核酸适体显著提高了人工含碱基的核酸适体对悬浮外泌体的可及性,与单链核酸适体功能化核酸适体传感器相比,NTH辅助的核酸适体传感器可检测外泌体,灵敏度高出100倍.Jiang等[35]基于核酸适体修饰的DNA NTH结合AuNPs和酶信号放大,设计了一种用于分析癌性外泌体蛋白的电化学感应传感器.该核酸适体传感器对HepG2肝癌外泌体的检出限为1.66×104particles/mL,还实现了对不同癌症阶段的肝癌荷瘤小鼠血浆衍生的外泌体的分析.更重要的是,通过使用相应的核酸适体,该传感器可以用于分析4种外泌体蛋白,有望区分和描绘不同的外泌体表面蛋白.这种敏感的、多功能的电化学核酸适体传感器为外泌体蛋白分析提供了一种新的方法.在感知细胞对环境刺激的适应性反应时或识别并结合目标物时,这种膜锚定的纳米结构可被激活,然后通过串联DNA杂交将多个功能模块合并,为定制细胞工程和智能合成生物学提供了新的范式.

Fig.5 Aptamer⁃containing nanotetrahedron
3.2 核酸适体结构转换与信号放大
各种等温核酸扩增技术,如杂交链式反应(HCR)、滚环扩增(RCA)、链置换扩增(SDA)和重组酶聚合酶扩增(RPA),已被用于生物传感中的信号扩增,但通常需要完整的信号放大引发序列来启动放大过程.大多数核酸适体传感器是根据核酸适体与靶分子相互作用后的构象变化或结构转变而设计的.据此,如果在核酸适体序列的前后设计信号引发序列,核酸适体在识别其目标物后结构将发生变化,从而暴露信号引发序列,就能实现信号放大.目前已报道的外泌体检测信号放大策略主要包括杂交链式反应和滚环扩增两种.
由Pierce等[74]开发的HCR显示出优异的扩增效率和通用的序列设计灵活性.由于具有无酶反应性质,HCR成本低,易于执行.HCR是一种简单但稳健且高效的等温扩增过程.此外,HCR等温扩增技术是一种不涉及靶标扩增的探针扩增技术,有效减少了RPA和PCR中经常出现的扩增物交叉污染和假阳性结果.由于上述良好特性,近些年基于核酸适体特异识别结合HCR信号扩增技术用于外泌体检测、定量的研究取得了较丰富的成果.如前文所述,Xing等[58]开发的肿瘤源外泌体蛋白检测方法就是基于HCR和CRISPR-Cas12a的双重扩增[图3(A)].该方法可以直接从复杂的样品环境中检测肿瘤源外泌体,LOD约为102particles/µL.Wan等[75]提出了一种基于核酸适体的外泌体表面DNA纳米组装方法.这种原位组装方法是基于DNA核酸适体与其外泌体表面标志物之间的分子识别,以及由核酸适体-嵌合触发的DNA杂交链反应,表明DNA纳米结构可以成功地组装在一个纳米尺寸的细胞器上.Shen等[76]设计了构象可切换探针来识别外泌体中非常丰富的经典四酯蛋白标志物CD63.该探针包含一个带有CD63抗体核酸适体序列的目标识别域和一个通过HCR启动DNA生长的触发域.这两个结构域的两侧有一个铰链序列,以实现核酸适体-靶相互作用引发的构象变化.由每个外泌体上的DNA纳米结构的靶引发工程实现单外泌体计数和表型.Gao等[37]开发了一种结合发夹式DNA级联反应(HDCR)和DNA树突状分子组装的双信号扩增方法,用于特异性检测CD63结合外泌体,从而实现了外泌体的定量检测.将DNA探针连接到磁珠上的CD63核酸适体作为捕获组件,在目标外泌体存在的情况下,核酸适体识别并与外泌体结合,释放DNA探针作为触发器,通过打开与AuNPs结合的发夹DNA(HP1)来启动HDCR.荧光标记的DNA树枝状大分子与HP1连接,作为第二个信号放大阶段,以提高信噪比.在最优条件下,此方法对HepG2细胞来源的外泌体在1.75×103~7.0×106particles/µL范围内具有良好的线性响应,检出限为1.16×103particles/µL.该设计为生物样本中的外泌体分析和定量检测提供了有用的平台.
滚环扩增是一种在室温下进行的新型核酸扩增技术,能够产生高分子量的产物以完成信号放大的反应.由于具有简单、稳定和高灵敏度的特点,RCA被认为是一种有效的生化分析工具.Huang等[53]于2019年开发了一种MUC1特异性核酸适体用作检测探针,RCA用于实现信号放大的荧光核酸适体传感器来检测胃癌外泌体.该方法对目标外泌体具有较高的特异性,还对胃癌患者的血浆进行了检测,验证了该方法的临床适用性.该研究表明,这种基于核酸适体的生物传感器为胃癌提供了一种简单、快速、廉价的检测方法,显示出在胃癌诊断和预后方面的潜力.紧接着,该课题组[77]又于2020年初提出了一种通过结合血红素/G-四链体系统和RCA来高选择性灵敏检测胃癌外泌体的无标记核酸适体传感器.他们先筛选几种胃癌细胞或癌症过表达的蛋白质核酸适体以选择胃癌外泌体特异性核酸适体,然后在抗CD63抗体修饰的金电极上捕获不同种类的外泌体,发现只有胃癌外泌体能够触发RCA实现大量G-四链体单位的生成.最后利用氯化血红素/G-四链脱氧核酶对RCA反应产生的H2O2进行还原和信号放大,产生显著强的电化学和比色响应,验证了基于胃癌患者血浆外泌体MUC1与健康者外泌体的差异.Zhao等[68]设计了一种核酸适体-胆固醇介导的邻近连接分析,再整合用于信号扩增的RCA策略,通过添加荧光报告分子显著减少干扰信号,实现了高度特异性地识别和定量检测外泌体,同时确保了相对高的灵敏度.
3.3 核酸适体的末端修饰
对核酸适体进行末端修饰有许多方式,如修饰氨基、巯基、羧基、生物素或荧光分子等(图6).末端修饰的核酸适体随着修饰基团的不同和整体传感体系设计的不同而具有不同的功能,一方面有利于其固定于基底,从而增强其稳定性和抗酶切能力,增强对外泌体的分子识别功能;另一方面便于连接信号分子实现信号输出.

Fig.6 Terminal modification of aptamers
生物素标记的核酸序列可长期保存而不影响使用效果,标记容易、简单、时间短.Xu等[78]利用生物素修饰的核酸适体连接链霉亲和素共轭的辣根过氧化物酶,从而释放比色信号,用于外泌体检测;而Zhang等[79]将生物素修饰的核酸适体连接于链霉亲和素磁珠上,用于外泌体的捕获与分离.除了生物素-亲和素作用,核酸适体与载体的连接还可以通过酰胺反应来完成,通过缩合剂EDC将羧基和氨基连接.如Wu等[80]将末端修饰氨基的核酸适体锚定在表面有羧基的微珠表面,并与DNA多联体相连,用于识别和结合外泌体上CD63蛋白的传感器.该生物传感器在识别和定量检测人类唾液外泌体方面具有良好的临床可行性,为从体液中一步敏感定量检测外泌体提供了一种新颖和通用的策略.Zhang等[81]基于末端修饰了羧基的CD63适体修饰的SA-PAM电极界面,利用原位形成的AuNPs-MXenes-Apt纳米探针,开发了一种高灵敏的电致化学发光(ECL)生物传感器,用于高灵敏度检测外泌体.来自HeLa细胞系的外泌体的检出限为30 particles/µL,比常规ELISA低1000多倍,线性范围为102~105particles/µL.该ECL传感平台对来自不同肿瘤细胞系(HeLa、OVCAR和HepG2)的外泌体及其表面蛋白具有高选择性,能够灵敏、准确地检测人血清中的外泌体.核酸适体相对于抗体尺寸较小(核酸适体分子量平均为1×104,而抗体超过1.5×105),可以很容易地用荧光染料标记.外泌体的分子量估计为1×105~5×105,固有的巨大质量/体积充当基于质量的荧光偏振放大器.因此,荧光染料标记的核酸适体与外泌体的结合将显著改变适体的分子量,从而导致荧光偏振信号的显著变化.因此,Fang等[33]使用末端修饰TMR的核酸适体,采用一步混合读取荧光蛋白法直接定量了癌细胞中的外泌体且无需分离.该工作证明了可在临床样本中定量检测来自肺癌患者和健康供体的外泌体,描述了一种新的简单的液体活组织检查分析方法以直接检测生物基质中的外泌体,这有助于癌症诊断和治疗监测.
3.4 多价核酸适体
在生物分析中,基于双重识别机制的三明治法具有较高的特异性和敏感性,是蛋白质测定的主要策略.例如Shen等[76]通过针对单个外泌体上不同蛋白标志物(CD63和HERG2)同时被核酸适体识别的反应,再结合HCR扩大信号反应用于检测外泌体.此工作不仅实现了在同一外泌体上同时识别双重表面标记,而且通过简单地修改探针,可以靶向更多不同类别的标记,以提高核酸适体检测方法对更多外泌体亚群体的区分能力[76].而Chang等[82]则将用于癌症生物标记识别的多个DNA核酸适体和用于信号整合与扩增的激活趾点作为两个分子钥匙,成功操作了可以执行多个生物标记的“AND”布尔逻辑分析的细胞表面装置.该装置可通过不同生物标记的存在或不存在,在大量相似细胞中精确标记靶细胞亚型.此研究能以优异的灵敏度和准确度实现单步癌细胞识别和分离.
Hou等[15]提出了一种基于双核酸适体的三明治型表面增强拉曼散射(SERS)传感器,用于肿瘤源外泌体的快速、特异定量检测.CD63核酸适体首先通过Au—S键修饰在AuNPs表面,构成SERS信号探针.然后将PTK7核酸适体固定在琼脂糖珠表面以获得捕获探针(AAP).在复杂的血清样本中,AAP可以选择性地与靶肿瘤外泌体膜表面的PTK7蛋白结合,而正常对照外泌体和各种蛋白聚集物可以通过简单的离心去除.随后加入特定的SERS探针识别目标外泌体,最终形成一个三明治型核酸核酸适体-免疫复合物(AAP-Exo-SP).尽管一些针对核酸适体的生物标志物仍然未知,但随着单细胞蛋白质组高通量分析方法的增加,它们的发现过程正在加速.通过并行操作两个基于多核酸适体的方法可以进一步扩大规模,以同时识别更多的受体.根据生物标记的不同表达水平,核酸适体可以以更高的精确度识别细胞,这种集成的基于多核酸适体的方法可能将优于当前基于单一生物标志物的细胞鉴定系统以及多步标记方法.
3.5 分裂核酸适体
分裂核酸适体由完整核酸适体的2个或多个片段组成,2个片段在靶分子存在下可形成特殊的三元复合物.在没有靶分子的情况下,分裂的核酸适体不能折叠成正确的二级结构,缺乏二级结构的分离链不能产生假阳性或非特异性信号.只有在靶分子存在的情况下,分裂的核酸适体才会选择性地组装.在这种情况下,它大大降低了细胞表面非特异性吸附的背景信号.但是目前将此项技术应用至识别胞外外泌体检测的工作还很少.受此概念启发,Chen等[38]使用了一个简单的基于发光共振能量转移(LRET)的纸支撑的自组装传感器,从上转换纳米粒子(UCNPs)到金纳米棒(Au NRs)用于外泌体的可及性测定.当外泌体存在时,核酸适体的两段与外泌体表面的CD63蛋白结合,形成共轭,缩小UCNPs和Au NRs之间的距离,从而启动LRET效应,促进发光猝灭,然后用图像系统监测、提取以量化发光.UCNPs的发光猝灭与外泌体的浓度线性相关,便能够定量检测外泌体.此方法不仅快速、便利,还可通过选择相应的核酸适体来检测不同的目标.Zhang等[83]也设计了2个含有PTK7核酸适体片段的寡核苷酸探针来识别和捕获含有PTK7的外泌体.在靶外泌体存在的情况下,核酸适体-靶三元复合物可以诱导邻近杂交并在电极上形成dsDNA,进而结合更多电活性增加阴极电流信号.利用这种方法构建的简易的外泌体电化学核酸适体传感器对不同肿瘤源外泌体具有良好的选择性,可用于复杂生物样品中的外泌体检测,也可扩展到其它外泌体的检测.
4 总结与展望
外泌体的研究始于30多年前[84],但将核酸适体用于外泌体的研究是近5年新兴的研究热点,其中2019~2020年间发表的相关研究论文数量超过了以往的总和.本文主要综述了以核酸适体为识别单元的对外泌体的组分进行分子识别的研究工作,为外泌体以及核酸适体的研究工作者提供参考.此外,将核酸适体用于外泌体研究的另一个重要领域是以靶向细胞表面受体分子的核酸适体为核心构建功能核酸,对外泌体表面进行修饰,从而利用功能化的外泌体实现外泌体的改性与定向运输[85,86].此方面的研究未作详细讨论.
尽管核酸适体独特的特性使其成为构建生物识别和信号转导体系的理想材料,但适用于外泌体分子识别的核酸适体仍存在需要改进或解决的问题和挑战.首要问题是可识别外泌体的核酸适体的种类有限,其数量远低于抗体,且可识别的靶标种类仅仅局限于部分表达量相对较高的外泌体蛋白,缺乏针对脂质、肽等其它活性成分的核酸适体.为了丰富靶向外泌体的核酸适体库,除了采用已有的通过重组蛋白筛选出的核酸适体之外,通过筛选得到新的核酸适体是必由之路.对从外泌体上已鉴定出的具有医学诊断意义的某一生物标志分子作为靶标进行筛选是核酸适体筛选研究者的领域之一.此外,组学研究已证明了不同源外泌体的分子谱存在差异,因此,从宏观组学思维出发,研究者尝试以乳腺癌细胞源外泌体作为正筛靶标,以普通细胞源外泌体为反筛靶标,进行核酸适体的筛选[87].此工作的思维与Shangguan等[88]开发的Cell-SELEX有异曲同工之处.直接以外泌体整体作为靶标进行筛选所得到的核酸适体不仅可区分不同源外泌体,也可作为特定细胞的外泌体功能拮抗剂,从而为核酸适体药物的开发拓展新的领域.与某一具体分子作靶标相比,外泌体成分多样,即使来源细胞相同,外泌体由于细胞生理状态的不同仍然存在异质性,因此在筛选文库的选择上选用何种丰富结构多样性的手段,如何优化筛选过程控制和监测方法,是提高外泌体筛选成功率需要考虑的问题[89].
其次,识别外泌体的核酸适体在实际应用方面的挑战在于亲和力和稳定性.目前针对外泌体上某一特定靶标蛋白进行分子识别的核酸适体是直接采用的能够结合同一体外重组蛋白或同一细胞表面蛋白的核酸适体.而外泌体作为非接触介导的细胞间通讯的载体,其生物发生过程复杂,且能够响应外界刺激,因此外泌体表面某一靶标分子的构象以及存在形式可能与细胞以及体外不同,因此导致此靶标的核酸适体对于外泌体上的靶标的结合能力降低.为解决这个问题,除了筛选或优化得到新的核酸适体序列之外,还可以利用核酸适体便于化学调控的优势,结合辅助手段增大对外泌体的结合能力.基于生物正交反应的方法和基于分子印迹的方法是有希望与核酸适体耦合、从而实现外泌体多维分子识别的途径.
如前文所述,外泌体可作为生物分子标记,特别是在癌症诊断和治疗方面有较突出的潜力,而且外泌体可从那些易于获得的体液中分离,这使得外泌体成分发展液体活检方法的重要目标物.外泌体体积小,密度低,易在流体中分散,核酸适体如果用于循环体液中的外泌体的识别,就需要有更高的稳定性,拥有抗酶切、长循环等特性.这些特性在核酸适体活体诊疗领域通常通过化学修饰来实现[90],如在碱基2′位添加氟(F)、氨基(NH2)或甲氧基(OCH3)等基团或在序列3′端加帽.筛选中也可加入锁核酸(LNA)L型RNA核酸适体以获得抗酶切的核酸适体.这些化学调控方法有望为体液中外泌体的识别提供借鉴,但应注意在提供抗酶切能力的同时保留核酸适体的亲和力.另一方面,为了延长活体内循环时间,核酸适体可以通过设计与聚乙二醇、脂质体、有机或无机纳米材料等大体积单元连接,此方法在外泌体的识别中已经得到了部分应用[91].在核酸适体化学不断发展的背景下,随着在体内水平上对外泌体生理功能的进一步探索以及外泌体临床应用的进一步开发,核酸适体在外泌体分子识别方面的探索与应用将有更广阔的发展.