局部介入联合卡瑞利珠单抗与阿帕替尼治疗转移性软组织肉瘤的安全性和有效性
李 岩,黎海亮,陈呈世,胡鸿涛,赵 妍
软组织肉瘤(soft tissue sarcoma,STS)是来源于间叶组织的恶性肿瘤,包括50多种组织学亚型[1]。早期治疗以手术、放疗、术后化疗为主,但约40%患者经历肿瘤复发或转移。常见的转移部位有肺、淋巴结、骨、肝脏、脾脏等,中位生存期<12个月,预后较差[2]。化疗是转移性STS的一线治疗方案,但耐药性较高[3],一线化疗失败后尚没有标准的后续治疗方案。随着介入放射学的快速发展,局部介入已成为治疗转移性STS的有效方法[4-6]。同时在远处转移等进展过程中大量病理性血管生成,因此帕唑帕尼、阿帕替尼等抗血管生成药物逐渐应用于转移性STS的治疗[7-8]。近年来,基于免疫检查点抑制剂(ICI)的免疫治疗也已在转移性STS中初显疗效[9]。随着对肿瘤发病机制的不断深入研究,全身治疗联合局部治疗的精准治疗模式会使患者获益更大。迄今为止,局部介入联合免疫与靶向治疗转移性STS的研究鲜有报道。本研究回顾性探讨局部介入联合卡瑞利珠单抗与阿帕替尼治疗转移性STS的安全性与有效性,为临床治疗提供依据。
1 材料与方法
1.1 一般资料
选取2019年3月至2020年6月在郑州大学附属肿瘤医院治疗的15例转移性STS患者。纳入标准:①组织病理学诊断为STS;②已出现远处转移;③治疗方案为局部介入联合卡瑞利珠单抗与阿帕替尼;④ECOG评分≤2;⑤预计生存期≥3个月;⑥临床资料及随访完整。排除标准:①合并其他恶性肿瘤;②严重凝血功能障碍;③严重的肝肾功能不全。患者的一般临床资料见表1。

表1 15例STS患者的一般临床资料
1.2 治疗方法
1.2.1 局部介入
1.2.1.1 经动脉化疗栓塞术(TACE):局麻后采用Seldinger方法穿刺股动脉并放置6 F动脉导管鞘,引入5 F导管后经造影明确肿瘤供血动脉。使用微导管超选择至肿瘤供血动脉后注入白蛋白紫杉醇(130 mg/m2),并进一步应用300~700μm微球栓塞,再次造影确认血流减缓或消失,必要时以明胶海绵颗粒补充栓塞。术后行对症支持治疗。
1.2.1.2 氩氦刀冷冻消融(CA):行CT平扫并结合术前影像资料设计肿瘤穿刺方案,将预估数量的氩氦刀穿刺针与主机相连接进行冷冻测试,确定每支氩氦刀均可以形成冰球,随后局麻并穿刺,将全部氩氦刀插入瘤体后扫描示所有氩氦刀分布理想。消融时依据冰球覆盖范围即时调整,以冰球边缘超过瘤体外缘0.5~1 cm为宜,冷冻10 min、复温3 min为1个循环,共2个循环后拔针。术后行对症支持治疗。
1.2.2 免疫治疗:局部介入治疗后3 d内开始使用抗PD-1单抗卡瑞利珠单抗(camrelizumab,艾瑞卡)200 mg,将其加入到0.9%氯化钠注射液100 mL经静脉泵入60 min,3周/次。
1.2.3 靶向治疗:局部介入治疗后3 d内开始口服甲磺酸阿帕替尼250 mg/d。若治疗过程中出现无法耐受药物时,则减少剂量或终止治疗。
1.2.4 定义与随访:联合治疗前检测血常规、凝血功能等生化指标并行增强CT或动态增强MRI等影像学检查,术后每2个月复查相关检查。临床疗效评估根据改良实体瘤评价标准(mRECIST)[10]。客观缓解率(ORR)=完全缓解(CR)+部分缓解(PR)。临床受益率(CBR)=CR+PR+稳定疾病(SD)。无进展生存期(PFS)定义为自联合治疗起到疾病观察到进展或最后一次随访时间,以先到者为准。总生存期(OS)定义为自联合治疗起到死亡时间或最后一次随访时间。临床获益持续时间(DoCB)定义为若疗效达到CR,PR或SD,自联合治疗起到疾病进展或最后一次随访时间。不良事件采用美国国家癌症研究所《不良事件通用术语标准》4.0版评价,分为0-Ⅳ级。
1.3 统计学分析
采用SPSS22.0软件,利用Kaplan-Meier法绘制PFS、OS生存曲线。
2 结果
2.1 有效性
15例患者中CR 1例(脂肪肉瘤)、PR 5例(透明细胞肉瘤、横纹肌肉瘤、恶性间皮瘤、腺泡样软组织肉瘤和成肌纤维细胞肉瘤)、SD 7例、PD 2例,ORR为40%,CBR为86.7%。mPFS为7.8个月(95%CI:6.9~8.7),mOS为14.9个月(95%CI:13.1~16.7),见图1、2。中位DoCB为8.4个月(95%CI:7.6~9.2)。

图1 15例STS患者的生存曲线
9例患者行CA联合TACE治疗,mPFS为8.5个月(95%CI:6.5~10.5),mOS为16个月(95%CI:14.4~17.6);6例患者行单纯CA治疗,mPFS为7.4个月(95%CI:5.0~9.8),mOS为13.4个月(95%CI:10.4~16.4),见图3。
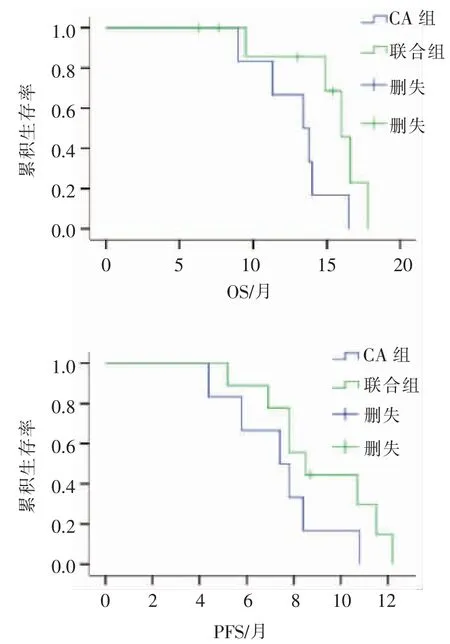
图3 联合组与CA组生存曲线
2.2 安全性
在随访观察中,不良反应绝大多数为Ⅰ~Ⅱ级,Ⅲ级为贫血2例、高血压2例、白细胞减低1例,经减量及对症处理后缓解,未观察到Ⅳ级或相关性死亡,见表2。

表2 Ⅰ~Ⅱ级不良反应发生病例数
3 讨论
目前,转移性STS的治疗除了以多柔比星与异环磷酰胺的联合化疗外,应用较多的是帕唑帕尼。Yoo等[7]研究显示,帕唑帕尼治疗的43例转移性STS患者mOS为8.2个月,mPFS为5.0个月,ORR为17.1%,DCR为61.0%,但在中国应用更多的是阿帕替尼。它是一种小分子血管内皮生长因子受体-2(VEGFR-2)酪氨酸激酶抑制剂,可以抑制肿瘤新生血管的生成。一项将阿帕替尼用于治疗晚期软组织肉瘤的研究显示mPFS为4.6个月,mOS为8.0个月,ORR为16.1%,DCR为77.4%[11]。近年来,随着免疫治疗的快速发展,ICI也逐渐应用于转移性STS的治疗。Zhou等[12]回顾性研究了38例以ipilimumab联合nivolumab诱导治疗、继而以nivolumab单药治疗的不可切除或转移性STS,结果mPFS为2.7个月,mOS为12.0个月。而免疫联合靶向治疗晚期STS的研究也在进行中,Martin-Broto等[13]的研究显示,nivolumab联合sunitinib治疗晚期STS患者mPFS为5.6个月,ORR为11%,6个月PFSR为48%。

图2 CR患者图像
本研究观察到的ORR为40%,CBR为86.7%,mPFS为8.5个月,mOS为15个月,效果显著。总体上,局部介入治疗通过物理或化学方法直接杀伤肿瘤,后续又可调节免疫系统[14-16],为联合治疗的可行性奠定了理论基础。CA通过局部组织冻结并经过多个冻融循环导致肿瘤细胞及血管损伤。而过程中释放的抗原可与血清内抗体相结合形成免疫复合物进而被树突状细胞吞噬[17],增强抗原呈递促进机体免疫反应。同时CA后坏死肿瘤细胞中CD8+T淋巴细胞高度浸润[18],进一步增强了特异性抗肿瘤作用。本研究CA联合TACE治疗mOS、mPFS要优于单纯CA。可能原因是一方面因为动脉栓塞后导致肿瘤坏死,减少了IL-10、TGF-β等免疫抑制因子的释放[16],使得局部CD4+、CD8+T淋巴细胞数量增加。同时栓塞后形成的缺氧微环境增加了HIF-1α的释放,其可以上调细胞表面PD-L1的表达[19],并且缺氧组织细胞坏死会诱导VEGF生成。而阿帕替尼可以高度选择性地与VEGFR-2结合,阻断信号传导抑制肿瘤新生血管的生成[20]。另一方面是TACE与CA的互补增效。CA不但二次杀伤栓塞不完全区肿瘤细胞,而且改变了细胞膜通透性有利于局部化疗药物的聚集。而TACE不仅有利于确定CA靶灶范围,还可以通过阻断血供降低热量损耗,从而加速冰球形成。阿帕替尼通过抑制肿瘤新生血管生成并纠正异常扭曲血管逐渐正常化,使抗PD-1单抗在肿瘤血管内保持高灌注化且CD4+、CD8+T淋巴细胞(15.3%与7%)较空白组(7.6%与2.3%)浸润增加进而增强免疫表达[21]。同时阿帕替尼可上调P53等基因表达促进细胞凋亡,还可以增强阿霉素、奥沙利铂等细胞毒性药物的疗效[22]。
本研究中严重不良反应为贫血、高血压、白细胞减低,对症处理后均缓解,但目前关于此种联合治疗的研究鲜有报道。而对比nivolumab联合sunitinib治疗晚期STS的研究,其Ⅲ、Ⅳ级不良反应为转氨酶升高(16.7%)与中性粒细胞减少症(11.5%),发生率大致相等,证明了此联合治疗良好的安全性[13]。
本研究尚有一定的局限性。首先,为单中心回顾性研究,样本量较小。随着研究的不断深入,人们发现免疫治疗用于不同组织学亚型的效果不尽相同。一项北美的研究纳入了338例血管肉瘤患者,结果显示皮肤血管肉瘤对免疫检查点抑制剂较为敏感[23]。所以后续需要扩大样本量并通过肉瘤亚型对结果进行分析,以进一步验证该联合治疗的有效性并从中找寻获益最大的亚组分型。其次是联合治疗的应用方法,尤其是联合时间。介入治疗会导致肿瘤抗原的释放并促进抗原呈递,但这种免疫调节作用是短暂的。同样阿帕替尼会促进PD-L1表达,减轻免疫抑制,但这种免疫促进作用有时间依赖性[24]。基于此点本研究将三者同时进行以增强协同作用,但同时治疗时可能会产生更大毒性,引起严重不良反应。目前关于联合治疗的应用方法仍处于探索阶段尚无共识,而本研究出现的严重不良反应较少且减量及对症处理后缓解。未来的研究应寻找此联合治疗的最佳应用方法,既能疗效最佳又能良好耐受,使患者从中获益最大。
综上所述,局部介入联合卡瑞利珠单抗与阿帕替尼能够延长转移性软组织肉瘤患者的生存期且安全可控,未来需要进一步开展前瞻性多中心大样本临床试验以证明此联合治疗的安全性与有效性。

