慢性乙型肝炎患者CD4+Th细胞中LSD1表达及其作用
毛 雪, 陈志勇, 顾宇峰, 朱雪娟, 谭晓慧*, 汪晓莺, 朱轶晴, 汤 伟
1. 南通大学附属医院老年医学科,南通 226001 2. 南通大学附属医院感染科,南通 226001 3. 南通大学医学院免疫系,南通 226001
目前一致认为,乙型肝炎病毒(HBV)慢性感染的机制涉及病毒和机体免疫功能两方面,后者占主要地位[1-2]。HBV感染后,体内辅助性T淋巴细胞(Th细胞)增殖、分化及各亚群尤其是Th1/Th2之间的平衡状况,直接或间接影响乙型肝炎的发病状况及转归。各型乙型肝炎患者体内均存在明显的细胞免疫应答失衡。急性乙型肝炎以Th1类细胞应答占优势,上升的Th1 类细胞因子[白细胞介素2(IL-2)、干扰素γ(IFN-γ)等]促进细胞毒性T淋巴细胞(CTL)参与清除HBV;慢性乙型肝炎(CHB)则以Th1类细胞应答下降为主,Th1类细胞因子表达下调,Th2类细胞因子表达上调,细胞免疫应答减弱,而Th1/Th2类细胞免疫应答失衡可能是HBV 感染慢性化的重要机制之一[3-4]。
赖氨酸特异性组蛋白去甲基化酶1(histone lysine-specific demethylase 1,LSD1)具有特异性去除单甲基化和二甲基化 H3K4 和 H3K9 位点上的甲基基团的功能。LSD1在淋巴细胞分化中发挥作用,参与维持Th1/Th2细胞分化平衡。张洁等[5]的研究显示,在体外可通过降低LSD1 活性诱导Th1/Th2 细胞分化偏向Th1 细胞,Th1类细胞因子表达上调,Th1类细胞免疫应答水平增强。但是,目前未明确CHB患者体内LSD1的表达是否与其Th1类细胞因子表达下调、Th2类细胞因子表达上调致Th1 /Th2类细胞免疫应答失衡有关。
因此,本研究通过观察CHB患者外周血CD4+Th细胞中LSD1的表达水平,分析其与血清中IFN-γ、IL-4、丙氨酸转氨酶(ALT)、乙肝病毒载量(HBV-DNA)等指标的相关性,探讨LSD1表达与Th1、Th2细胞免疫的关系,以了解LSD1介导的组蛋白修饰在HBV感染慢性化机制中的作用。
1 资料与方法
1.1 研究对象 选择2017年6月至12月在南通大学附属医院感染科住院的65例CHB患者,均依据慢性乙型肝炎防治指南(2015更新版)[6]诊断。65例CHB患者中,男性41例、女性24例,年龄18~65岁,平均(43.32±12.38)岁。所有患者均排除甲型肝炎病毒(HAV)、丙型肝炎病毒(HCV)、丁型肝炎病毒(HDV)、戊型肝炎病毒(HEV)感染及应用相关药物、酒精或自身免疫性疾病等引起的急慢性肝损害,均未接受过抗HBV药物、糖皮质激素或胸腺肽等免疫调节剂的治疗。另选择30例同期于本院接受健康体检的健康人作为对照,男性18例、女性12例,年龄22~63岁,平均(44.43±11.74)岁。对照组均无病毒性肝炎及自身免疫性疾病病史,肝功能正常,HBV标志物阴性,HCV抗体阴性。2组研究对象性别构成与年龄差异无统计学意义。
根据CHB患者入院时的ALT水平将65例患者分为ALT高水平组[>4×ULN(正常上限)]与ALT低水平组(≤4×ULN);按HBV-DNA定量结果,将65例患者分为HBV-DNA高载量组(≥106拷贝/mL)与HBV-DNA低载量组(<106拷贝/mL)。
1.2 主要试剂及仪器 乙型肝炎病毒表面抗原(HBsAg)测定试剂盒购自美国雅培公司;HBV-DNA荧光定量试剂盒购自上海科华生物工程股份有限公司);人IFN-γ和 IL-4 ELISA检测试剂盒购自北京欣博盛生物科技有限公司)。CD4+Th细胞阳性分选试剂盒(含试剂A和试剂B)购自美国Dynal公司。人CD3-FITC、CD4-PE单抗购自美国BD公司;兔抗人β-actin 抗体购自美国Bioworld Technology公司;兔抗人LSD1单克隆抗体购自美国CST公司;HRP 标记羊抗兔抗体购自美国Bioworld Technology公司。ECL化学发光试剂购自美国Pierce公司。全蛋白提取试剂盒购自南京凯基生物公司。
全自动蛋白质核酸定量检测仪购自德国Eppendorff公司。MACS磁力架购自美国Dynal公司。化学发光凝胶成像系统(Chemi-Smart 5000)购自法国Vilber公司。RG3000荧光定量PCR系统购自德国Rotor-Gene公司。i200SR型全自动微粒子化学发光免疫分析仪购自美国雅培公司。
1.3 外周血CD4+Th细胞LSD1检测 采集受试者空腹静脉血4 mL(EDTA-Na2抗凝),常规分离出单个核细胞,采用免疫磁珠法分选出CD4+Th细胞,以流式细胞术检测其纯度,≥95.0%时用于后续研究。提取CD4+Th细胞总蛋白,以Western 印迹法检测LSD1蛋白表达:SDS-PAGE电泳,转膜,先后加入一抗(兔抗人LSD1抗体及兔抗人β-actin抗体)和二抗(HRP标记羊抗兔抗体)孵育,ECL发光化学试剂处理后,置于Chemismart 5000,用Image J分析软件测定目标条带的灰度值。以LSD1/β-actin的灰度比值表示LSD1蛋白的相对含量。
1.4 血清CHB指标、免疫指标检测 血清HBsAg定量采用全自动微粒子化学发光法,按试剂盒说明书操作。血清HBV-DNA定量检测采用实时定量PCR法,按试剂盒说明书操作。HBV-DNA最低检测限1 000/mL,各标本实际检测值取常用对数,以log10表示。血清IFN-γ、IL-4定量检测采用ELISA法,按试剂盒说明书操作。

2 结 果
2.1 CHB患者与健康人外周血CD4+Th细胞LSD1表达水平比较 结果(图1)显示:CHB患者CD4+Th细胞LSD1表达量(0.28±0.09)高于健康人(0.52±0.21;t=-7.49,P< 0.001)。
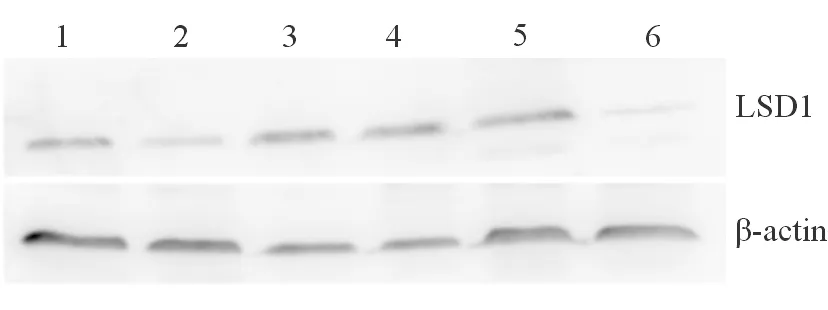
图1 外周血CD4+Th细胞LSD1蛋白表达情况
2.2 各亚组CHB患者外周血CD4+Th细胞LSD1表达量比较 结果(表1)显示:CD4+Th细胞LSD1表达量在ALT高水平组低于ALT低水平组(P<0.001),在HBV-DNA高载量组高于低载量组(P<0.001)。

表1 各亚组CHB患者CD4+Th细胞LSD1表达量
2.3 CHB患者与健康人血清IFN-γ、IL-4含量及IFN-γ/IL-4比值比较 ELISA结果(表2)显示:CHB患者血清IFN-γ含量及IFN-γ/IL-4比值均低于健康人(P<0.05),IL-4含量高于健康人(P=0.001)。
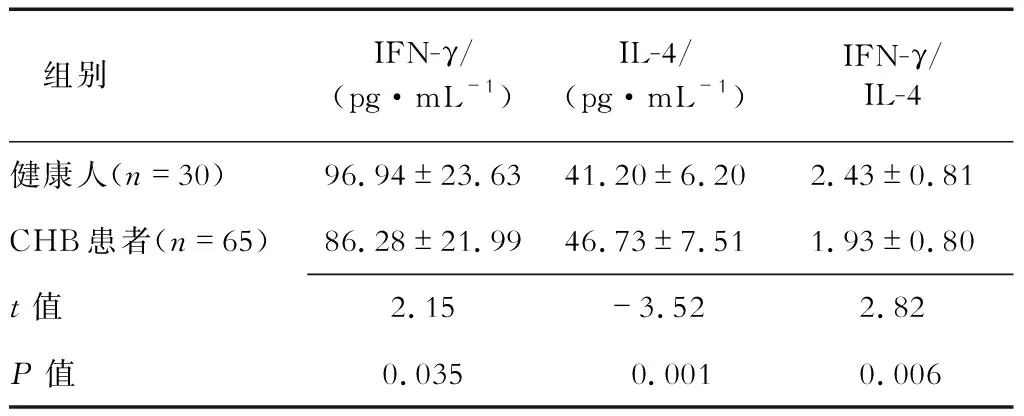
表2 CHB患者与健康人血清IFN-γ、IL-4及IFN-γ/IL-4水平
2.4 CHB患者LSD1表达量与血清ALT、IFN-γ、IL-4、IFN-γ/IL-4及HBV-DNA载量的相关性分析 结果(表3)显示:CHB患者外周血CD4+Th细胞LSD1表达量与血清ALT水平、IFN-γ水平及IFN-γ/IL-4负相关(P<0.01),与HBV-DNA载量正相关(P<0.001),与血清IL-4水平无相关性。

表3 LSD1表达量与血清IFN-γ、IL-4、IFN-γ/IL-4及HBV-DNA载量的相关性
3 讨 论
LSD1定位于细胞核内,能特异性脱去染色体组蛋白H3K4、H3K9、H3K27等位点上的单甲基化和二甲基化甲基基团,对靶基因的表达产生不同影响[7-9]。
LSD1在CD4+T淋巴细胞分化中发挥重要作用,参与维持Th1/Th2分化的平衡。T-bet是Th1细胞相关的转录因子,影响Th1细胞的分化及Th1反应[10]。CD4+T细胞分化为Th1过程中,LSD1可通过影响T-bet启动子区域的H3K27和H3K4的甲基化,使T-bet转录降低或失活,从而影响Th1/Th2的平衡状态[11-12]。本研究中,CHB患者CD4+Th细胞中LSD1表达量较健康人升高;在CHB患者中,ALT低水平组CD4+Th细胞LSD1表达量高于ALT高水平组,HBV-DNA高载量组CD4+Th细胞LSD1表达量高于HBV-DNA低载量组。
近年来免疫学研究表明,Th1/Th2细胞反应在机体细胞免疫中发挥非常重要作用。慢性HBV携带者、CHB及乙肝肝硬化患者的血清Th1细胞因子(如IFN-γ、IL-2、IL-12水平低于健康人群,而Th2细胞因子IL-4水平高于健康人,IFN-γ水平及IFN-γ/IL-4比值与HBV-DNA载量负相关[13-15]。另有研究[16]发现,降低小鼠体内LSD1表达,可明显提高血清中IFN-γ水平。本课题组前期研究[17]中以HBV感染小鼠为模型,给予LSD1抑制剂反苯环丙胺(TCP) 及LSD1的siRNA抑制LSD1的活性后,在相同时间段内,血清中HBsAg水平、HBV-DNA载量均明显降低,且肝组织中HBsAg明显减少。本研究中,与健康人比较,CHB患者血清IFN-γ含量减少、IL-4含量增加、且IFN-γ/IL-4比值降低,提示CHB患者体内Th1/Th2平衡偏向Th2;进一步分析发现,CHB患者CD4+Th细胞LSD1表达量与血清IFN-γ及IFN-γ/IL-4负相关,与IL-4无相关性,而与HBV-DNA定量正相关。本研究结果与上述研究相符。
综上所述,CD4+Th细胞LSD1参与调节机体Th1/Th2细胞免疫平衡。CHB患者CD4+Th细胞内LSD1表达升高可引起Th1细胞分化减少和Th1/Th2反应失衡,导致机体对HBV清除及抑制HBV复制的能力降低,表现为CHB患者CD4+Th细胞LSD1高表达时,其血清IFN-γ水平降低,肝脏组织炎症较轻和血清HBV-DNA载量升高。本研究提示,CD4+Th细胞LSD1表达升高可能是HBV感染慢性化的机制之一。
利益冲突:所有作者声明不存在利益冲突。

