花生肽-钙螯合物的制备及其结构表征
王孟丽,布冠好,*,陈复生,李盘欣,黄亚男
1.河南工业大学 粮油食品学院,河南 郑州 450001
2.河南省南街村(集团)有限公司,河南 漯河 462600
钙在人体生长发育过程中起着极其重要的作用,人体吸收充分的钙可以降低患骨质疏松、佝偻病的风险[1-3]。目前补钙制品分为无机钙、有机钙和螯合钙,前两类钙产品容易在肠道中形成钙沉积,严重降低了钙的吸收利用率[4-6]。相比前两类离子钙来说,以螯合形式存在的肽钙具有生物利用率高、稳定性高、低生物毒性等优点[7-12],而且其在转运机制、稳定性等方面都要优于氨基酸螯合钙[13-15],是一种相对理想的钙补充剂。
花生是我国六大油料作物之一,同时也是非常值得开发的植物蛋白资源[16-18]。但是目前我国花生主要用于榨油,花生蛋白资源未得到充分利用,为了减少蛋白质资源的浪费[19-20],加强开发花生蛋白深加工产品成为当务之急。花生肽是花生蛋白的深加工产品,其稳定性优于花生蛋白,可直接被小肠吸收,增强免疫力[21-23]。
关于肽-钙螯合物的研究,已有报道以动物性肽-钙螯合物较多,植物源肽-钙螯合物有大豆肽-钙螯合物、玉米肽-钙螯合物及核桃肽-钙螯合物等相关研究,而花生肽-钙螯合物的研究鲜见报道。目前肽钙产品主要是酪蛋白磷酸肽螯合钙、乳清蛋白肽螯合钙,产品单一且价格较高,另外存在螯合率不高且风味不佳的问题。如何挖掘高效、低成本的多肽基料来开发多肽螯合钙制剂具有十分重要的意义。
作者以富含蛋白且价格低廉的花生粕为原料,通过复合酶解控制技术及螯合反应条件的优化,制备具有双重营养功能的含钙量高且风味佳的花生肽-钙螯合物,并利用光谱学以及热力学分析等方法对其进行表征。既可实现花生蛋白的高值化利用,又为人体补钙提供了新的途径,为开发成本低且易吸收的新型补钙产品提供理论依据。
1 材料与方法
1.1 材料与设备
花生粕:实验室自制;碱性蛋白酶、风味蛋白酶:上海源叶生物科技有限公司;EDTA、钙指示剂、无水氯化钙等均为分析纯。
L550离心机:湖南湘仪实验室仪器开发有限公司;LGJ-10C真空冷冻机:四环福瑞科仪科技发展有限公司;HSHZ-B恒温水浴振荡器:上海跃进医疗器械有限公司;UV-1901紫外光谱仪:北京普析通用仪器有限公司;WQF-510傅里叶红外光谱仪:北京瑞丽分析仪器有限公司;DSCQ热重分析仪:美国TA仪器公司。
1.2 方法
1.2.1 花生分离蛋白的提取
取一定量花生粕,按照质量比10∶ 1加入去离子水并调节pH至9.0,50 ℃水浴搅拌1 h,5 000 r/min离心20 min,取上清液继续调节pH至4.5左右,5 000 r/min离心20 min,弃掉上清液,收集沉淀,冷冻干燥即得到花生分离蛋白(蛋白含量86.95%)。
1.2.2 花生肽的制备
1.2.2.1 单酶酶解
取一定量的花生分离蛋白,按照质量比20∶ 1加入去离子水,调整pH值为添加酶制剂的最适pH值,分别加入不同种类的酶进行酶解,酶解后在95 ℃条件下灭酶,酶解液经5 000 r/min离心20 min,过滤后取上清液冷冻干燥即为花生肽。
1.2.2.2 双酶酶解
从1.2.2.1中选取螯合率和水解度最高的酶作为主要的最佳水解酶,在此基础上复配风味酶,水解酶与风味酶复配最佳比例为3∶ 2,以双酶同步和双酶分步2种方式进行酶解,酶解液以5 000 r/min离心20 min,收集上清液,冷冻干燥得到花生肽。
1.2.3 花生肽-钙螯合物的制备
称取一定量的花生肽加入去离子水配成一定浓度的多肽溶液,调节反应温度、pH值后加入一定量的无水氯化钙混匀进行螯合,反应结束后加入无水乙醇溶液,5 000 r/min离心20 min,取沉淀,将其置于冷冻干燥机中冻干得花生肽-钙螯合物粉末。
1.2.4 钙含量及螯合率的测定
钙含量测定:参照GB/T 5009.92—2016中的EDTA滴定法。
螯合率测定:采用EDTA络合滴定法[24]。

1.2.5 酶解产物水解度的测定
利用茚三酮比色法测定水解度(DH)[25]。
式中:N1为酶解样品的游离氮含量,mol/L;N0为花生分离蛋白的游离氮含量,mol/L;N总为总氮含量,mol/L。
1.2.6 单因素试验
分别考察肽钙质量比1∶ 2、2∶ 1、4∶ 1、6∶ 1、8∶ 1、10∶ 1,pH 4、5、6、7、8、9,温度30、40、50、60、70 ℃,时间30、40、50、60、70 min条件下花生肽-钙螯合物的螯合率。
1.2.7 响应面试验
在单因素试验的基础上以螯合率为响应值,采用Box-Behnken中心组合进一步优化反应条件。
1.2.8 紫外光谱分析
取适量的花生肽及花生肽-钙螯合物,配制成1 mg/mL的溶液,用紫外分光光度计在190~400 nm进行扫描,测定花生肽以及花生肽-钙螯合物的紫外吸收光谱。
1.2.9 红外光谱分析
取干燥的花生肽及花生肽-钙螯合物2 mg与适量KBr混匀压片至透明,利用红外光谱仪对样品进行扫描,扫描范围400~4 000 cm-1,测定花生肽以及花生肽-钙螯合物的红外光谱。
1.2.10 热重分析
分别称取花生肽及花生肽-钙螯合物10 mg于坩埚中,将坩埚置于热重分析仪中,测定温度25~600 ℃,升温速度10 ℃/min,N2流速30 mL/min,记录样品实时质量,计算并绘制质量损失率曲线。
1.3 数据分析
采用SPSS19.0分析数据,所有试验重复3次,结果用平均值±标准差表示。采用Origin9.0软件绘图。
2 结果与分析
2.1 蛋白酶种类对花生蛋白水解度的影响
由图1可知:花生蛋白的水解度均随着酶解时间的延长而增加,且在水解前期(30~120 min)增加幅度较大,这与酶的高效性有直接关系;在水解后期(120 min以后)5种蛋白酶水解度的增长速率都有所下降,但碱性蛋白酶的水解度仍高于其他4种蛋白酶。故选择碱性蛋白酶为水解花生蛋白的最佳蛋白酶。
2.2 蛋白酶种类对花生肽-钙螯合率的影响
由图2可知,花生肽的钙螯合率随着螯合时间的延长先上升后下降,主要是因为随着水解时间的延长,刚开始水解的肽链较多,暴露出来较多的末端氨基酸,能够促进螯合反应的进行。随着水解时间的延长,螯合率呈现下降的趋势,可能是因为一些花生肽被继续水解生成更小分子的肽段,而这些小分子肽段不利于与钙离子的结合,从而造成螯合率下降。5种蛋白酶中碱性蛋白酶的螯合率最高,因此选择碱性蛋白酶作为制备花生肽的水解酶。
2.3 酶解方式对花生肽-钙螯合率和水解度的影响
由图3可知,双酶酶解时,花生肽-钙螯合率和水解度有一定的提高,且分步酶解法的花生肽-钙螯合率和水解度显著提高。说明加入风味蛋白酶后,双酶酶解可以提升花生肽-钙螯合率和水解度,此外风味蛋白酶能剪切苦肽末端的疏水氨基酸,对苦味肽进行降解以达到脱苦的目的[26]。因此,采用碱性酶复配风味酶酶解进行后续螯合研究。魏新颜等[13]以淘汰蛋鸡为原料,利用木瓜蛋白酶复配风味蛋白酶进行酶解,发现产物的钙螯合能力优于单酶酶解。
2.4 单因素试验
2.4.1 肽钙质量比
由图4可知,随着肽钙质量比的增加,螯合率先增加后基本趋于稳定,螯合物中的钙含量呈现下降趋势。当肽钙质量比为1∶ 2时,肽未得到充分利用,此时钙离子含量过剩,钙含量较大,但螯合率较低;当肽钙质量比为10∶ 1时螯合率最大,此时钙含量较低;当肽钙质量比为6∶ 1时,螯合率基本已增加到最大值,且钙含量下降趋势不显著,螯合反应已经达到饱和状态。因此,在响应面设计时将肽钙质量比的中心试验点设为6∶ 1。
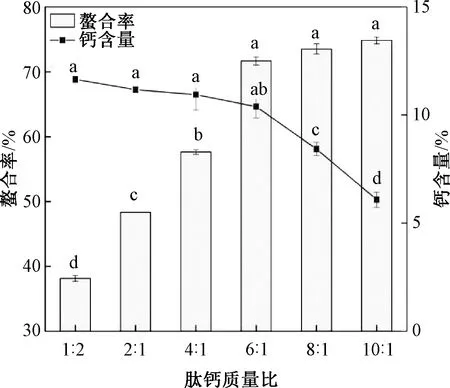
图4 肽钙质量比对花生肽-钙螯合率、钙含量的影响
2.4.2 pH值
由图5可知,随着反应pH值的不断增大,螯合率和钙含量均先上升后下降,在pH 8时,螯合率和钙含量均达到最大值。pH值较小时,过多氢离子会与肽的氨基结合,与Ca2+形成竞争关系进而阻碍肽和钙离子的配位[27],不利于形成肽钙螯合物。pH值过大时,氢氧根可与钙离子反应产生氢氧化钙沉淀,也不利于肽钙螯合物的形成。因此,在响应面设计时将pH的中心试验点设为8。
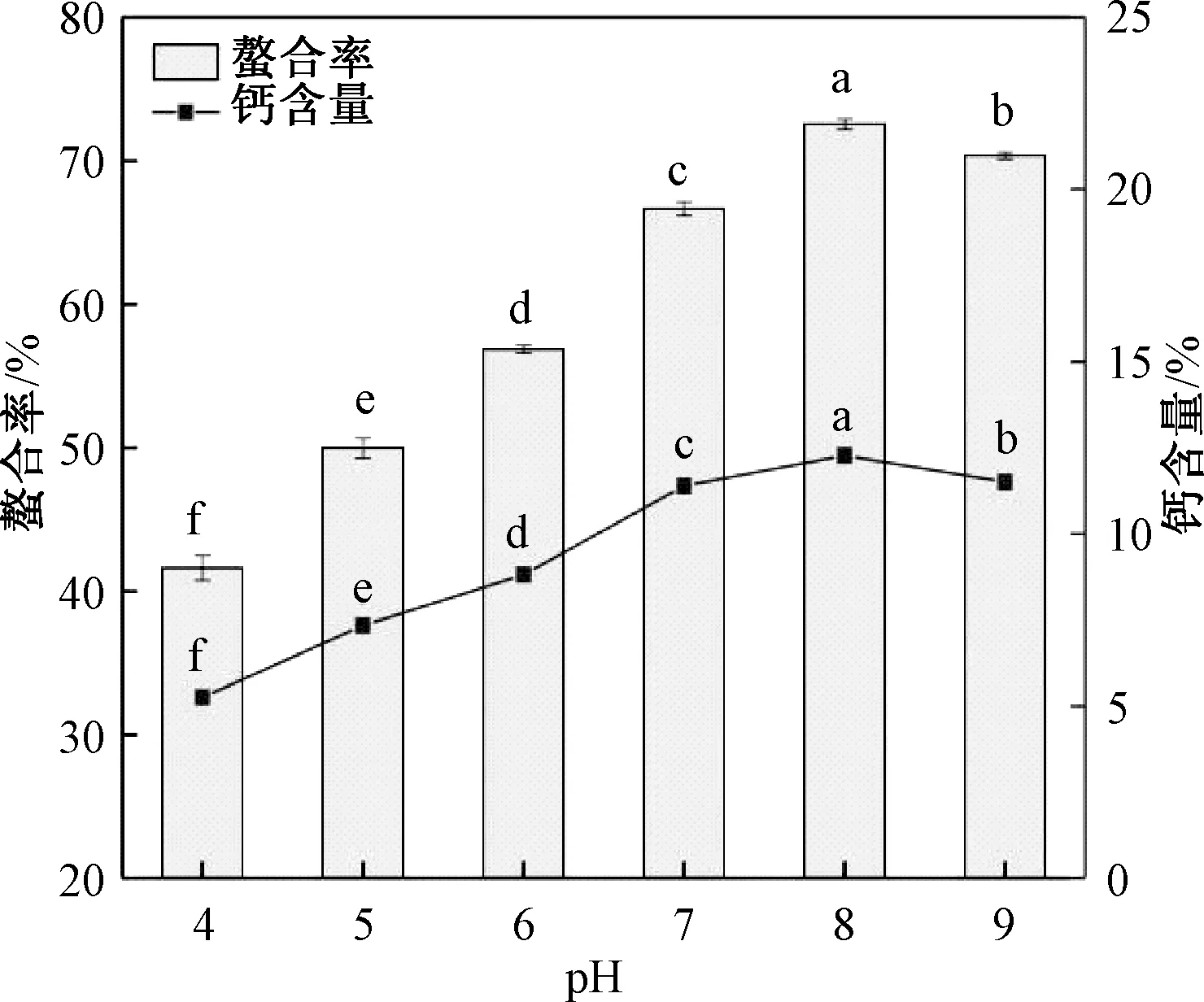
图5 pH值对花生肽-钙螯合率、钙含量的影响
2.4.3 螯合时间
由图6可知,反应30 min后螯合率和钙含量变化不显著, 50 min时螯合率和钙含量均达到最大值,时间继续延长时螯合率和钙含量小幅度下降,原因是反应时间过长,螯合物可能不稳定而发生分解[14]。说明螯合反应是快速反应,因此,选定螯合时间为50 min,在响应面试验中不再研究螯合时间对花生肽-钙螯合率的影响。
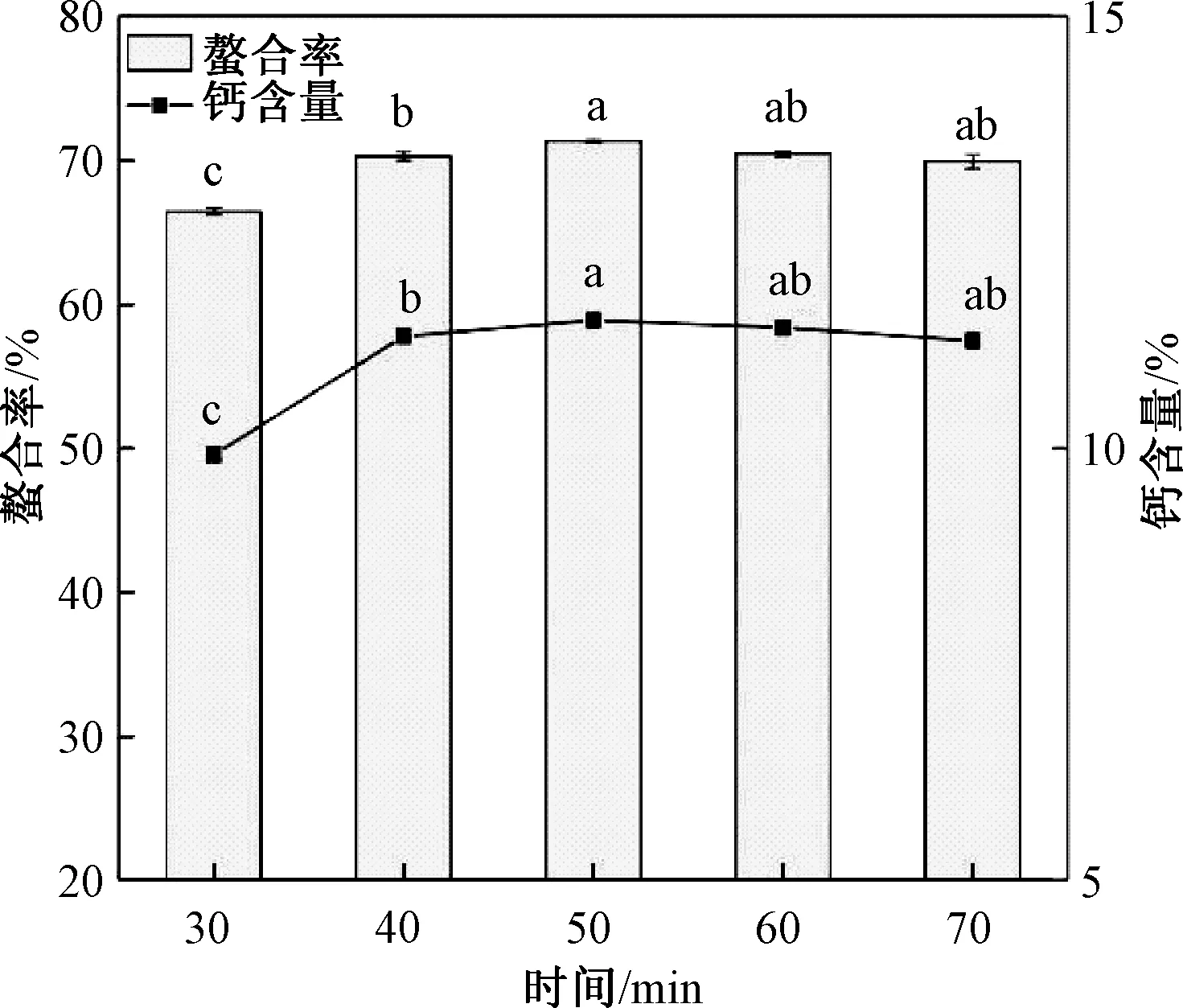
图6 时间对花生肽-钙螯合率、钙含量的影响
2.4.4 螯合温度
由图7可知,随着温度的升高,螯合率和钙含量均先上升后下降,在50 ℃时达到最大值。当温度升高时,分子之间发生碰撞,钙离子与氨基酸残基结合概率增大,螯合率上升。温度继续升高,花生肽的分子结构发生改变,分子之间会产生团聚,使可参与钙螯合的基团减少,螯合率下降,因此,在响应面设计时将温度的中心试验点设为50 ℃。
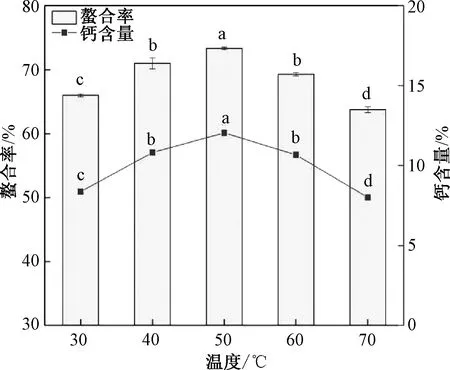
图7 温度对花生肽-钙螯合率、钙含量的影响
2.5 响应面试验
2.5.1 响应试验设计及结果
响应面试验因素与水平见表1。

表1 响应面因素与水平
响应面试验设计及结果如表2所示。对肽钙质量比、pH值、温度3个因素进行线性回归拟合,得到二次多项回归方程模型。
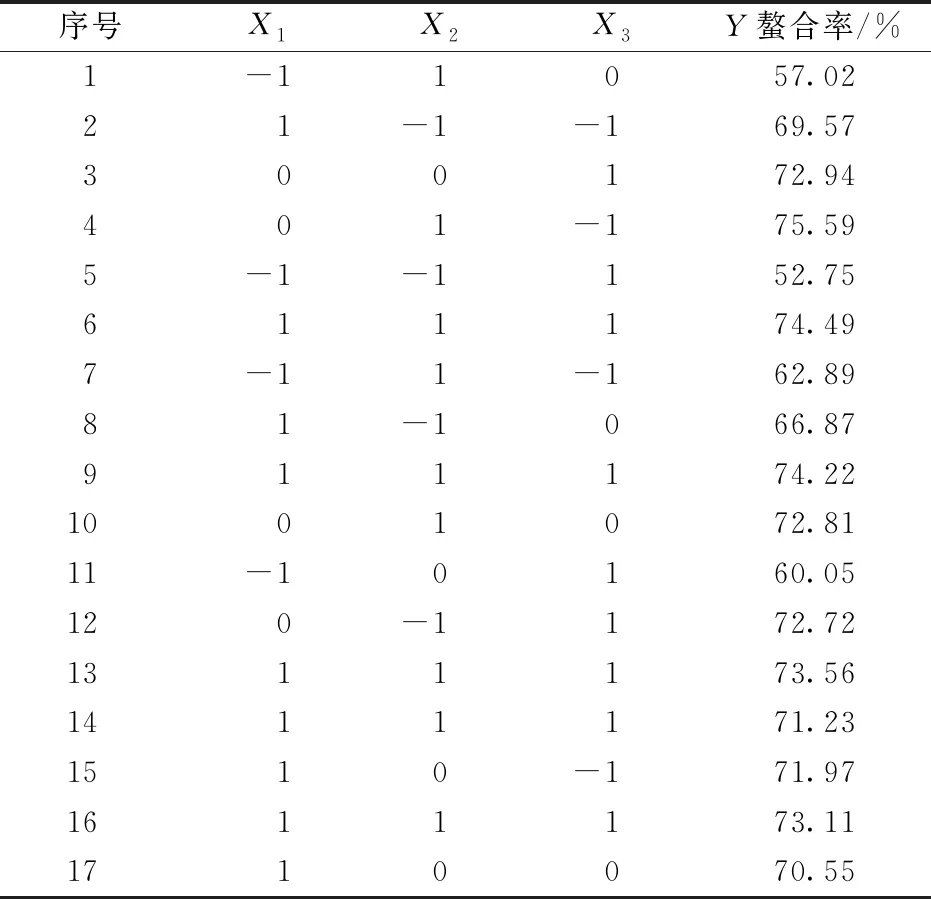
表2 响应面试验设计及结果
Y=73.32+7.67X1+1.7X2-1.6X3-1.77X1X2+0.77X1X3+0.32X2X3-5.68X12-3.02X22-0.56X32。
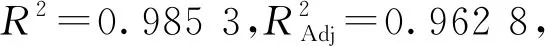
表3 回归模型方差分析
2.5.2 响应面分析
由图8可知,两个因素之间交互作用的等高线曲面形状为椭圆形,表明肽钙质量比与pH值之间存在显著的交互作用。肽钙质量比和pH值沿着曲面上升的斜率是陡峭的,且肽钙质量比对螯合率的影响要大于pH值。结合Design Expert试验设计软件分析得到最佳螯合条件为肽钙质量比7.185∶ 1、pH 7.547、温度46.839 ℃,此时螯合率预测值为75.75%。实际应用中调整肽钙质量比7.2∶ 1、pH 7.5、时间50 min,温度47 ℃,得到的螯合率为75.26%, 与预测值相差0.5%,与响应面预测值较为吻合。
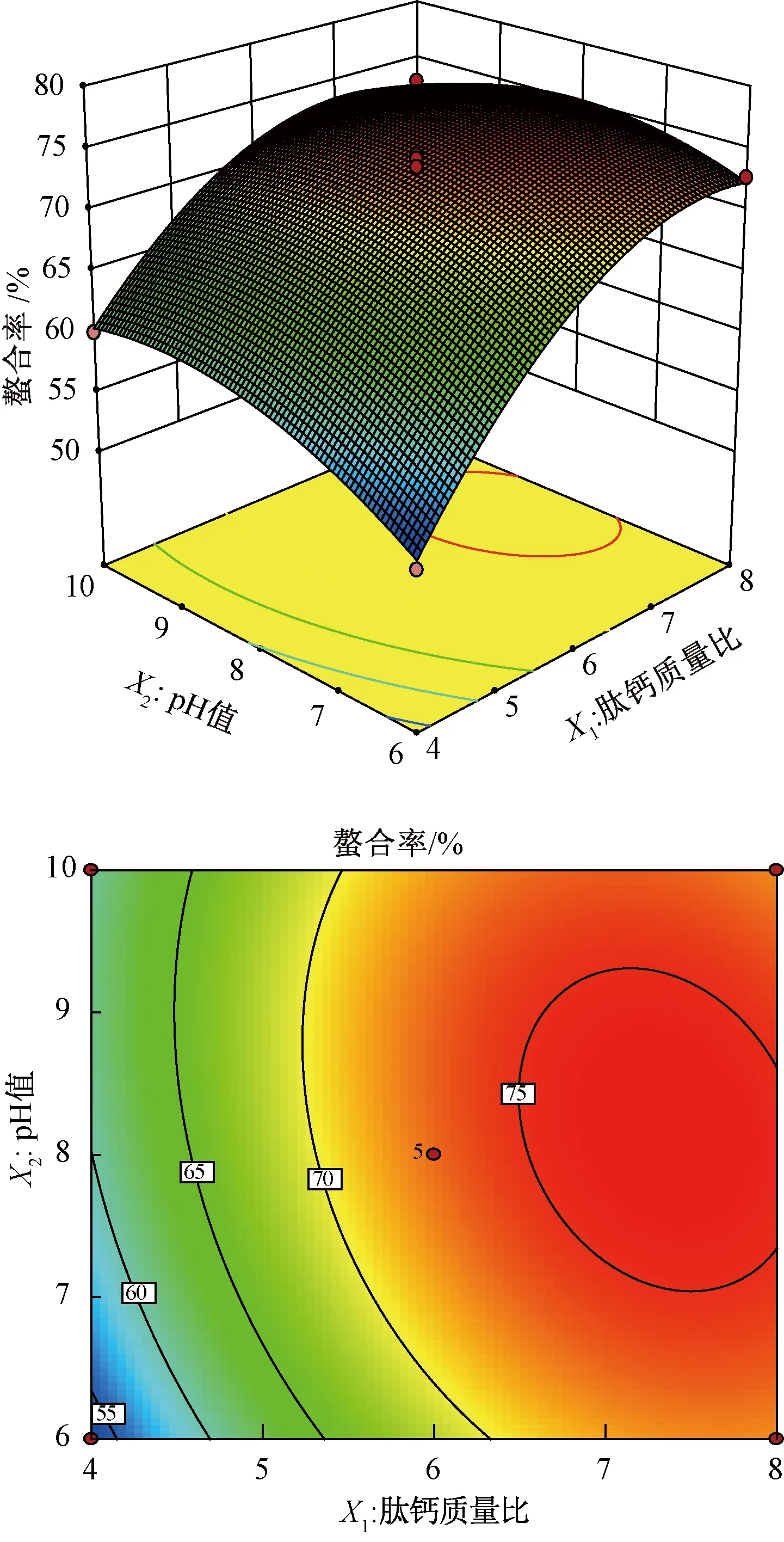
图8 肽钙质量比和pH值交互作用的响应面和等高线
2.6 花生肽-钙螯合物的结构表征
2.6.1 紫外光谱分析
由图9可知,在螯合反应前后,样品最大吸收波长的位置以及吸收强度均有所改变。在205 nm处有最大的吸收峰,这是肽中羰基的振动引起的一个特征吸收峰,与钙螯合后,吸收峰红移至208 nm,这可能是钙离子与肽键上的羰基发生了反应,影响了电子跃迁,导致吸收峰位置和强度发生改变[14]。另一个吸收峰出现在270 nm左右,这主要是多肽中的芳香族氨基酸构象变化所引起的紫外吸收特性[28]。钙离子与肽中的芳香族氨基酸反应,导致发色基团的改变以及电子的跃迁使吸收峰位置和强度发生改变。由紫外扫描光谱可知,肽与钙离子作用后形成了一种不同于多肽的新化合物。
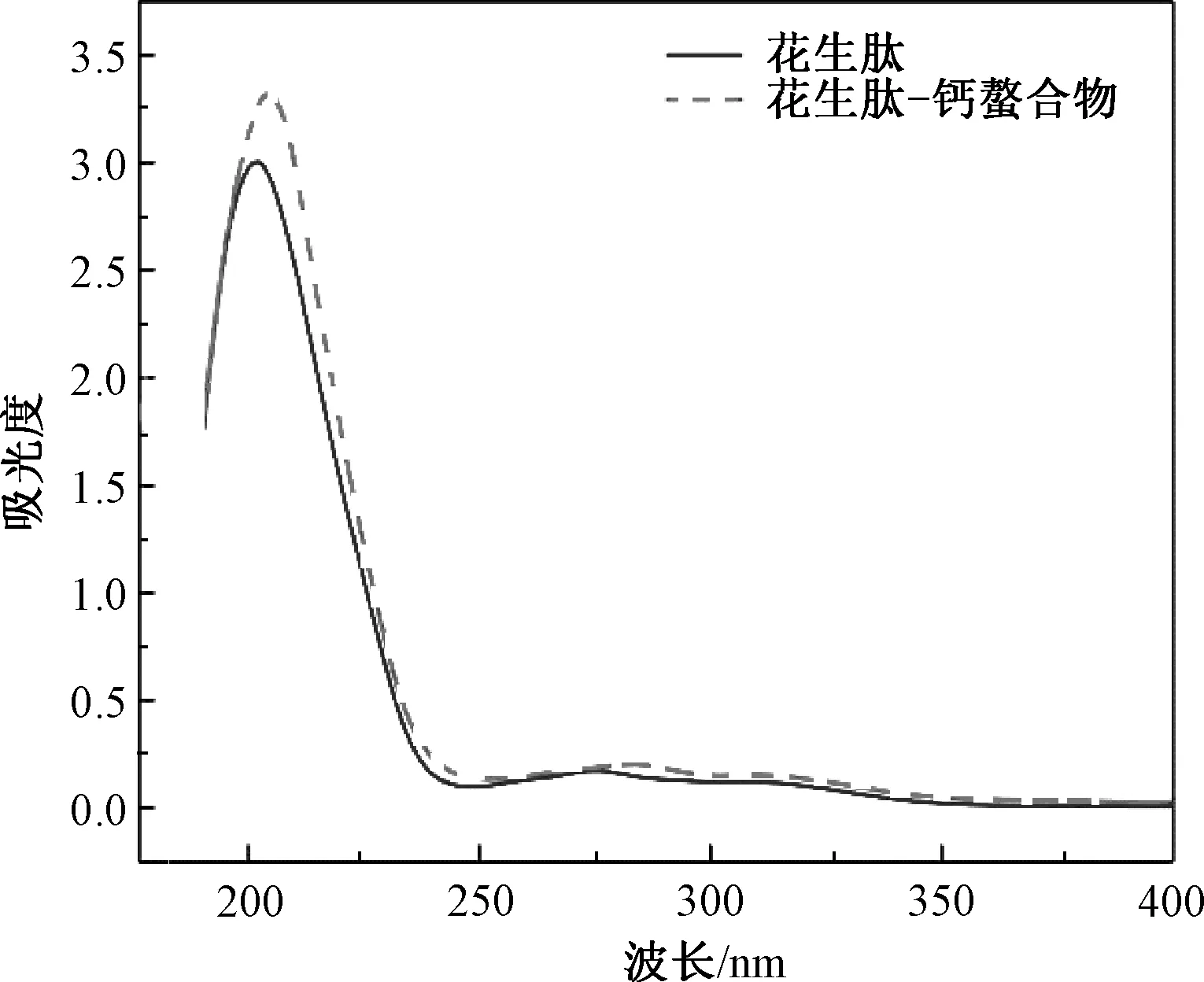
图9 花生肽与花生肽-钙螯合物的紫外光谱图
2.6.2 红外光谱分析

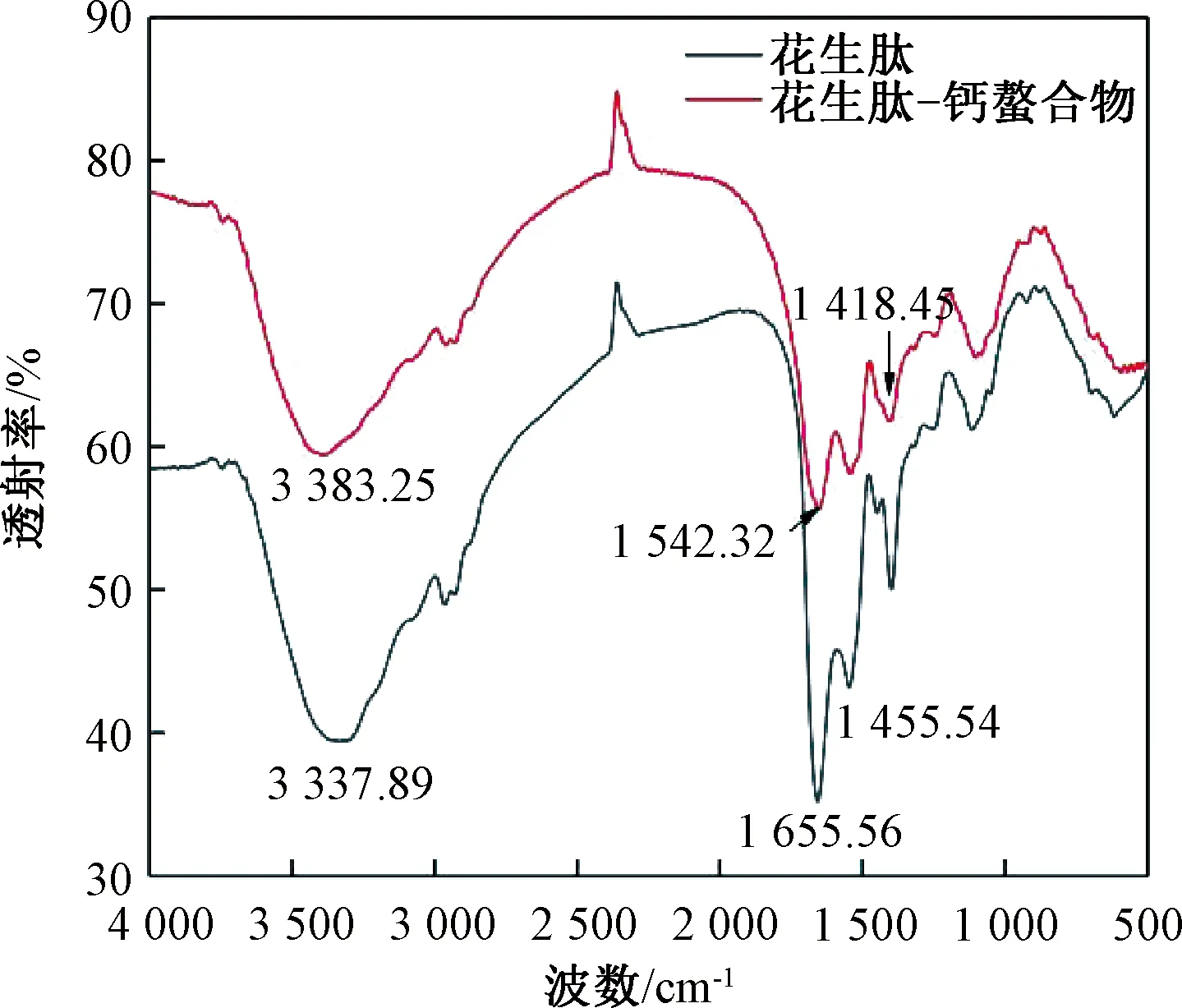
图10 花生肽与花生肽-钙螯合物的红外光谱图
2.6.3 TG热重分析
由图11可知,花生肽及肽-钙螯合物都出现2个失重区,从50~150 ℃为吸附水挥发阶段。花生肽及肽-钙螯合物在这一阶段质量损失大约为6%。温度继续升高,会使肽及螯合物上的化学键在高温下断裂,分解花生肽-钙螯合物的温度明显高于花生肽。表明花生肽-钙螯合可能生成了稳定的化学键,分解螯合物需要更多的能量,表明螯合物结构更加稳定。
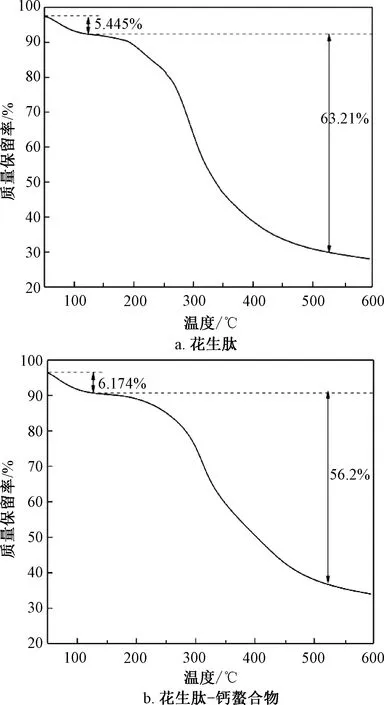
图11 花生肽与花生肽-钙螯合物的热重曲线
3 结论
将花生肽与钙离子进行螯合,研究了不同的酶解方式以及肽钙质量比、pH值、时间和温度对螯合率的影响,并采用光谱学及热力学方法分析螯合前后结构的变化。结果表明:碱性蛋白酶和风味蛋白酶双酶分步酶解的螯合率优于单酶及同步酶解;通过响应面优化的螯合工艺条件为肽钙质量比7.2∶ 1、pH 7.5、时间50 min,温度47 ℃,实际得到的螯合率为75.26%;光谱分析证明了多肽中氨基和羧基参与了螯合反应,形成了不同于花生肽的新物质。热重分析表明,花生肽与钙离子螯合后,生成的花生肽-钙螯合物具有更稳定的结构。本研究为新型肽钙制剂的开发及工业化生产提供了理论和技术指导。

