儿童良性癫疒间伴中央颞区棘波与SV2A基因多态性的研究
张羽航 徐向平
儿童良性癫疒间伴中央颞区棘波(benign childhood epilepsy with centrotemporal spikes,BECTS)为儿童期最常见的癫疒间综合征之一,迄今BECTS的病因尚不明确,大量研究证实该病为遗传相关性疾病,因此,本病的基因型研究已成为研究热点。SV2A是新型抗癫疒间药物左乙拉西坦的作用靶点,其通过参与调节神经递质的释放和囊泡循环维持突触囊泡的正常功能,在神经递质释放的过程中有一定的作用。左乙拉西坦可减少中央颞区棘波(central temporal spikes,CTS)放电,有效控制BECTS临床发作。由此推测SV2A可能参与了BECTS的发生,BECTS患儿体内可能存在SV2A基因的缺失或突变,导致该基因的异常表达,从而增加BECTS患病风险。
对象与方法
一、对象
1.BECTS组:符合诊断标准的儿童良性癫疒间伴中央颞区棘波(BECTS)患者69例,为哈尔滨医科大学附属第一医院儿科2014年9月至2016年11月期间门诊、住院处患儿。其中男性37例,女性32例,年龄3~14岁。所有患者均已行24 h脑电图证实存在CTS放电。
BECTS诊断标准根据2001年国际抗癫疒间联盟提出的癫疒间综合征的分类[1],即(1)首发年龄3~13岁,有自发缓解倾向,多在16岁以前消失;(2)临床主要表现为部分性发作,也可以继发全身强直阵挛发作,经常在睡眠中发作;(3)无智力障碍或者神经系统病变,无相关疾病既往史;(4)无精神疾病病史;(5)无营养不良、贫血、肝、肺、心、肾等慢性病史。
2.对照组:选择2014年9月至2016年11月期间哈尔滨医科大学附属第一院儿内科门诊和住院处的非BECTS的癫疒间患儿99例,其中男性57例,女性42例,年龄1~16岁,均已行24 h脑电图排除存在CTS放电,患者发作类型及频数分布见表1。

表1 对照组癫疒间发作类型及频数分布表Table 1 Epileptic seizure type and frequency distribution in control group
本研究中所有儿童及家长均在知情同意的情况下参加本研究,并签署知情同意书。本研究获得哈尔滨医科大学附属第一医院医学伦理委员会的批准。
二、方法
1.血液样品DNA的提取:
(1)准备。①移取5.5 Ml Protease Solvent放入含有冻干QIAGEN Protease的瓶子。②混合AL(含有高浓度的盐酸胍的裂解液)之前要摇晃混匀。③缓冲液(AW1、AW2)在第一次使用之前,添加适量的乙醇96%~100%,AW1加130 mL,AW2加160 mL。④准备PBS。⑤高压1.5 mL、2 mL离心管。
(2)过程。①移取20 uL QIAGEN Protease 放入1.5 mL离心管。②离心管里加入200 uL样品,200 uL全血与200 Ul PBS混合。③在样品里加入200μL Buffer AL,涡旋15 s。④56℃孵化10 min。⑤瞬离离心管。⑥在样品中加入200 uL乙醇,混合,涡旋15 s,瞬离1.5 mL离心管。⑦小心的将步骤⑥的混合物放在柱子上(在2 mL收集管里)不将边缘弄湿,关闭盖子,离心机在6 000×G(8 000转)1 min,把柱子放在干净的2 mL收集管里,丢弃含有滤液的管。⑧小心地打开QIAamp柱子在无润湿边缘加入500μL AW1。关闭盖子在离心机在6 000×G(8 000转)1 min,把QIAamp 柱子放在干净的2 mL离心管里,丢弃含有滤液的管。⑨小心地打开QIAamp柱子在无润湿边缘加入500μL Buffer AW2,关闭盖子,离心机在(20,000 xg;14,000 rpm) 3 min。⑩把QIAamp 柱子放在新的2 mL离心管里,丢弃旧的含有滤液的收集管,离心机13 000 rpm、1 min。⑾把QIAamp 柱子放在干净的1.5 mL离心管里,丢弃含有滤液的管,小心地打开QIAamp柱子,加入200μL Buffer AE,在室温(15℃~25℃)孵化1 min,离心6 000 g ×(8 000转)1 min。
2.引物设计:Agena公司在线引物设计软件Assay Design Suite v 2.0自动设计SNP基因分型的PCR引物和延伸引物,SNP位点引物设计序列详见表2。
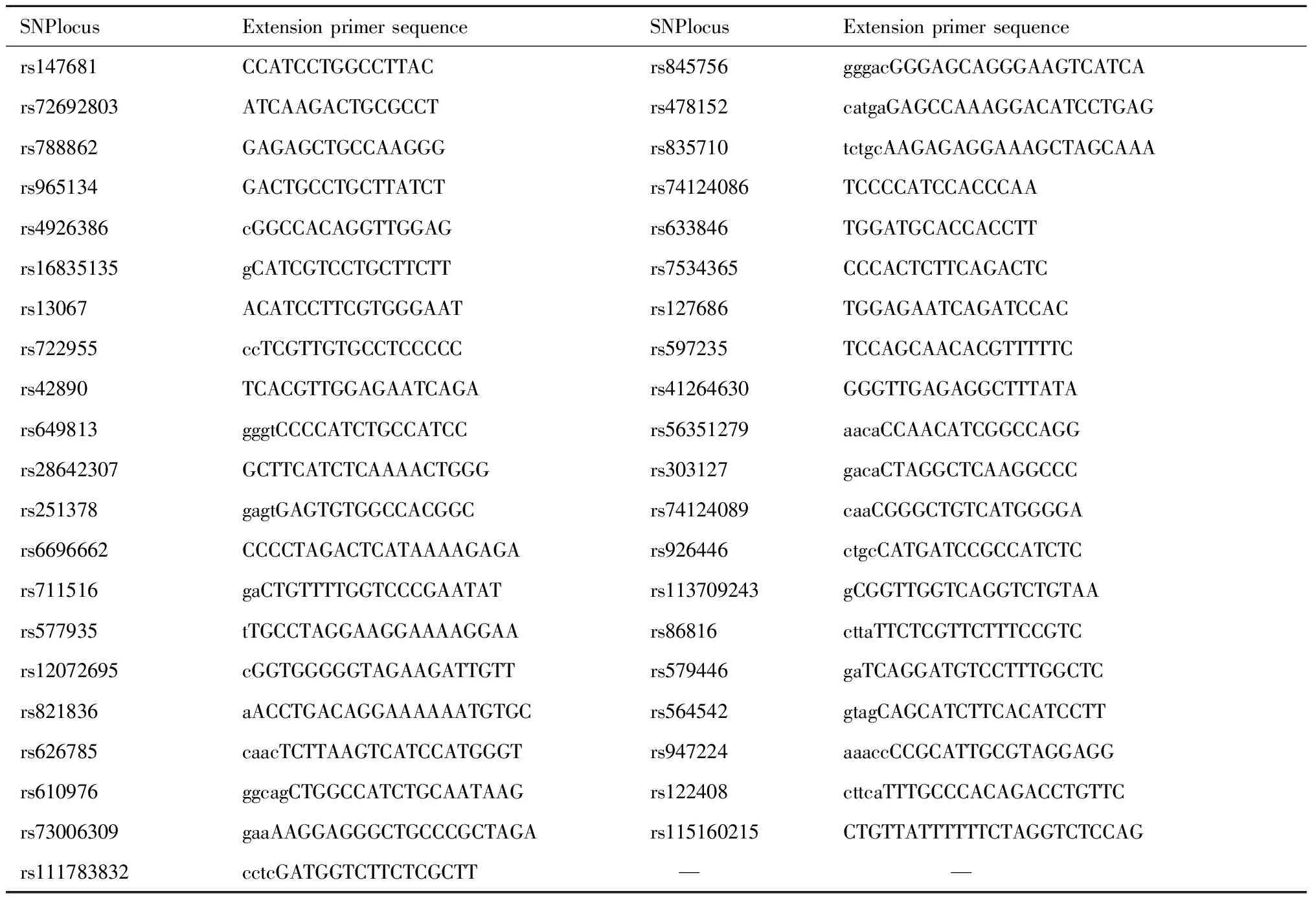
表2 引物设计序列Table 2 Primer design sequence
3.MassARRAY 基因分型实验:本实验部分由上海吉凯基因科技有限公司完成。
(1)Nanodrop DNA质检。用2μL纯化后的DNA经Nanodrop测量,质检合格后的DNA样本方可进行后续的分型实验(合格标准:DNA浓度 >10 ng/μL,不符合此条件则判定为该样本不合格,不进行后续分型实验)。本实验168例样本DNA质检全部合格,将质检合格的DNA浓度调整至50 ng/uL,转移至384孔板,-20℃储存备用。
(2)PCR扩增。采用多重PCR技术,在384孔板中进行,每个反应体系总体积为5 uL。① 在一个新的1.5 mL EP管中配制PCR master mix 溶液。配制PCR master mix 溶液见表3。

表3 master mix 溶液Table 3 Master mix solution
② 使用24通道加样器,调节加样体积为4 uL,在384孔板的每个加样孔中加入PCR master mix 溶液,该384孔板即为PCR反应板。
③取出已经制备好的DNA样品384孔板,使用24通道加样器,调节加样体积为1 uL,每个5 uL PCR反应体系中包含模板DNA 20~50 ng,Hotstar Taq 0.5 U,每条扩增引物0.5 pmol,0.1 uL的25 mM dNTPs。
④在兼容384孔板的PCR仪上设定PCR反应条件,即94℃ 4 min,94℃ 20 s,55℃ 30 s,72℃ 1 min,45个循环;72℃ 3 min,4℃ 保持。将384孔PCR反应板放置于PCR仪上,启动PCR反应。
(3)PCR产物碱性磷酸酶处理。①在PCR反应结束后,将PCR产物用SAP(虾碱性磷酸酶)处理,以去除体系中游离的dNTPs。
②配制碱性磷酸酶处理反应液,SAP Mix。见表4。

表4 碱性磷酸酶处理反应液Table 4 Reaction solution treated with Alkaline phosphatase
③使用24通道加样器,调节加样体积为2 uL,将SAP Mix加入384孔PCR反应板。对于每个碱性磷酸酶处理反应孔,反应体系总体积为7 uL,其中PCR产物5 uL,SAP混合液2 uL(SAP 0.5 U,buffer 0.17 uL)。
④将384孔板放置在兼容384孔板的PCR仪上,设定PCR反应条件为37℃ 40 min,85℃ 5 min;4℃维持,启动PCR仪进行碱性磷酸酶处理。
(4)单碱基延伸。
①在碱性磷酸酶处理结束后,进行单碱基延伸反应,反应体系总体积9 uL。
②配置单碱基延伸反应液,EXTEND Mix。见表5。

表5 单碱基延伸反应液Table 5 Single base extension reaction solution
③使用24通道加样器,调节加样体积为2 uL,将EXTEND Mix对应加入384反应板。对于每个反应孔,单碱基延伸反应体系包括SAP处理后PCR产物7 uL,EXTEND Mix液2 uL(其中各延伸反应引物混合物0.94 uL,iPLEX酶0.04 uL,延伸混合物0.20 uL)。
④将384孔板放置在兼容384孔板的PCR仪上,设定PCR反应条件,94℃ 30 s,94℃ 5 s,52℃ 5 s,80℃ 5 s,52℃ 5 s;四个循环;94℃ 5 s;39个循环;72℃ 3 min,4℃ 维持,启动PCR仪进行单碱基延伸反应。
(5)树脂纯化。
①将Clean Resin树脂平铺到6 mg的树脂板中。
②加16 uL水加到延伸产物的对应孔内。
③将干燥后的树脂倒入延伸产物板中,封膜,低速垂直旋转,引物充分接触。
④离心使树脂沉入孔底部。
(6)芯片点样。扩增产物经树脂除盐纯化后,点样到覆盖有基质的SpectroCHIP芯片阵列中。
(7)质谱检测。基质表面的分子基质表面的分子,在激光的照射下解吸并电离,电荷离子按照其质荷比率在加速电场真空小管中飞行到达检测器。
(8) 数据分析。MassARRAYTyper软件自动解读质谱检测的分子量峰,转化显示为SNP位点所对应的分子量质谱峰图。
4.统计学处理:应用SPSS19.0软件进行分析,采用卡方检验比较各个SNP位点基因型在BECTS组和对照组的差异关系。计算比值比(odds ratio,OR),P<0.05为差异有统计学意义。
结 果
通过对BECTS组和对照组癫疒间患者41个SNP位点基因型进行检测,发现有33个位点两组均为同种纯合基因型,组间差异无统计学意义,见表6;有8个位点两组含有纯合基因型与杂合基因型两种类型,其中rs577935位点,BECTS组为62例GG纯合型,7例AG杂合型;对照组为77例GG纯合型,22例AG杂合型,携带GG基因型为携带AG基因型患病率的2.531倍,差异具有统计学意义;而rs111783832位点,BECTS组全部为TT纯合型,对照组有50例为TT基因型,43例存在T碱基缺失,差异具有统计学意义,其余位点差异均无统计学意义。见表6。
一、SNP基因分型结果
检测中DNA标本全部合格,99.6%的样本位点具有分型结果。见表6。
二、统计分析
上述表6中所列BECTS组及对照组基因型均为纯合型的位点,两组间基因型差异无统计学意义,不纳入统计学分析,现就rs564542,rs12072695,rs28642307,rs4926386,rs577935,rs626785,rs115160215,rs111783832共8个位点两组基因型进行分析,结果见表7。
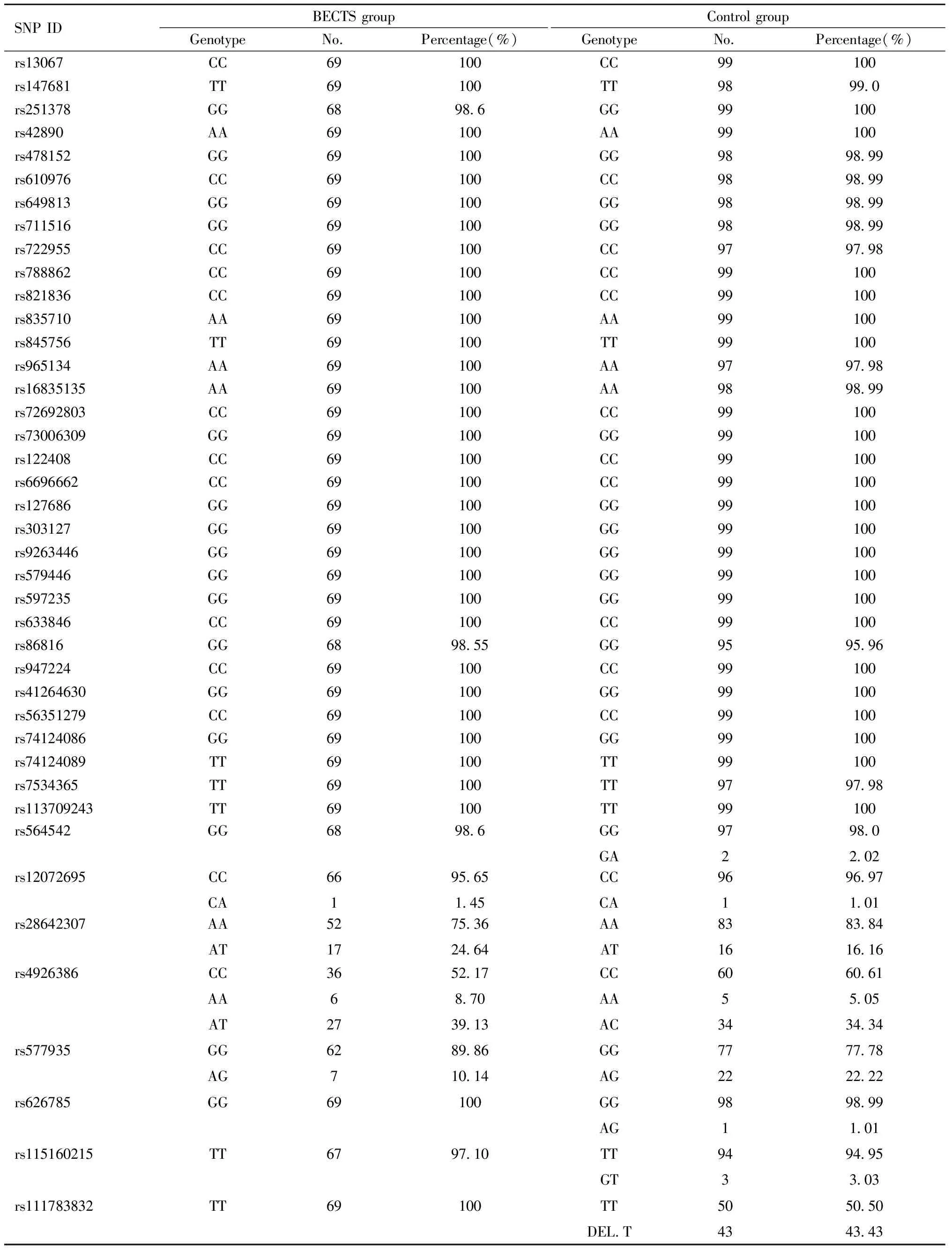
表6 SNP基因分型结果Table 6 SNP genotyping results
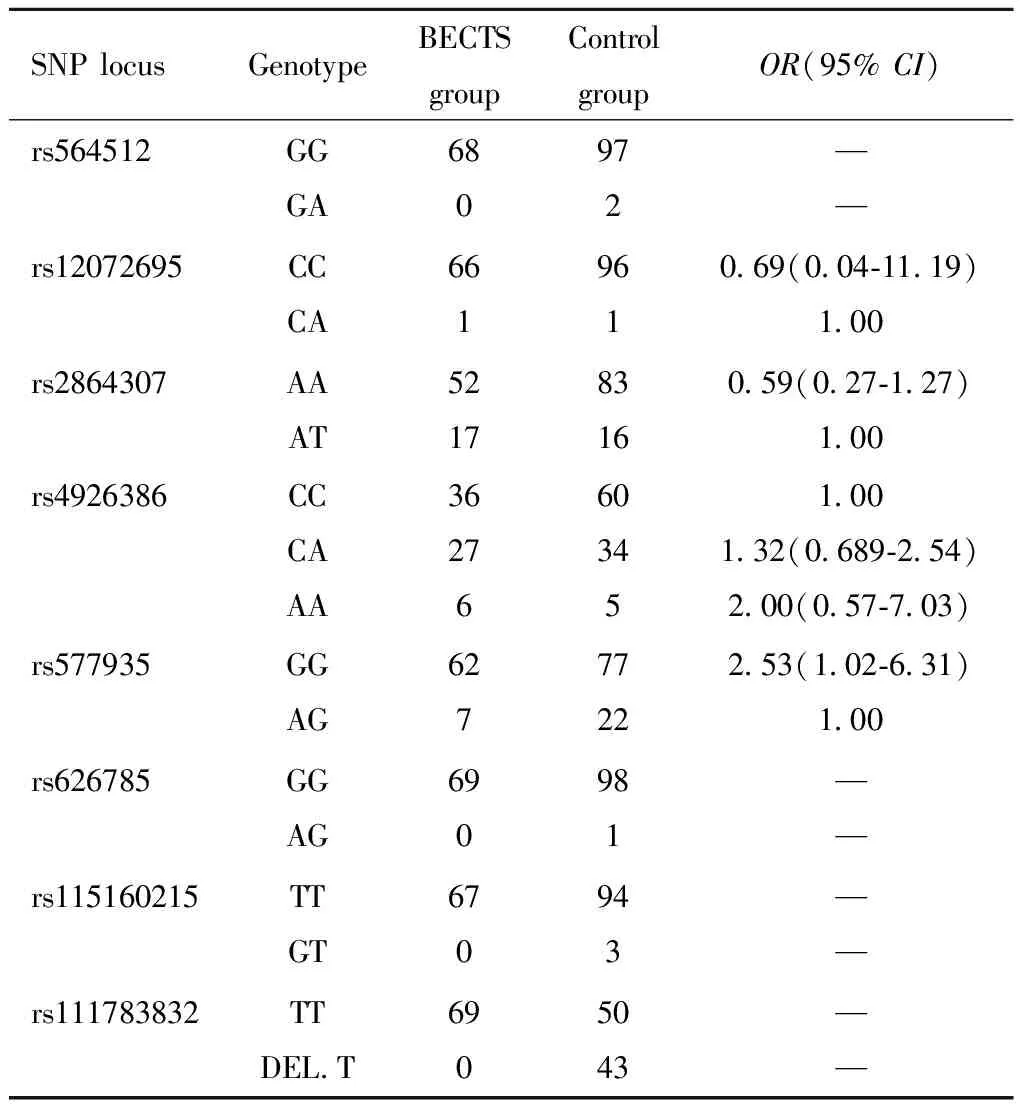
表7 BECTS组与对照组SNP位点基因型比较 Table 7 Comparison of SNP locus genotype between BECTS group and control group
讨 论
单核苷酸多态性(SNP)是指基因水平某特定核苷酸位点存在两个不同的碱基,其中最少的一种在群体中的频率大于1%, SNP主要由单个碱基转换或颠倒(如G->A,T->C ),亦有部分发生于嘌呤和嘧啶之间的颠换[2]。继微卫星之后,SNP成为了第三代遗传标记,在人体基因组中每1 000个碱基就有一个SNP,人体许多表型上的差异和对疾病的易感性等都可能与SNP有关。
BECTS是儿童时期最常见的癫疒间综合征, 1989年国际抗癫疒间联盟协会将其归入到原发性部分性癫疒间综合征,2001年国际抗癫疒间联盟的重新分类中,把BECTS归入到与部位及患者年龄大小有关的特发性癫疒间综合征,发病的年龄在3~13岁之间,其中8~10岁为发病高峰[1]。BECTS脑电图最显著特点是双侧、局灶性棘波或尖波放电,后面常跟有慢波[3]。CTS可能是BECTS临床亚型和遗传学证据的亚临床标记。最近的家系研究发现BECTS在有热性惊厥及癫疒间失语谱系障碍的家族中发病率增加[4]。许多位点或基因与CTS放电有关,Neubauer等[5]研究发现少数BECTS患者与KCNQ2和KCNQ3有关,Roll等[6]在同时伴有精神发育迟滞、严重的语言障碍和中央颞区癫疒间的两个家庭发现SRPX2的突变,全基因组关联分析发现BECTS及CTS放电与ELP4有关[7],此外, Endele等[8]在一个早发性癫疒间脑病伴CTS放电的女孩基因发现GRIN2A突变。Lal等[9]发现RBFOX1和RBFOX3基因的突变与BECTS发生有关。然而,所有这些发现仅局限在单个患者、几个患者或小家系,缺乏群体共性。
人类SV2A基因位于1号染色体的长臂2区1带2亚带,约含有14 565个碱基对,其编码的mRNA含有13个外显子,含有4 353个碱基对,其翻译的蛋白质分子量为82.6 KD,由742个氨基酸构成,SV2A的启动子区的共同序列原件中包含了不同的转录因子,如adaptor protein-1、p53、RSRFC4、interferon regulatory factor1、ary1 hydrocarbon receptor和Pax-2[10]。但尚无证据显示这些转录因子参与调控SV2A的表达。SV2A含有12个疏水跨膜区和1个含3个N-糖基化位点的突触泡内大环。SV2A胞质面N端第57个氨基酸是与Ca2+敏感蛋白突触结合蛋白(synaptotagmin,SYT-1)C2B结构域相互作用的主要部位。SYT-1是Ca2+通路介导胞吐过程的第一个受体,SV2A和SYT-1以Ca2+依赖的方式相互作用。SV2A N端含酪氨酸的内吞膜体结构(Tyr46)对SV2A和SYT-1向囊泡表面运输起着关键作用;SV2A同样包含有ATP结合位点,分别位于TMR1和7胞质端内侧部分,因而推测它可能是一个ATP结合蛋白,并且由腺嘌呤核苷酸调控着突触囊泡的引燃过程[11]。
SV2A存在于低等脊椎动物和高等哺乳动物的神经元和内分泌细胞中,主要表达在突触密集的区域,可维持神经递质的正常功能,在颞叶癫疒间和海马硬化患者海马中的SV2A会明显减少[12],有研究表明SV2A表达的减少可能会造成神经元网络的不稳定性从而引起癫疒间的发生[13-14]。2015年,Serajee等[15]发现难治性癫疒间患者SV2A基因的纯合突变,该突变基因位于SV2A基因外显子5,导致氨基酸第383位点(R383Q)发生精氨酸—>谷氨酸的改变,其父母均为R383Q突变位点的携带者,这说明该突变为隐性突变,目前R383Q变化在已知健康人群、外显子组数据库及SNP数据库未被检测到。此例报道为SV2A基因突变导致癫疒间的第一例。
SV2A基因rs577935 SNP位点位于SV2A基因内含子区域和5′非翻译区,等位基因为G/A。本研究通过搜集BECTS患儿与非BECTS癫疒间患儿的EDTA抗凝全血标本,提取血液DNA,进行SV2A基因41个SNP位点基因型检测,结果发现有33个位点BECTS组与非BECTS组均为同种纯合基因型,两组间无差异;有7个位点BECTS组与非BECTS组含有纯合基因型与杂合基因型两种类型,其中rs577935位点,BECTS组为62例GG纯合型,7例AG杂合型;对照组为77例GG纯合型,22例AG杂合型,携带GG基因型为携带AG基因型患病率的2.53倍,差异具有统计学意义,其余位点差异均无统计学意义。由此推测,SV2A基因rs577935 SNP位点携带等位基因G/A,当发生A->G的变异时,则增加了BECTS发病的风险。
SV2A基因rs111783832位点位于SV2A基因内含子区域,携带等位基因-/T,在本研究中BECTS组基因型全部为TT纯合型,对照组共有99例,其中有50例为TT纯合型,43例为DEL.T,差异具有统计学意义。由此推测,当SV2A基因rs111783832位点的基因型为TT型时,BECTS发病风险将明显增加。SV2A基因rs577935和rs111783832位点均位于非编码区域,当这两个位点的基因发生变异时,会导致转录过程中的异常剪接,从而导致功能性SV2A蛋白含量的下降,进而引起神经元网络的异常,促进BECTS的发生。
综上所述,SV2A基因rs577935 SNP位点的GG基因型可能与BECTS发生有关;SV2A基因rs111783832 SNP位点的TT基因型可能与BECTS发生有关。基因型的确定可以帮助BECTS的诊断和治疗,特别是对于药物控制不理想的患者,在应用左乙拉西坦治疗的同时,未来或许能够实现对其采取基因治疗的方法;对患者子代SV2A基因位点进行检测,或可以早期干预,减少其发病几率,提高生活质量。

