氯化胆碱-草酸低共熔溶剂处理含铁尘泥制备纳米氧化铁及动力学研究
曹雪辰,周东杰,姚海威,居殿春
(江苏科技大学张家港校区冶金与材料工程学院,江苏张家港215600)
钢铁冶金行业一直是中国基础设施建设的重要组成部分,在中国经济发展中发挥了重要作用,但是在钢铁冶金的生产过程中会排出大量的固体废弃物,冶炼尘泥是其中一种含铁量很高的固体废弃物,包括烧结粉尘、转炉粉尘、电炉粉尘等[1-3]。目前对含铁粉尘的附加值利用率很低,大部分以堆积或直接出售的方法进行处理,会造成资源浪费与环境污染。为积极响应国家环保政策,提高企业经济效益,钢铁企业需要对含铁尘泥进行更好的利用。
近年来,低共熔溶剂(Deep Eutectic Solvents,DES)开始进入人们的视野,这是ABBOTT等[4-6]发现的由氢键受体与氢键供体按照一定比例合成的一种新型绿色溶剂[7],由于其稳定性能优异[8-9]、挥发性低[10-11]、溶解能力强[12-13]、电导率高[14]等优点,在萃取提纯[15]、材料科学[16]、电化学[17]、化工[18]等领域引起深度关注并获得了优异的实验效果。低共熔溶剂原料廉价、制备简单、利用率高、污染小,是一种更为安全环保、经济实用的新型溶剂。
虽然低共熔溶剂具有诸多优点,但在进行处理金属氧化物时也存在一些问题:例如氢键受体如季铵盐在强碱和高温条件下,容易发生Hofmann消除反应生成副产物;由于在423 K时尿素会发生热分解,当氢键供体是尿素时,反应不能在高温环境下进行[19];氯化胆碱-尿素低共熔溶剂对氧化铁、氧化铝等金属氧化物基本不溶解。因此本文选取氯化胆碱-二水合草酸作为低共熔溶剂,通过选择性溶解特定离子胆碱溶液中的金属氧化物[20]来对含铁烟尘进行处理。
当结构单元尺寸在1~100 nm时,纳米结构材料将产生物理和化学性质显著的变化如表面效应、体积效应、量子尺寸效应。由于其特殊的性质,纳米材料被广泛应用于冶金、化工、医药等各个行业,其中纳米氧化铁具有粒径小、比表面积大、孔隙多等优秀的性能,具有广阔的应用前景。近些年来,纳米氧化铁被普遍用作高温脱硫剂[21],这对纳米氧化铁的可控合成与晶粒生长状况要求很高,且与制备方法的影响密不可分。目前纳米材料的制备方式多种多样,包括沉淀法、溶胶-凝胶法、水热法、模板合成法、热等离子法、固相反应法等[22]。
雷震[23]对含铁尘泥的浸出结果研究表明氯化胆碱-二水合草酸低共熔溶剂(CC-OA DES)对ZnO、Fe2O3及一些氯化物具有良好的溶解度,该体系可以较强地浸出尘泥中所含的Zn和Fe,在冷却与加水稀释时,Zn可以迅速析出,而Fe析出则需要较长时间静置,通过这种方法能浸出烟尘中Zn和Fe并实现分离的目的。张远等[24]研究表明:CC-OA低共熔溶剂的制备可以采用物质的量比为1∶1的氯化胆碱和二水合草酸在363 K下混合加热后形成透明溶液,经室温冷却后形成熔点为282 K的液体。同时CC-OA低共熔溶剂是制备纳米氧化铁的理想溶剂,不仅可以提供制备纳米氧化铁的反应源,而且兼有表面活性剂的功能。
本文运用CC-OA低共熔溶剂处理含铁粉尘制备前驱体,将前驱体放入马弗炉中焙烧制得纳米氧化铁,对处理过程中前驱体热分解及不同时间与温度下纳米氧化铁晶粒生长情况进行动力学分析以确定最佳的焙烧条件,对最佳条件下得到的纳米氧化铁进行表征,为后续纳米氧化铁的可控合成与性能优化提供理论基础。
1 实验(材料与方法)
1.1 实验原料与仪器
实验原料:氯化胆碱(分子式为C5H14ClNO)、二水合草酸(分子式为C2H2O4·2H2O),均为分析纯;含铁粉尘来自江苏沙钢集团。
实验仪器:UlitimaⅣ型X射线衍射仪;EDX-7000型X射线荧光光谱仪;SU8010型冷场发射扫描电子显微镜;LA950型激光粒度仪;D-09123型热重差热分析仪。
1.2 样品制备
氯化胆碱、二水合草酸在363 K下干燥8 h备用。将氯化胆碱和二水合草酸按照物质的量为1∶1准确称量后进行混合,在363 K下油浴加热并搅拌,一段时间后得到无色澄清溶液,所得溶液即为CC-OA低共熔溶剂。取5.0 g含铁粉尘(经水洗处理,水洗条件为固液体积比为1∶3、时间为5 min、温度为323 K)加入到50 mL CC-OA低共熔溶剂中,在363 K下油浴加热并搅拌,直至溶液澄清;取上层清液加入到300 mL去离子水中搅拌1 h并过滤,在378 K下干燥2 h得到前驱体;前驱体在673 K下焙烧2 h即得到纳米氧化铁。
2 结果与讨论
2.1 前驱体的表征
氧化铁溶解在CC-OA DES中,经过水解反应,析出沉淀物,其XRD分析见图1。由图1可知,前驱体为草酸亚铁二水合物FeC2O4·2H2O。前驱体的扫描电镜照片见图2。由图2可以看出,前驱体呈均匀棒状聚集在一起,平均粒径较小。
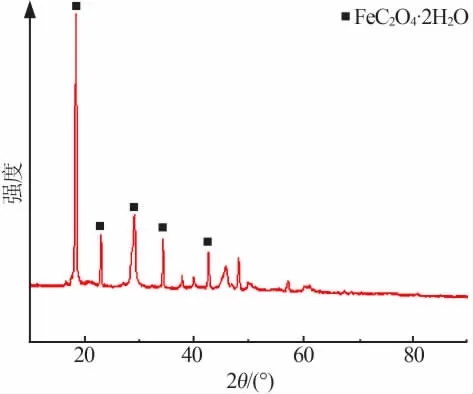
图1 前驱体XRD图谱Fig.1 XRD pattern of the precursor

图2 前驱体的扫描电镜照片Fig.2 SEM image of the precursor
前驱体差热曲线见图3,其升温速率为10 K/min,保护气体为N2。由图3可知,FeC2O4·2H2O的分解分为两个阶段,第一阶段在423 K左右,是草酸亚铁二水合物粉体表面水分的脱附阶段;第二阶段在673 K左右,是二水合草酸亚铁热分解(式1)阶段。
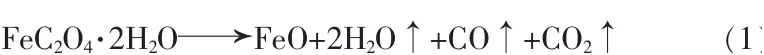
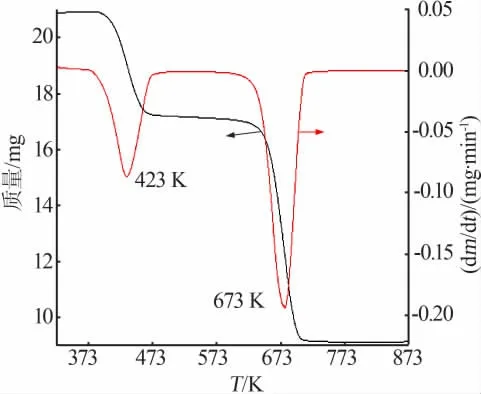
图3 前驱体热分析曲线Fig.3 Thermal analysis curves of the precursor
2.2 等转化率法前驱体热分析动力学
热分析动力学直接检测体系内某一物理性质的变化,能够同时得到反应过程中相应物理性质变化的动力学信息,主要分为模型函数法和等转化率法。模型函数法需选择或假定合适的反应机理函数,对复杂的非基元反应,很难找到较为符合的机理函数。而等转化率法无需反应机理函数,可根据相同的转化率直接求解出反应活化能。此处运用Ozawa[25]方程 法、Kissinger-Akahira-Sunose[26]方 程 法 和Starink[27]方程法3种等转化率法,求解前驱体草酸亚铁二水合物(FeC2O4·2H2O)的反应活化能E(kJ/mol),通过3种方程计算结果互相验证得到最符合的动力学参数。通过等转化率法前驱体热分析动力学计算得到反应活化能可以补充和完善草酸亚铁前驱体热分析和动力学相关参数,对制备不同形貌与粒径的纳米氧化铁具有一定的参考价值。反应活化能越低,则在指定温度下活化分子数越多,反应进行得越快。对于一般的热分解过程,反应方程式为:

热分解动力学积分形式可表示为:

热分解动力学微分形式可表示为:

阿仑尼乌斯公式反应速率常数与温度呈指数关系:

式中:α为反应的转化率;t为时间,s;k为反应速率常数;f(α)为反应函数微分式;G(α)为反应函数积分式;A为频率因子;E为反应活化能,kJ/mol;R为物质的量气体常数,J/(mol·K)。
Ozawa方程如下:

Kissinger-Akahira-Sunose方程如下:

对不同加热速率β(k/min)下进行测定,选择T曲线峰值对应的温度Tp,可知ln(β/Tp2)与1/Tp成线性关系,对数据进行直线拟合,由斜率可求得E。
根据Kissinger-Akahira-Sunose方程,Starink在其基础上提出了更加符合反应的Starink方程:
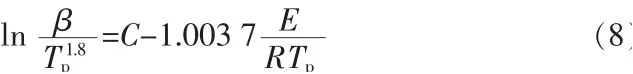
式中:C为常数项。对数据进行拟合后由斜率可得反应活化能E。
前驱体的热分解分为两个阶段,第一阶段为草酸亚铁二水合物脱附水分;第二阶段为草酸亚铁热分解阶段。此处以第二阶段草酸亚铁热分解为等转化率法热分析动力学的研究目标,其升温速率为5、10、15、20、25 K/min的TG曲线如图4a所示。在不同升温速率下热分解速率不同,升温速率越慢,热失重曲线越滞后。目标温度相同时,由于样品升温时间较少的样品前驱体受热相对不均匀,难以完全受热分解,所以热分解的失重阶梯出现滞后。DTG曲线见图4b,DTG峰值自右到左对应的升温速率逐渐降低。
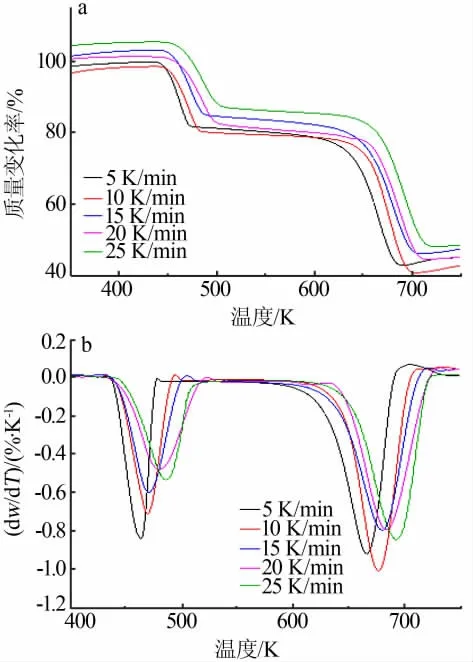
图4 前驱体不同升温速率TG及DTG曲线Fig.4 TG and DTG spectra of precursors at different heating rates
图5 为前驱体不同升温速率时的转化率。如图5看出,不同加热速率的前驱体转化率随加热速率的函数从左到右逐渐增加,如果加热速率慢,温度上升到所需温度的时间长,该加热速率的前驱体受热更均匀、更完全,因此加热速率较低的前驱体可以充分吸收热量并进行分解反应;而加热速度较快,前驱体在较短时间内上升到所需温度,会导致前驱体受热不均匀、不充分。在较高的加热速率下,前驱体不能充分吸收热量,前驱体的分解温度高于升温速率较慢时的分解温度。
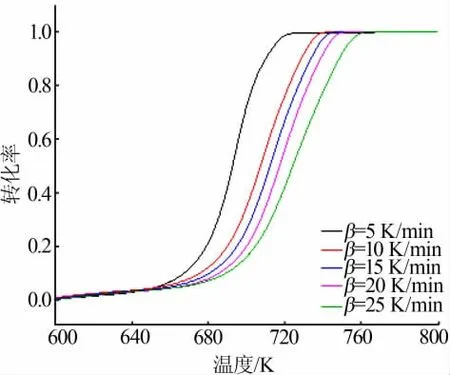
图5 前驱体不同升温速率时转化率Fig.5 Conversion rates of precursor at different heating rates
根据Ozawa方程:
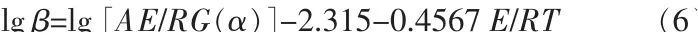
取不同升温速率β下曲线的等转化率α处的温度T,对lg β-1/T作图见图6。由拟合直线斜率k=-0.456 7E/RT求得对应于α的反应活化能E。不同α所求得的E即为前驱体热分解不同阶段反应活化能。表1表示直线对应的斜率和活化能。由表1可以看出,随着转化率的减少,热分解活化能逐渐增加,其平均值为219.68 kJ/mol。
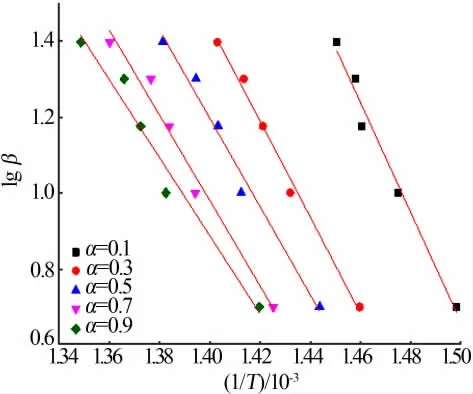
图6 前驱体热分解不同转化率时lg β对1/T线性拟合Fig.6 Linear fit of lg β to 1/T for different conversion rates of precursor thermal decomposition
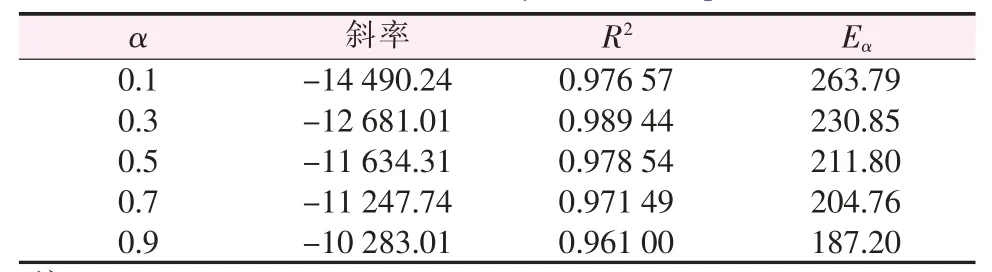
表1 Ozawa方程法不同转化率时热分解动力学参数Table 1 Thermal decomposition kinetic parameters at different conversions by Ozawa′s equation
根据Kissinger-Akahira-Sunose方程得到的不同升温速率与其对应的热分解峰的峰值如表2所示,随着升温速率的增大,热分解峰值的温度也逐渐增加。图7为ln(β/Tp2)对1/Tp作图的拟合直线,拟合方程为y=-26 706.60x+28.787 19,R2=0.963 98,由直线斜率k=-E/R可计算得到热分解反应活化能,计算得到的活化能为222.04 kJ/mol。
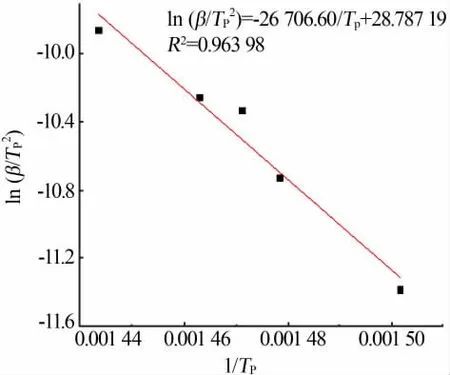
图7 Kissinger-Akahira-Sunose方程法计算直线拟合Fig.7 Calculation of straight line fitting by Kissinger-Akahira-Sunose equation
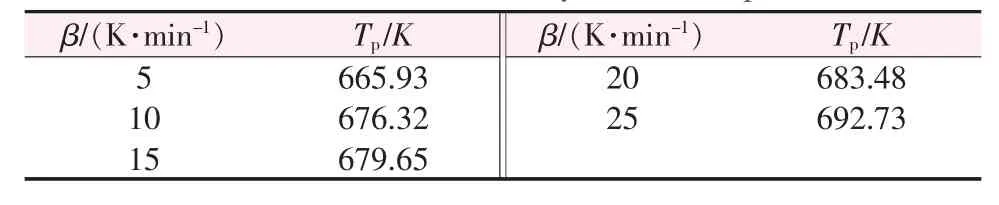
表2 前驱体不同升温速率对应热分解温度Table 2 Thermal decomposition kinetic parameters at different conversion rates by Ozawa′s equation
ln(β/Tp1.8)对1/Tp作图的拟合直线如图8所示,由直线斜率k=-E/R可以计算得到热分解反应活化能E。根据Starink方法计算得到的活化能为219.89 kJ/mol。
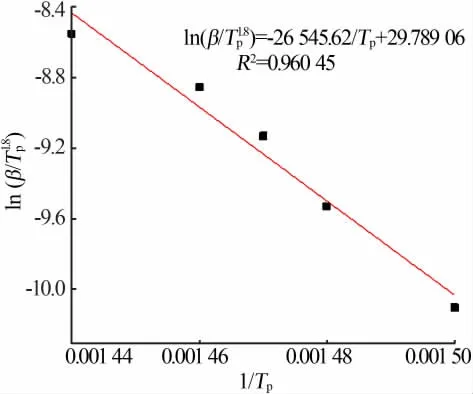
图8 Starink方程法计算直线拟合Fig.8 Calculation of straight line fitting by Starink equation
根据Ozawa方程法、Kissinger-Akahira-Sunose方程法及Starink方程法3种等转化率法计算得到的反应活化能分别为219.68、222.04、219.89 kJ/mol,计算平均值为220.54 kJ/mol。
2.3 前驱体焙烧实验
2.3.1 焙烧温度对制备纳米氧化铁的影响
在焙烧时间为2 h条件下,研究焙烧温度对制备纳米氧化铁的影响。不同温度下焙烧前驱体的XRD谱图分析见图9。由图9可见,前驱体的焙烧在373、473、573 K下并不完全,前驱体并没有完全转化为氧化铁;由前驱体的差热分析可以知道,在673 K左右为前驱体分解的第二阶段草酸亚铁的热分解阶段,综合考虑400℃为最佳的焙烧温度。
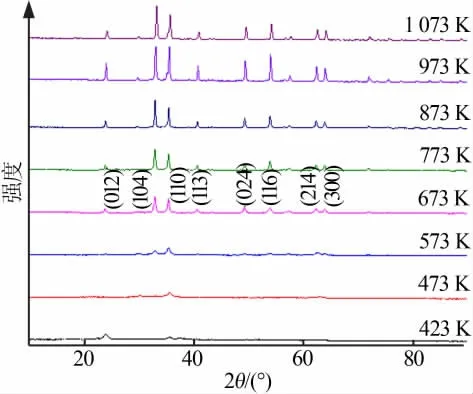
图9 不同温度下焙烧前驱体的XRD谱图Fig.9 XRD patterns of the calcined precursor at different temperature
引 入 谢 乐(Scherrer)公 式[28](式9)计 算400~1 073 K的纳米氧化铁的晶粒尺寸。

式中:K为常数;λ为X射线波长;β为衍射峰半高宽;θ为衍射角。在上式中常数K的取值与β的定义有关,当β为半宽高时,K取0.89;当β为积分宽度时,K取1.0。在晶粒尺寸小于100 nm时,应力引起的宽化与晶粒尺度引起的宽化相比可以忽略。由于二水合草酸亚铁焙烧制备纳米氧化铁的过程受焙烧温度的影响较大(图10所示),平均粒径由673 K的22.7 nm增长到1 073 K的60.1 nm,增长37.4 nm。由此可知,草酸亚铁二水合物作前驱体可以通过控制焙烧温度得到粒径较小的纳米氧化铁颗粒,但由于其对温度较为敏感,因此粒径分布可能不均匀。
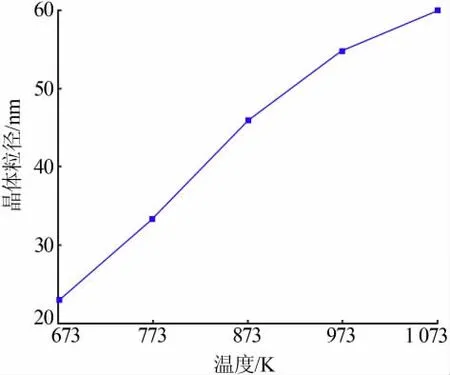
图10 不同温度下焙烧前驱体的粒径分布图Fig.10 Particle size distribution of the calcined precursor at different temperature
2.3.2 焙烧时间对制备纳米氧化铁的影响
在焙烧温度为400℃条件下,研究焙烧时间对制备纳米氧化铁的影响,焙烧时间的XRD图谱分析见图11,焙烧时间对粒径的影响见图12。对1~8 h的晶粒尺寸用谢乐公式进行计算。由图11和图12可知,随着焙烧时间的推移,纳米氧化铁的平均粒径从1 h的16.8 nm增长到了8 h的52.4 nm。由此可知,草酸亚铁二水合物作前驱体可以通过控制焙烧温度得到粒径较小的纳米氧化铁颗粒,但由于其对时间较对温度更加敏感,因此粒径分布有出现更不均匀现象概率。

图11 不同焙烧时间下前驱体的XRD图谱Fig.11 XRD patterns of the precursor at different roasting time

图12 不同焙烧时间下前驱体的粒径分布图Fig.12 Particle size distribution of the precursor at different roasting time
2.3.3 生长动力学
唯象理论[29]是对实验现象概括的总结与凝练,在马弗炉中焙烧前驱体草酸亚铁二水合物制备纳米氧化铁的晶粒生长动力学满足下面的唯象方程:

式中:D为平均晶粒大小;D0为起始晶粒大小;n为晶粒生长动力学指数;t为时间;K0为常数;Q为晶粒生长激活能;R为摩尔气体常数;T为绝对温度。
由于在焙烧过程中平均晶粒大小远大于起始晶粒大小,所以上式可简化为:

等式两边分别对t求导得:

对上式两边同时取对数得:
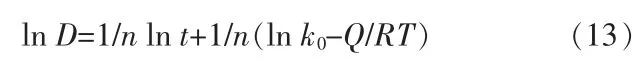
变形可得:
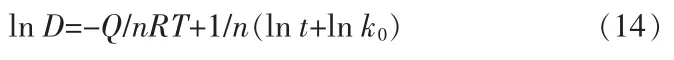
由上示可知,在相同温度条件下,作lnD-lnt线性拟合直线图见图13a,通过计算其斜率能够得出晶粒生长动力学指数n=2.6,在相同时间条件下,作lnD-1/T线性拟合直线图见图13b,通过计算其斜率能够得出晶粒生长激活能Q=39.06 kJ/mol。
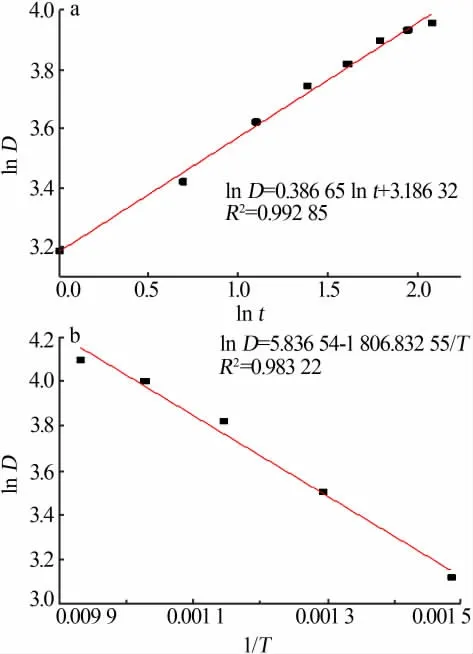
图13 ln D-ln t直线拟合(a);ln D-1/T直线拟合(b)Fig.13 ln D-ln t line fit(a)and ln D-1/T line fit(b)
2.3.4 纳米氧化铁表征
前驱体草酸亚铁二水合物在673 K下焙烧1 h后得到纳米氧化铁。表3为制得的纳米氧化铁主要性质;图14为纳米氧化铁在不同扫描电镜倍数下的显微形貌。由图14可以看出,焙烧后的纳米氧化铁颗粒呈现不规则的立方晶体结构,对其进行XRF检测得到氧化铁含量为99.67%(质量分数,下同),利用XRD分析软件Jade计算得到平均粒径为37.1 nm。

表3 前驱体焙烧制备纳米氧化铁的主要性质Table 3 Main properties of nano iron oxide particles prepared by precursor roasting

图14 纳米氧化铁在不同倍数下的SEM照片Fig.14 SEMimagesofnano-ironoxideat different magnifications
3 结论
采用氯化胆碱-二水合草酸低共熔溶剂对含铁粉尘进行处理得到前驱体,焙烧后制备纳米氧化铁,并对实验过程中前驱体热分解动力学和纳米氧化铁晶粒生长动力学进行分析,考察焙烧温度与时间对前驱体制备纳米氧化铁平均粒径的影响。
前驱体产物为FeC2O4·2H2O,热分解第一阶段脱去结晶水,第二阶段草酸亚铁热分解生成Fe2O3。利用等转化率法对热分解第二阶段进行计算,反应活化能平均值为220.54 kJ/mol,补充和完善了草酸亚铁前驱体热分析和动力学相关参数,对制备不同形貌与粒径的纳米氧化铁具有一定的参考价值。
根据唯象方程计算纳米氧化铁晶粒生长激活能Q=39.06 kJ/mol。通过对焙烧温度与焙烧时间对粒径的影响总结规律,实现纳米氧化铁不同粒径的可控合成。最佳焙烧条件(673 K,1 h)制备的纳米氧化铁,颗粒呈不规则立方晶体结构,进行XRF检测得到氧化铁含量为99.67%,利用Jade软件计算平均粒径为37.1 nm。

