新型2,5-取代-1,3,4-噻二唑衍生物的合成与杀菌活性
王 威, 黄晓瑛, 王列平, 郑晓蕊, 刘康云, 王储备, 屈应莲
(1. 西安近代化学研究所 氟氮化工资源高效开发与利用国家重点实验室,陕西 西安 710065;2. 新乡学院 能源与燃料研究所,河南 新乡 453000)
由于1,3,4-噻二唑及其衍生物具有杀菌、杀虫、抗病毒、除草和植物生长调节等多种生物活性,该类型化合物的合成及生物活性研究一直都是杂环类农药创制领域关注的热点之一[1-4]。许多噻二唑杂环化合物已被开发为商品化农药,如除草剂氟噻草胺、丁噻咪草酮、噻黄隆和杀菌剂噻枯唑[1]。
2,5-取代-1,3,4-噻二唑衍生物作为1,3,4-噻二唑杂环结构中的重要结构类型,其母体结构1,3,4-噻二唑的2-位和5-位可进行取代修饰,通过引入不同的药效团进行结构的衍生化设计[3-5]。此外,氧杂环苯并二噁茂作为天然产物石蒜碱分子结构的关键药效团,具有杀螨[6]、杀虫[7]、抗真菌[8]、杀菌[9]、抗增殖[10]、抗艾滋病毒[11]等生物活性,常作为先导结构被用于合成衍生化合物。部分化合物已实现商品化,如西诺沙星(Cinoxacin)[12]和吡贝地尔(Piribedil)[13]。
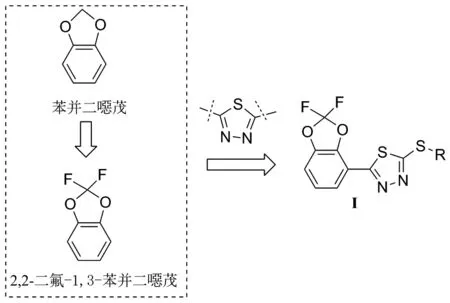
Chart 1

Scheme 1
在以苯并二噁茂为基础的衍生化研究中,研究人员利用氟原子自身的独特物化性质,及其可改善有机分子母核生物活性的特点,通过在氧杂环苯并二噁茂的母核结构的2-位引入氟原子,4-位引入吡咯环,成功开发出了高效杀菌剂咯菌睛(Fludioxonil)[14]。
本文的研究兴趣在于,将天然产物或药物分子中的关键药效团引入到1,3,4-噻二唑分子结构的2-位或5-位,有望获得具有杀菌活性的1,3,4-噻二唑衍生物。根据活性亚结构拼接原理,将2,2-二氟-1,3-苯并二噁茂与1,3,4-噻二唑杂环相拼接(Chart 1),设计并合成了9个新型的1,3,4-噻二唑衍生物(I-1~I-9, Scheme 1),其结构经1H NMR,13C NMR,19F NMR, MS(EI)和元素分析表征,并对化合物的杀菌活性进行了初步测试。
1 实验部分
1.1 仪器与试剂
Varian Mercury 500 MHz型超导核磁共振仪(CDCl3或DMSO-d6为溶剂,TMS为内标); Finnigan Trace MS型质谱仪;Vario EL III型元素分析仪。
中间体1~3按文献[15-20]方法合成;其余所用试剂均为分析纯或化学纯。
1.2 合成
(1) 2-巯基-5-(2,2-二氟-1,3-苯并二噁茂-4-基)-1,3,4-噻二唑(I-1)的合成[21]
向装有冷凝管的50 mL圆底烧瓶中,加入中间体3(5 mmol),乙醇(10 mL), KOH(6.0 mmol)的(3 mL)溶液,搅拌使其混合均匀;分批加入CS2(8.0 mmol),加毕,加热至回流,反应4~6 h。蒸除过量CS2和乙醇,加入水(30 mL),滤去不溶物,滤液滴加浓硫酸至pH 2~3,析出大量淡黄色固体I-1,收率85%, m.p.94~96 ℃;1H NMR(500 MHz, DMSO-d6)δ: 7.41(s, 1H), 7.65~7.69(t, 2H), 14.88(s, 1H, -SH);13C NMR(125 MHz, DMSO-d6)δ: 107.09, 113.92, 122.31, 125.81, 131.75(t,1JC-F=253.63 Hz), 140.33, 144.16, 156.45, 177.83;19F NMR(470 MHz, DMSO-d6)δ: -48.61; MS(EI)m/z: 273.97[M+]; Anal. Calcd for C9H4N2O2S2F2: C 39.41, H 1.47, N 10.21, found C 39.17, H 1.28, N 10.01。
(2) 2-取代-5-(2,2-二氟-1,3-苯并二噁茂-4-基)-1,3,4-噻二唑(I-2~I-9) 的合成通法[22]
在100 mL三颈瓶中加入目标化合物I-1(6.6 mmol), K2CO3(6.6 mmol),DMSO(25 mL),搅拌下加入氯(溴)代物(6.6 mmol),加毕,反应至原料点消失。将反应体系倾入水(100 mL)中,析出白色固体,抽滤,滤饼真空干燥得目标产物I-2~I-9,用乙醇或乙醇和水的混合溶剂重结晶得纯品。目标化合物I-2~I-9的结构表征数据如下:
I-2: 白色固体,收率84%, m.p.100~102 ℃;1H NMR(500 MHz, CDCl3)δ: 2.35(s, 1H, CH), 4.09(d, 2H, -CH2-), 7.21~7.26(m, 2H), 7.73~7.75(m, 1H);13C NMR(125 MHz, CDCl3)δ: 21.33, 73.24, 107.17, 112.43, 121.99, 124.27, 131.71(t,1JC-F=256.75 Hz), 141.08, 144.58, 161.75, 163.72;19F NMR(470 MHz, CDCl3)δ: -49.41; MS(EI)m/z: 311.98[M+]; Anal. Calcd for C12H6N2O2S2F2: C 46.15, H 1.94, N 8.97, found C 46.03, H 2.10, N 8.62。
I-3: 白色固体,收率86%, m.p.118~120 ℃;1H NMR(500 MHz, CDCl3)δ: 1.31(t, 3H, -CH2CH3), 4.14(s, 2H, -CH2-), 4.26(q, 2H, -CH2CH3), 7.21~7.25(m, 2H), 7.69~7.73(m, 1H);13C NMR(125 MHz, CDCl3)δ: 14.06, 34.43, 62.50, 107.14, 112.36, 121.89, 124.26, 131.68(t,1JC-F=256.75 Hz), 140.98, 144.52, 161.54, 164.01, 167.27;19F NMR(470 MHz, CDCl3)δ: -49.47; MS(EI)m/z: 360.01[M+]; Anal. Calcd for C13H10N2O4S2F2: C 43.33, H 2.80, N 7.77, found C 43.08, H 2.43, N 7.44。
I-4: 白色固体,收率81%, m.p.117~119 ℃;1H NMR(500 MHz, CDCl3)δ: 4.51(s, 2H, -CH2-), 7.20~7.32(s, 3H), 7.67(t, 1H), 7.88(d, 1H), 8.53(s, 1H);13C NMR(125 MHz, CDCl3)δ: 32.96, 107.02, 112.47, 121.84, 124.34, 124.40, 124.43, 131.09, 131.66(t,1JC-F=256.75 Hz), 139.72, 140.93, 144.49, 144.52, 150.04, 151.07, 161.63, 163.92;19F NMR(470 MHz, CDCl3)δ: -49.36; MS(EI)m/z: 398.97[M+]; Anal. Calcd for C15H8N3O2S2F2Cl: C 45.06, H 2.02, N 10.51, found C 45.23, H 1.78, N 10.34。
I-5: 白色固体,收率79%,m.p.132~134 ℃;1H NMR(500 MHz, CDCl3)δ: 4.71(s, 2H, -CH2-), 7.25(s, 2H), 7.61(s, 1H), 7.71(s, 1H);13C NMR(125 MHz, CDCl3)δ: 28.80, 106.99, 112.55, 121.89, 124.38, 131.67(t,1JC-F=256.88 Hz), 135.65, 140.98, 141.38, 144.52, 152.56, 161.87, 163.86;19F NMR(470 MHz, CDCl3)δ: -49.32; MS(EI)m/z: 404.93[M+]; Anal. Calcd for C13H6N3O2S3F2Cl: C 38.47, H 1.49, N 10.35, found C 38.19, H 1.68, N 10.52。
I-6: 白色固体,收率81%, m.p.111~113 ℃;1H NMR(500 MHz, DMSO-d6)δ: 4.61(s, 2H, -CH2-), 7.29(s, 1H), 7.35(t, 2H), 7.41(t, 1H), 7.50(d, 2H), 7.66(d, 1H), 7.74(d, 1H);13C NMR(125 MHz, DMSO-d6)δ: 36.53, 107.41, 113.75, 122.71, 125.80, 128.29, 129.05, 129.51, 131.73(t,1JC-F=253.50 Hz), 136.94, 140.36, 144.18, 161.18, 164.63;19F NMR(470 MHz, DMSO-d6)δ: -48.66; MS(EI)m/z: 364.02[M+]; Anal. Calcd for C16H10N2O2S2F2: C 52.74, H 2.77, N 7.69, found C 52.67, H 2.87, N 7.28。
I-7: 白色固体,收率78%, m.p.112~114 ℃;1H NMR(500 MHz, DMSO-d6)δ: 4.68(s, 2H, -CH2-), 7.35(m, 2H), 7.42(t, 1H), 7.52(d, 1H), 7.65(t, 2H), 7.73(d, 1H);13C NMR(125 MHz, DMSO-d6)δ: 34.89, 107.39, 113.82, 122.74, 125.81, 127.94, 130.10, 130.49, 131.73(t,1JC-F=253.38 Hz), 132.04, 133.83, 134.23, 140.40, 144.18, 161.43, 164.10;19F NMR(470 MHz, DMSO-d6)δ: -48.66; MS(EI)m/z: 397.98[M+]; Anal. Calcd for C16H9N2O2S2F2Cl: C 48.19, H 2.27, N 7.02, found C 48.41, H 2.38, N 7.14。
I-8: 白色固体,收率78%, m.p.114~116 ℃;1H NMR(500 MHz, CDCl3)δ: 1.27(t, 3H, -CH2CH3), 2.20~2.23(m, 2H, -CH2CH2CH2CO-), 2.52(t, 2H, -CH2CH2CH2CO-), 3.39(t, 2H, -CH2CH2CH2CO-), 4.13~4.18(q, 2H, -CH2CH3), 7.23(d, 2H), 7.72(s, 1H);13C NMR(125 MHz, CDCl3)δ: 14.21, 24.60, 32.67, 60.65, 107.35, 112.22, 121.89, 124.23, 131.69(t,1JC-F=256.50 Hz), 140.95, 144.52, 172.45;19F NMR(470 MHz, CDCl3)δ: -49.48; MS(EI)m/z: 388.04[M+]; Anal. Calcd for C15H14N2O4S2F2: C 46.39, H 3.63, N 7.21, found C 46.31, H 3.46, N 7.17。
I-9: 白色固体,收率83%,m.p.132~134 ℃;1H NMR(500 MHz, DMSO-d6)δ: 4.76(s, 2H, -SCH2-), 5.89(s, 2H, -CH2-),7.16~7.18(m, 1H), 7.41~7.48(m, 1H), 7.64~7.75(m, 2H), 8.33(s, 1H);13C NMR(125 MHz, DMSO-d6)δ: 24.42, 45.54, 107.34, 113.78, 122.70, 125.79, 131.71(t,1JC-F=252.88 Hz), 135.77, 140.38, 141.97, 143.95, 144.17, 151.92, 161.24, 164.33;19F NMR(470 MHz, DMSO-d6)δ: -48.70; MS(EI)m/z: 485.96[M+]; Anal. Calcd for C16H9N6O2S3F2Cl: C 39.47, H 1.86, N 17.26, found C 39.29, H 1.66, N 17.10。
1.3 杀菌活性测试
以苹果树腐烂病菌(Valsamali)、小麦赤霉病菌(Fusariumgraminearum)、西瓜枯萎病菌(Fusariumoxysporum)、棉花枯萎病菌(Fusariumoxysporumf.sp.vasinfectum)和番茄灰霉病菌(Botrytiscinerea)等5种农业病菌作供试菌种,95%嘧菌酯(Azoxystrobin)原药作对照药,采用菌丝生长速率法测试了化合物的杀菌活性。
将1.0 mL不同质量浓度的供试药液与9.0 mLPDA培养基混匀,倒入无菌培养皿中制成带药培养基平板。待培养基凝固后,在每个培养基平面接入一个供试真菌菌饼(直径为4 mm),使带菌丝的一面贴在培养基表面。以清水作为对照。每处理设3次重复。在每个带药培养基平面接入一个供试真菌菌饼后,于25 ℃恒温箱中培养72~96 h,用十字交叉法测量菌落生长直径,并计算菌丝生长抑制率。
2 结果与讨论
2.1 表征
由目标化合物的13C NMR谱图(图略)可知,sp3杂化的碳原子的特征峰均位于δ74以下;羰基碳特征峰出现在δ167.27~172.45附近;碳原子受相邻氟原子的耦合裂分影响,符合n+1规律,在“O—CF2—O”结构片段中,与氟原子相接的碳原子在δ131.70附近裂分为三重峰,其耦合常数为(1JC-F)为253.38~256.88 Hz。
2.1 杀菌活性
表1为100 mg/L浓度下、目标化合物I-1~I-9对苹果树腐烂病菌、小麦赤霉病菌、西瓜枯萎病菌、棉花枯萎病菌和番茄灰霉病菌等5种农业病菌的杀菌活性实验结果。从表1可知,目标化合物对苹果树腐烂病菌和番茄灰霉病菌的抑制活性分别为40%~96%和44%~80%;其中化合物I-1、I-2、I-5和I-9对苹果树腐烂病菌的抑制活性为80%~96%。化合物I-1和I-9对番茄灰霉病菌具有80%的抑制活性;所有化合物对小麦赤霉病菌(0~27%)、西瓜枯萎病菌(10~50%)和棉花枯萎病菌(0~61%)的抑制活性较差。
由构效分析可知,目标化合物分子结构中1,3,4-噻二唑的5-位为2,2-二氟-1,3-苯并二噁茂,2-位硫醚基中R为氢原子、噻唑环、炔烃时,化合物对苹果树腐烂病菌的抑制活性最高,达到80%~96%;当R为噻唑与三氮唑串联基团或炔烃时,化合物对番茄灰霉病菌具有80%的抑制活性;当R为其它基团时,化合物的杀菌活性均较差。整体而言,目标化合物对大部分测试病菌的杀菌活性不如对照药剂嘧菌酯,且R的变化与杀菌活性强弱无明显规律性变化,这需要在后续工作中适当引入更多不同类型的基团,进一步研究其结构与杀菌活性的关系。

表1 化合物I的杀菌活性*
以苯并二噁茂为起始原料,设计并合成了9个结构新颖的2-取代-5-(2,2-二氟-1,3-苯并二噁茂-4-基)-1,3,4-噻二唑化合物,并对其杀菌活性进行了测试。结果表明,部分化合物在100 mg/L浓度下对苹果树腐烂病菌具有较高的抑制活性。其中,化合物I-1和I-5对苹果树腐烂病菌的抑制活为92%和96%。因此I-1和I-5具有作为防治苹果树腐烂病菌的活性先导化合物作进一步研究的价值。

