腺苷2B受体激动剂对大鼠高原肺水肿的治疗作用
罗芩 何庆
(1.西南交通大学医学院,四川 成都 610031; 2.西南交通大学附属医院 成都市第三人民医院,四川 成都 610031)
急性高原病是指人在进入海拔2 500 m以上的高原环境不能很快适应而发生的一系列不适症状,包括急性高山病、高原肺水肿(high-altitude pulmonary edema,HAPE)和高原脑水肿[1]。HAPE往往起病急,病情变化快,救治难度大,严重威胁人的生命健康,因此对HAPE立即进行有效治疗十分重要。
腺苷可刺激肺泡离子转运,调节肺泡内液体清除[2]。它有四种不同的G蛋白偶联腺苷受体(Ars),包括A1AR、A2AAR、A2BAR和A3AR,其中,A2BAR高表达于Ⅱ型肺泡上皮细胞[3]。BAY60-6583是A2BAR的选择性激动剂,对其亲和力远高于其他腺苷受体[4]。有研究证明BAY60-6583在内毒素诱导的大鼠急性肺损伤模型中能抑制肺水肿、减轻肺部炎症[5]。因此,本研究旨在探究BAY60-6583是否能对急性HAPE大鼠模型起到治疗作用。
1 材料
1.1 实验仪器与试剂
高原性疾病环境模拟舱(成都达硕),Epoch酶标检测仪(BioTeK),荧光定量聚合酶链反应(PCR)仪(Bio-rad),BAY60-6583(Master of Small Molecules),肿瘤坏死因子-α(TNF-α)试剂盒(优尔生),白介素(IL)-6试剂盒(优尔生),超氧化物歧化酶(SOD)试剂盒(南京建成),丙二醛(MDA)试剂盒(南京建成),环磷酸腺苷(cAMP)试剂盒(江莱),兔抗氨酰敏感Na+通道α亚基(epithelial sodium channel-α,ENaC-α)抗体(Stressmarq)。
1.2 实验动物
清洁级SD雄性大鼠(180~220 g)[购自成都达硕实验动物有限公司,动物合格证号:SCXK(川)2020030]。
2 方法
2.1 HAPE模型制备
将24只大鼠随机分为平原对照组(Control组)、HAPE模型组(HAPE组)和BAY60-6583干预组(BAY组),每组8只。将HAPE组和BAY组大鼠放入高原性疾病环境模拟舱内,以10 m/s的速度升至模拟海拔6 000 m,维持48 h;Control组大鼠常氧饲养48 h。出舱后BAY组腹腔注射BAY60-6583[2 mg/(kg·d)],Control组和HAPE组腹腔注射等体积溶媒,持续3 d。
2.2 肺含水量测定
各组动物用10%水合氯醛(0.3 mL/200 g)麻醉后,剖开胸腔,取出双侧肺叶,小心剔除肺外组织,分离左肺上叶,用电子天平称肺湿重后,置于80 ℃恒温干燥箱48 h烘干至恒重,称肺干重。计算肺含水量[肺含水量=(肺湿重-肺干重)/肺湿重]。其余的肺叶一部分用于病理观察,一部分-80 ℃冷冻保存备用。
2.3 肺组织病理观察
分离右肺上叶,用4%多聚甲醛固定,常规脱水、包埋,制成片厚约4 μm的HE染色切片,于光镜下观察肺组织病理学变化。
2.4 血清和肺组织中TNF-α和IL-6含量测定
在解剖大鼠前采集血液3~5 mL,室温自然凝固后离心10 min(3 500 r/min),收集血清。将冻存的右肺下叶室温冰浴下解冻后称取适量肺组织,制成10%匀浆液,低温离心机3 500 r/min离心15 min,收集上清液。按所选TNF-α和IL-6试剂盒说明书测定血清和肺组织中TNF-α和IL-6的含量。
2.5 肺组织和心脏组织中SOD活性和MDA含量测定
将肺组织和心脏组织分别制成组织匀浆,收集上清液。按照所选SOD和MDA试剂盒说明书测定肺组织和心脏组织中SOD活性和MDA含量。
2.6 肺组织中cAMP水平测定
将肺组织和制成组织匀浆,收集上清液。按所选cAMP试剂盒说明书测定肺组织中cAMP水平。
2.7 反转录聚合酶链反应检测ENaC-α基因相对表达量
将冻存的肺组织制成组织匀浆,用RNA提取液提取肺组织中的总RNA,纯化后定量RNA浓度。用表1所示的引物进行扩增,荧光定量PCR仪检测ENaC-α和甘油醛-3-磷酸脱氢酶(GAPDH)mRNA,用GAPDH mRNA表达情况归一化数据,并以相对于对照组的倍数变化情况来表示ENaC-α的mRNA相对表达量。

表1 ENaC-α和GAPDH的引物序列
2.8 蛋白质印迹法检测ENaC-α蛋白相对含量
将冻存的肺组织制成组织匀浆,提取蛋白质,并用二喹啉甲酸蛋白定量试剂盒检测蛋白浓度。电泳后进行转膜,然后用5%脱脂奶粉封闭30 min,将封闭好的聚偏二氟乙烯膜与兔抗ENaC-α多克隆抗体(1∶1 000稀释)孵育,4 ℃下过夜;然后与辣根过氧化物酶偶联的山羊抗兔二抗(1∶3 000稀释)在室温下反应30 min。用底物化学发光法检测标记的条带,并通过凝胶成像系统进行可视化,用Alpha软件处理系统分析目标带的光密度值。
2.9 统计学方法
3 结果
3.1 各组大鼠肺含水量
如表2所示。与Control组相比,HAPE组大鼠肺含水量明显增多(P=0.012);与HAPE组相比,BAY组大鼠的肺含水量明显降低(P=0.006);差异均有统计学意义。

表2 肺含水量
3.2 肺组织HE染色
如图1所示,Control组(图1A)大鼠肺泡腔内无分泌物,肺泡壁完整,壁薄,无充血、水肿、炎性细胞浸润及红细胞渗出。HAPE组(图1B)大鼠肺泡腔内可见渗出物及大量炎症细胞、红细胞渗出,部分肺间隔增厚;支气管上皮杂乱,支气管腔狭窄、变形,大量炎性细胞聚集。与HAPE组相比,BAY组(图1C)肺组织炎性细胞浸润渗出明显减轻,肺泡腔内未见明显水肿、渗出、出血,肺泡结构完整;支气管结构较完整,有少许炎性细胞浸润。
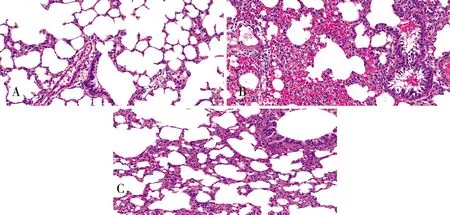
图1 肺组织HE染色(400倍)注:A:Control组;B:HAPE组;C:BAY组。
3.3 炎症因子TNF-α和IL-6水平
如图2和图3所示,与Control组相比,HAPE组大鼠血清中TNF-α(P=0.004)及IL-6(P=0.02)水平升高,肺组织中TNF-α(P=0.012)及IL-6(P=0.032)水平升高;与HAPE组相比,BAY组大鼠血清中TNF-α(P=0.022)及IL-6(P=0.024)水平显著降低,肺组织中TNF-α(P=0.012)及IL-6(P=0.048)水平显著降低;差异均有统计学意义。
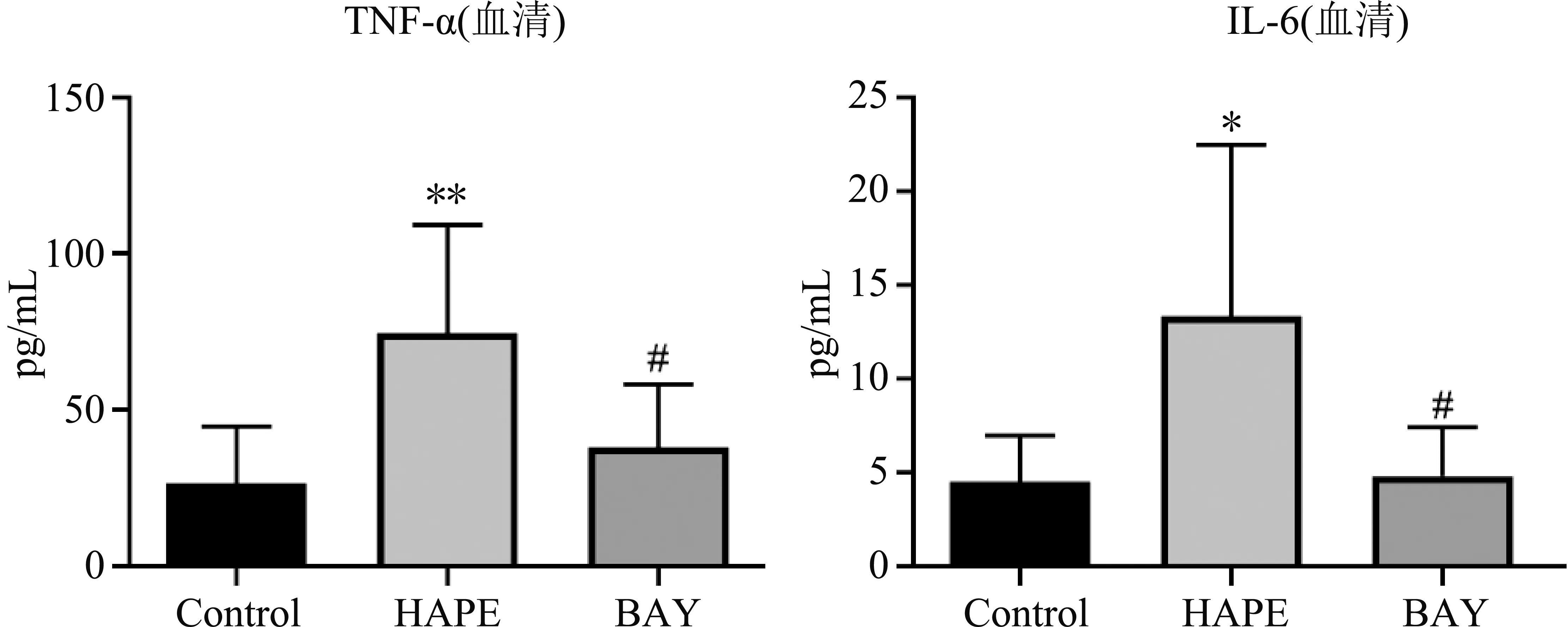
图2 血清中TNF-α及IL-6水平检测结果注:与Control组相比,*表示P<0.05,**表示P<0.01;与HAPE组相比,#表示P<0.05。
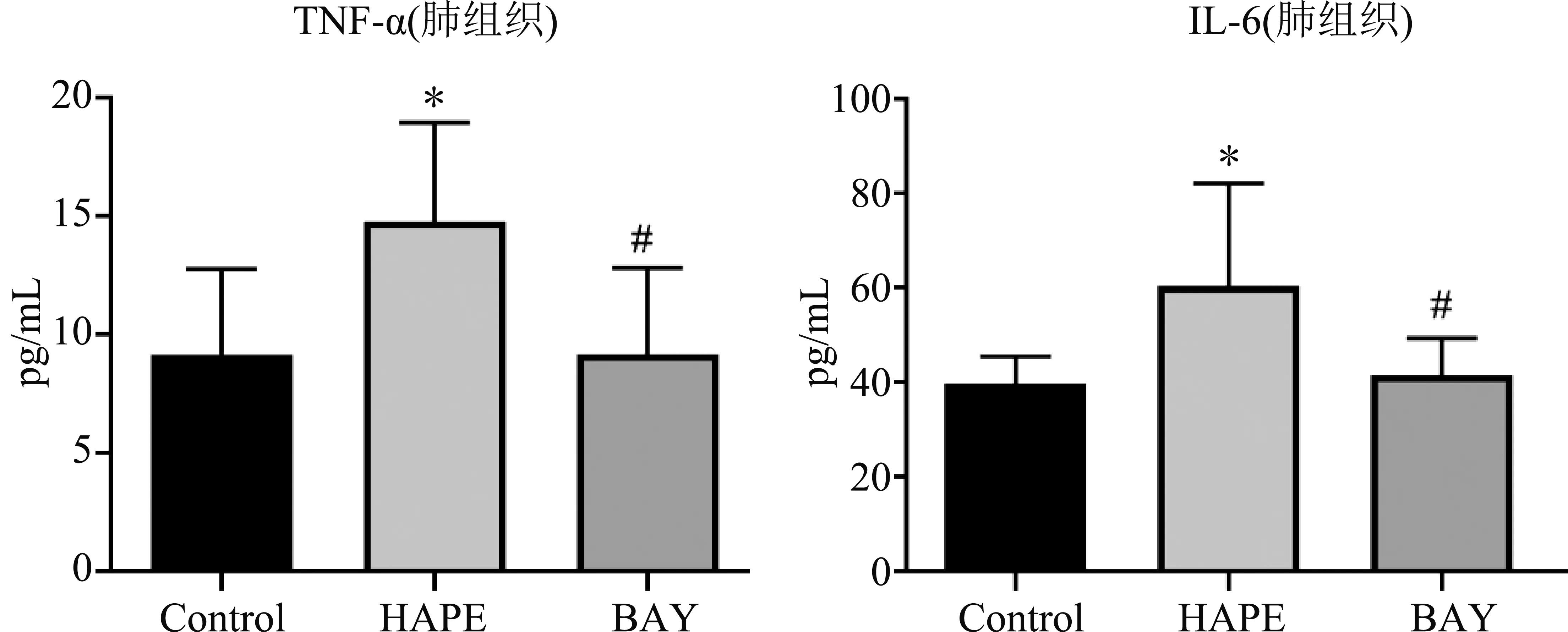
图3 肺组织中TNF-α及IL-6水平检测结果注:与Control组相比,*表示P<0.05;与HAPE组相比,#表示P<0.05。
3.4 氧化应激指标SOD活性和MDA含量
如图4和图5所示,与Control组相比,HAPE组大鼠肺组织中SOD活性降低(P=0.012),MDA含量升高(P=0.002),心脏组织中SOD活性降低(P=0.026),MDA含量升高(P=0.025);与HAPE组相比,BAY组大鼠肺组织中SOD活性升高(P=0.002),MDA含量降低(P=0.032),心脏组织中SOD活性升高(P=0.016),MDA含量降低(P=0.011);差异均有统计学意义。
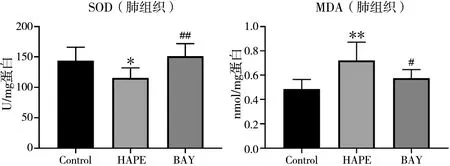
图4 肺组织中SOD活性及MDA含量检测结果注:与Control组相比,*表示P<0.05,**表示P<0.01;与HAPE组相比,#表示P<0.05,##表示P<0.01。

图5 心脏组织中SOD活力及MDA含量检测结果注:与Control组相比,*表示P<0.05;与HAPE组相比,#表示P<0.05。
3.5 肺组织中cAMP水平
如图6所示,与Control组相比,HAPE组大鼠肺组织中cAMP水平较低,但差异没有统计学意义(P=0.264);与HAPE组相比,BAY组大鼠肺组织中cAMP水平显著升高,差异有统计学意义(P=0.026)。
3.6 肺组织中ENaC-α mRNA相对表达量
如图7所示,与Control组相比,HAPE组大鼠肺组织ENaC-α mRNA相对表达量降低(P=0.042);与HAPE组相比,BAY组大鼠肺组织ENaC-α mRNA相对表达量升高(P=0.033);差异均有统计学意义。

图7 肺组织中ENaC-α基因相对表达量注:与Control组相比,*表示P<0.05;与HAPE组相比,#表示P<0.05。
3.7 肺组织中ENaC-α蛋白表达量
如图8所示,与Control组相比,HAPE组大鼠肺组织ENaC-α的蛋白含量降低(P=0.045);与HAPE组相比,BAY组大鼠肺组织ENaC-α蛋白含量升高(P=0.032);差异均有统计学意义。

图8 肺组织中ENaC-α蛋白含量注:与Control组相比,*表示P<0.05;与HAPE组相比,#表示P<0.05。
4 讨论
本研究首次证明了A2BAR激动剂BAY60-6583能减轻HAPE大鼠模型的炎症反应和氧化应激情况,能增加肺组织中的ENaC-α含量从而增加肺泡液的清除,减轻肺水肿。
有研究发现HAPE患者体内炎症相关转录mRNA增多,这些mRNA通过调节缝隙连接的表达和内皮的激活,形成了内皮通透性和液体渗漏的正前馈环;研究还发现HAPE患者体内TNF-α和IL-6含量增加,增加了肺血气屏障的通透性[6]。虽然炎症并不是HAPE形成的原因,但由缺氧诱导的肺血管内皮细胞破裂、内源性损伤物质和活性氧的释放均可触发炎症反应,而炎症反应又会反过来加重HAPE的肺损伤。而A2BAR在急性肺损伤中具有抗炎作用,可减弱肺中性粒细胞的聚集和肺内细胞因子水平,维持内皮屏障,从而减少白蛋白渗漏,提高生存率[7-9]。在本研究中,HAPE组大鼠血清和肺组织中炎症因子(TNF-α和IL-6)含量均明显高于Control组,而BAY组大鼠血清和肺组织中炎症因子水平明显低于HAPE组,说明BAY60-6583可减轻HAPE大鼠的炎症反应。
HAPE的发生与高原急性缺氧所致的氧化应激作用有着密切的关系。高原缺氧能使机体产生过量的氧自由基,使脂质过氧化作用明显增强,导致细胞的结构和功能紊乱。SOD活性和MDA含量均可反映机体的氧化应激程度,SOD活性越低、MDA含量越高,说明机体受到氧自由基攻击越多,氧化应激程度越高。肺脏作为直接感知氧浓度变化的器官,对氧化应激较为敏感[10]。在本研究中,与Control组相比,HAPE组大鼠肺组织和心脏组织中SOD活性明显降低,MDA含量明显升高;而与HAPE组相比,BAY组大鼠心肺组织的SOD活性明显升高,MDA含量明显降低。说明BAY60-6583能通过刺激A2BAR来减轻HAPE大鼠的氧化应激。
肺泡液清除是肺泡上皮,特别是Ⅱ型肺泡上皮的主要功能。在Ⅱ型肺泡上皮细胞上有许多通道参与肺泡液清除,包括顶端的ENaC、基底侧的Na+-K+-ATP酶和水通道蛋白等[11-12]。经ENaC的Na+转运是Ⅱ型肺泡上皮Na+和液体运输的主要驱动和限速步骤[12-15]。肺ENaC可受到多种因子的调节,许多药物均能刺激cAMP产生进而通过蛋白激酶A途径和交换被cAMP信号直接激活的蛋白来增强肺泡液清除[16-17]。A2BAR能与Gs蛋白相互作用激活触发腺苷酸环化酶使cAMP升高[18]。由于A2BAR在肺泡上皮细胞高表达,而cAMP是Na+通过肺泡上皮转运的关键调节因子,本研究假设肺泡上皮A2BAR有助于肺泡液平衡,从而可治疗HAPE。
ENaC由三个亚基构成,分别为α、β、γ亚基,在Ⅱ型肺泡上皮中,表达量最多且承担最多离子转运功能的是ENaC-α,远高于其他两个亚基。本研究使用了A2BAR激动剂BAY60-6583来研究其通过cAMP对ENaC-α和肺含水量的影响,进而研究其对HAPE大鼠肺水肿的清除能力。实验结果显示,与Control组相比,HAPE组大鼠肺组织中cAMP含量降低,ENaC-α的mRNA相对表达量和蛋白含量均明显降低,肺含水量明显升高;而与HAPE组相比,BAY组大鼠肺组织中cAMP含量明显升高,ENaC-α的mRNA相对表达量和蛋白含量均明显升高,肺含水量明显降低。这一实验结果说明BAY60-6583能通过激活A2BAR来增加cAMP的含量,进而增加ENaC-α的mRNA和蛋白含量,从而减少肺组织含水量,清除肺水肿,对HAPE大鼠起到治疗作用。
除肺泡上皮外,其他细胞上的A2BAR对缺氧也有保护作用。在高原环境下,红细胞上的A2BAR被激活,诱导产生2,3-双磷酸甘油酸并触发释放O2,以防止组织缺氧和肺血管渗漏[19]。另一研究表明,CD73依赖的血浆腺苷信号升高可通过A2BAR来调节红细胞的平衡核苷转运体,增强缺氧反应以更快地适应海拔升高[20]。这说明A2BAR除了可治疗高原低压低氧引起的肺水肿外,还能通过其他的机制加快机体的高原适应,在预防高原性疾病(如急性高山病、HAPE和高原脑水肿)方面可能也有很大的潜力。
综上所述,本研究提示BAY60-6583可通过激活A2BAR减少HAPE的炎症反应和氧化应激,增加肺组织内cAMP含量进而上调肺组织中ENaC-α的表达,促进肺泡液的清除,从而治疗HAPE。但除了能治疗HAPE外,A2BAR还能增强缺氧反应以使机体更快适应升高的海拔,或可能预防高原性疾病。鉴于目前能预防和治疗高原性疾病的药物并不多,A2BAR在这两方面的潜在价值值得深入研究。