宫腔粘连子宫内膜组织中E-cadherin、MMP-9及PDGF-AA的表达水平及临床意义*
伍雯莹,丁丽君,谢 环
1.湖北省黄石市妇幼保健院妇女保健科,湖北黄石 435000;2.湖北省黄石市妇幼保健院产科,湖北黄石 435000;3.湖北省宜昌市第二人民医院/三峡大学第二人民医院妇产科,湖北宜昌 443000
近年来随着人工流产、刮宫等宫腔操作增加,宫腔粘连发生率呈增高趋势。宫腔粘连的形成可导致月经紊乱和继发不孕,即使宫腔镜宫腔粘连切除手术水平不断提高,但是术后仍有较高的复发风险,妊娠率仍较低[1]。目前宫腔粘连发病机制尚不十分明确,现有研究认为上皮-间质转化(EMT)在宫腔粘连发病机制中占有重要地位[2]。E-钙黏蛋白(E-cadherin)是细胞黏附连接的关键成分,在细胞黏附和维持上皮细胞表型中起着重要作用[3]。基质金属蛋白酶9(MMP-9)是基质金属蛋白酶家族成员,通过分解基底膜纤维连接蛋白、粘连蛋白降解细胞外基质,参与EMT过程[4]。血小板源性生长因子-AA(PDGF-AA)是促进成纤维细胞分裂、趋化的细胞因子,在细胞外基质合成、降解中均扮演关键角色[5]。目前E-cadherin、MMP-9、PDGF-AA在宫腔粘连中均有报道,但较少关注E-cadherin、MMP-9、PDGF-AA与宫腔粘连患者疗效和预后的关系。鉴于此,本研究通过监测宫腔粘连患者子宫内膜组织中E-cadherin、MMP-9、PDGF-AA的表达,追踪临床疗效和妊娠结局,探讨E-cadherin、MMP-9、PDGF-AA与宫腔粘连患者临床特征、疗效和预后的关系。
1 资料与方法
1.1一般资料 选择2015年6月至2018年7月湖北省黄石市妇幼保健院妇女保健科收治的86例宫腔粘连患者作为宫腔粘连组。纳入标准:(1)典型月经异常、周期性腹痛,经宫腔镜诊断为宫腔粘连;(2)行宫腔镜手术治疗,术中取组织病理检查,结果完整;(3)有妊娠需求。排除标准:(1)子宫先天畸形;(2)合并生殖器官恶性肿瘤、子宫内膜异位症;(3)病理标本不合格、配偶不育、随访失联者。宫腔粘连组患者年龄27~39岁,平均(34.21±3.26)岁;病因:有刮宫史35例,有子宫内膜息肉切除史22例,子宫内膜感染16例,雌激素水平降低10例;类型:混合型49例、周边型37例;Nasr宫腔粘连分级[6]:从峡部粘连(“是”计2分,“否”计0分)、膜状粘连(“少”计1分,“广泛”计2分)、致密粘连(“单发”计2分,“多发”计4分)、输卵管开口(“可见”计0分,“单侧可见”计2分,“均不可见”计4分)、管状宫腔(“是”计10分,“否”计0分)、月经类型(“正常”计0分,“少”计4分,“闭经”计8分)、孕产史(“无不良孕产史”计0分,“复发性流产”计2分,“不孕”计4分)等方面进行评分,轻度(0~4分)41例,中度(5~10分)25例,重度(11~22分)20例;粘连性质:膜性29例,纤维性37例,肌性20例;内膜分期:增殖期39例,分泌期47例;子宫发育:正常62例,异常24例,闭经30例。另选择同期收治的51例输卵管性不孕患者为对照组,均经宫腔镜排除宫腔粘连,年龄26~41岁,平均(35.02±3.53)岁;内膜分期:增殖期26例,分泌期25例。两组基线资料比较差异无统计学意义(P>0.05),具有可比性。本研究已经获得湖北省黄石市妇幼保健院伦理委员会批准。
1.2方法
1.2.1宫腔粘连的临床治疗 宫腔粘连组所有患者均行宫腔镜宫腔粘连分离术,取膀胱截石位,硬腰联合麻醉,扩阴器扩开阴道,扩宫棒扩张宫颈,置入宫腔镜,了解子宫、附件粘连情况,针状电极分离粘连组织,直至宫腔恢复正常大小和形态,双侧输卵管开口可见为止,术中应轻柔操作,减少宫腔内膜损伤。术中酌情配合腹腔镜监视,根据粘连部位不同放置“T”或“O”形宫内节育器预防粘连。术后使用抗生素预防感染,雌激素和孕激素人工周期综合治疗,2~3个月后复查宫腔镜,恢复正常后取出宫内节育器。
1.2.2免疫组织化学方法检测E-cadherin、MMP-9、PDGF-AA表达 取86例宫腔粘连患者手术切除的子宫内膜组织和51例输卵管性不孕患者诊刮获取的子宫内膜组织标本,经3.7%中性甲醛溶液固定,石蜡包埋,制作4 μm切片,二甲苯中脱蜡,乙醇梯度水化,蒸馏水洗涤,在108 ℃高压2 min,3%过氧化氢/甲醇溶液室温下阻断内源性过氧化物酶活性15 min,1%稀释正常马血清(北京太阳红科技有限公司)37 ℃下孵育30 min,阻断非特异性抗体结合,磷酸盐缓冲液(PBS)冲洗后加入PDGF-AA多克隆抗体、鼠抗人MMP-9 单克隆抗体、E-cadherin 兔单克隆抗体(均购自Abcam 公司),37 ℃孵育60 min,4 ℃ 冰箱孵育过夜。PBS冲洗3次加二抗,37 ℃孵育17 min,PBS冲洗3次,链霉抗生物素蛋白-过氧化物酶(SP)(购于福建迈新生物技术开发公司)显色3~5 min,37 ℃孵育30 min,二氨基联苯胺(DAB)(购于福建迈新生物技术开发公司)显色3~5 min。再经苏木素复染、脱水、透明封固,光学显微镜随机选取5个高倍视野进行观察,放大倍数为400倍。以PBS代替一抗为阴性对照。结果判读:由湖北省黄石市妇幼保健院病理科2名具有副主任职称的病理医师在双盲条件下独立采用半定量法进行等级评定[7],胞质和(或)细胞核中有淡黄色至棕色颗粒被定义为阳性。随机从各组选择3张切片,每张切片随机选取5个高倍视野观察,先进行染色强度评分(无染色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分),再进行阳性细胞百分比评分(阴性为0分, <25%为1分,25%~50%为2分,>50%~75%为3分,>75%为4分),染色强度评分与阳性细胞百分比评分相乘的积为免疫反应评分(IRS)。IRS判断标准:0分为阴性(-),1~4分为弱阳性(+),5~8分为中度阳性(++),9~12分为强阳性(+++)。
1.2.3宫腔粘连的疗效判断 疗效判断标准:宫腔形态、月经恢复正常为痊愈,宫腔形态、月经基本恢复为显效,宫腔形态、月经未改善或加重为无效。痊愈、显效均统计为治疗有效[8]。
1.2.4预后随访 宫腔粘连患者均定期电话随访2年,每3个月1次,了解随访期间成功妊娠、分娩情况。
1.3统计学处理 采用SPSS25.0进行数据分析,计数资料以例数或百分率表示,组间比较采用χ2检验。Spearman秩相关分析E-cadherin、MMP-9及PDGF-AA表达与Nasr分级之间的相关性;Kaplan-Meier生存曲线分析E-cadherin、MMP-9、PDGF-AA表达阴性、阳性的宫腔粘连患者妊娠、成功分娩差异,比较用Log-Rankχ2检验。检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1宫腔粘连组、对照组患者子宫内膜组织中E-cadherin、MMP-9及PDGF-AA的阳性表达率比较 宫腔粘连组患者子宫内膜组织中MMP-9、PDGF-AA阳性表达率均高于对照组(P<0.05),E-cadherin阳性表达率低于对照组(P<0.05)。见表1。
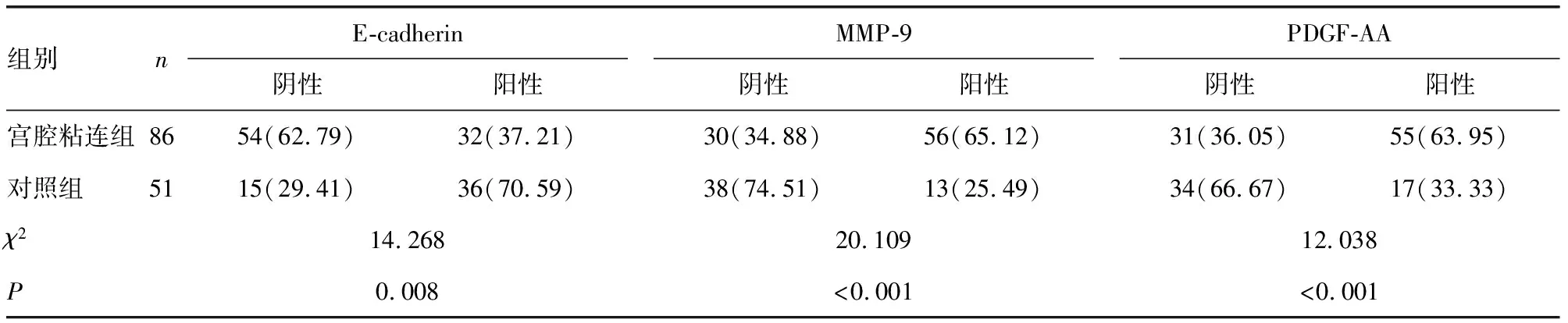
表1 宫腔粘连组、对照组患者子宫内膜组织中E-cadherin、MMP-9及PDGF-AA阳性表达率比较[ n(%)]
2.2E-cadherin、MMP-9及PDGF-AA表达与宫腔粘连患者临床特征、疗效的关系 Nasr分级中重度、输卵管开口不可见、闭经、治疗无效的宫腔粘连患者的MMP-9、PDGF-AA阳性表达率高于Nasr分级轻度、输卵管开口单侧或双侧可见、无闭经、治疗有效的宫腔粘连患者(P<0.05),E-cadherin阳性表达率低于Nasr分级轻度、输卵管开口单侧或双侧可见、无闭经、治疗有效的宫腔粘连患者(P<0.05)。膜性宫腔粘连患者的E-cadherin阳性表达率高于纤维性和肌性粘连患者(P<0.05),纤维性粘连患者和肌性粘连患者之间的E-cadherin阳性表达率差异无统计学意义(P>0.05)。见表2。
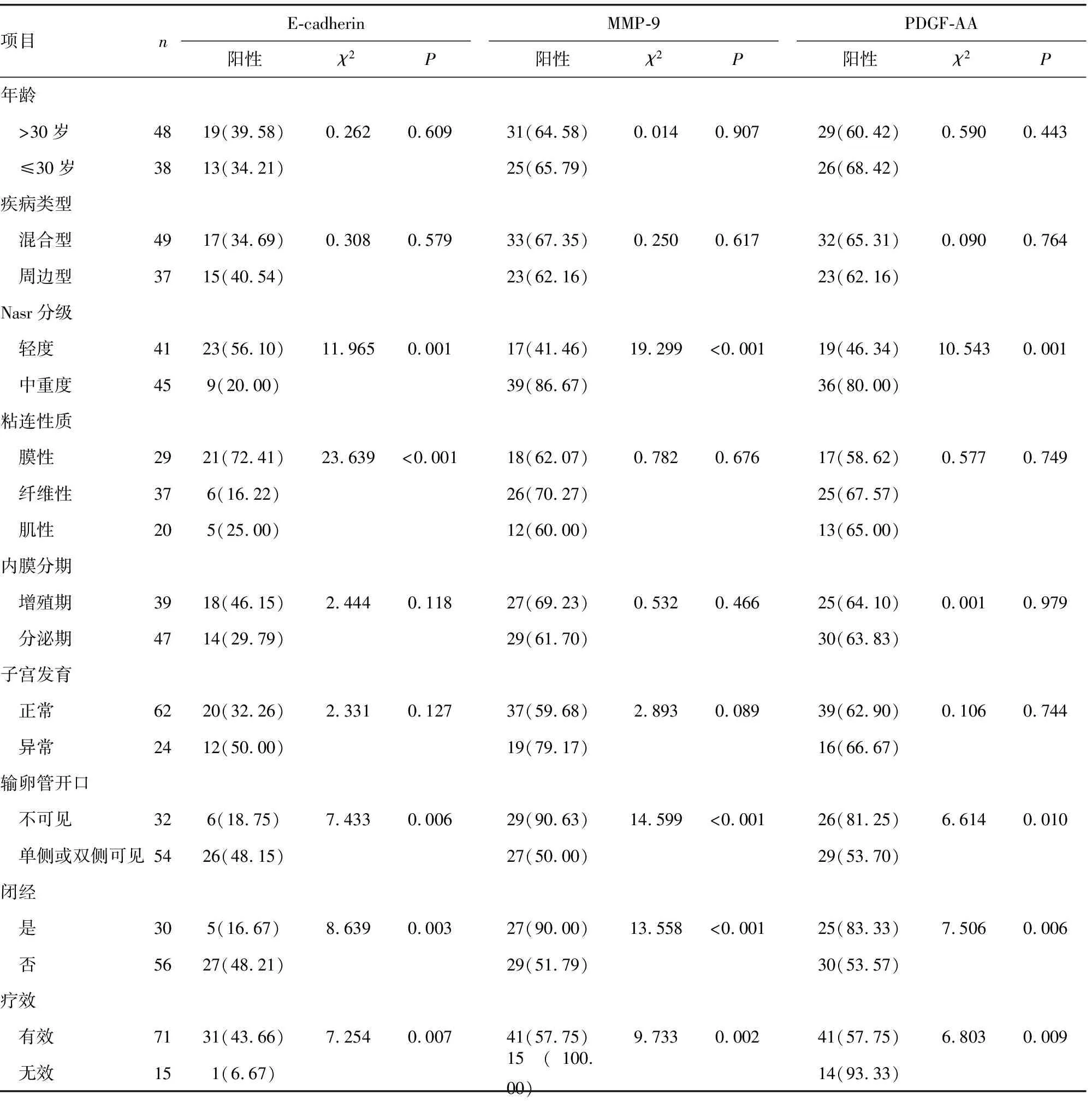
表2 不同宫腔粘连项目和疗效的患者E-cadherin、MMP-9及PDGF-AA阳性表达率比较[ n(%)]
2.3E-cadherin、MMP-9及PDGF-AA表达与Nasr分级的相关性 MMP-9、PDGF-AA表达与Nasr分级呈正相关(r=0.623、0.513,P<0.05),E-cadherin表达与Nasr分级呈负相关(r=-0.569,P<0.05)。
2.4E-cadherin、MMP-9及PDGF-AA与宫腔粘连患者预后的关系 随访期间宫腔粘连患者妊娠32例,成功分娩22例,均存活。MMP-9、PDGF-AA阳性表达者妊娠率分别为25.00%、27.27%,MMP-9、PDGF-AA阴性表达者妊娠率分别为60.00%、54.84%,MMP-9、PDGF-AA阳性表达者妊娠率低于MMP-9、PDGF-AA阴性表达者,差异有统计学意义(P<0.05);E-cadherin阳性表达者妊娠率(56.25%)高于E-cadherin阴性表达者(25.93%),差异有统计学意义(P<0.05)。见图1。E-cadherin、MMP-9、PDGF-AA表达阴性、阳性患者分娩率比较(25.93%vs.25.00%;20.00%vs.35.48%;16.36%vs.41.94%),差异均无统计学意义(Log-Rankχ2=0.006、2.303、3.194,P=0.941、0.129、0.074),见图2。
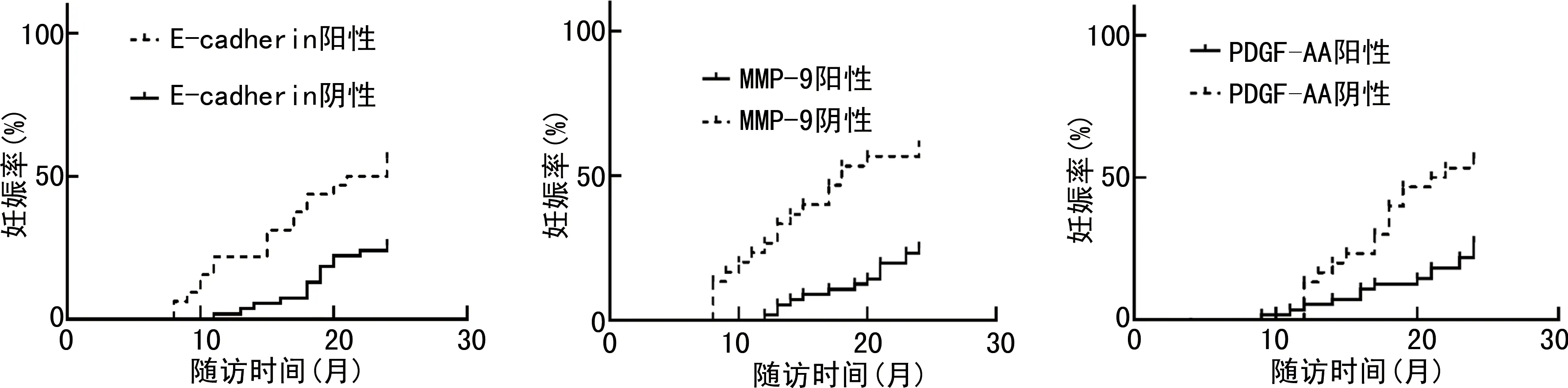
图1 不同E-cadherin、MMP-9、PDGF-AA表达宫腔粘连患者妊娠曲线图
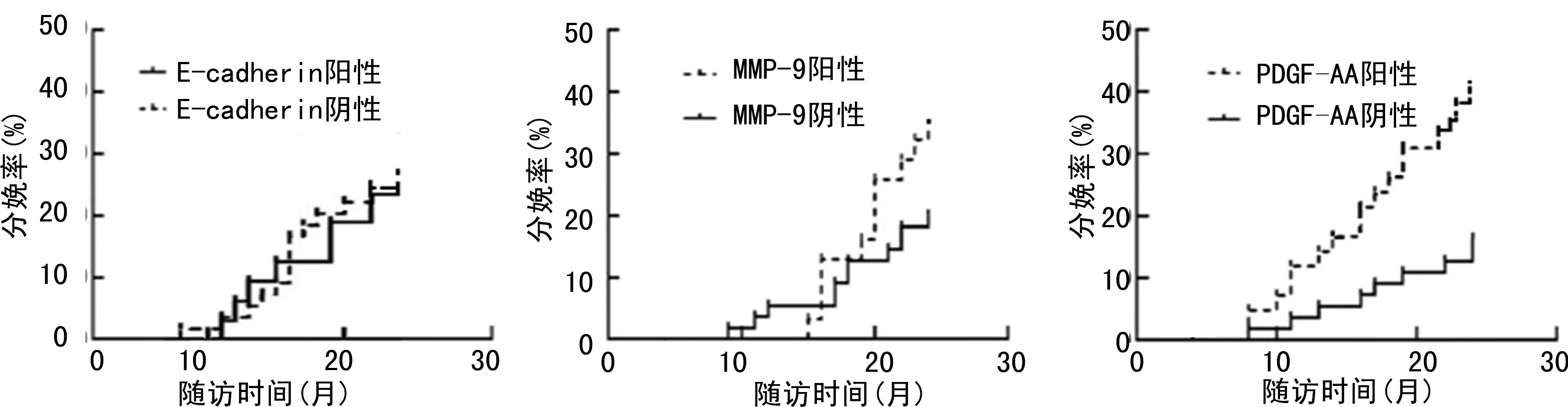
图2 不同E-cadherin、MMP-9、PDGF-AA表达宫腔粘连患者分娩曲线图
3 讨 论
宫腔粘连是子宫内膜损伤后修复障碍最严重的并发症之一。各种原因引起的子宫内膜基底层损伤,可引起内膜上皮细胞再生障碍,并向间质细胞表型转化和迁移,最终导致细胞外基质过度沉积,成纤维细胞增生,造成宫腔粘连[9]。EMT、细胞外基质沉积是宫腔粘连发病机制的关键环节,探讨与其相关的分子生物学机制有助于临床诊断,为治疗提供新的思路和靶点,并对预后预测可能起到一定辅助作用。
E-cadherin是钙黏蛋白家族的一员,在调节钙依赖细胞黏附和细胞连接形成中发挥不可或缺的作用,E-cadherin细胞质尾部可与各种细胞骨架连接,并介导Wnt、转化生长因子-β(TGF-β)、核转录因子-κB(NF-κB)等多种下游信号转导,参与调控上皮细胞发育、组织器官形成,维持机体稳态,形成黏附性连接等过程,对维持细胞间隙、细胞相互作用稳态至关重要[10-11]。E-cadherin表达可抑制EMT,促进上皮细胞增殖、分化和迁移,E-cadherin表达缺乏可引起细胞表皮结构异常和EMT进程[12]。MMP-9是调节蛋白水解活动、降解细胞外基质的关键酶,参与胚胎发育、血管生成、骨骼发育、伤口愈合、细胞迁移等多种生理过程,MMP-9过表达可诱导EMT过程,促使纤维化疾病进展[13-14]。PDGF-AA是具有多生物学效应的生长因子,属于血小板源性生长因子14受体家族,具有促使纤维细胞分化增殖、调控间充质干细胞表型转化等作用[15]。PDGF-AA过表达可导致巨噬细胞、上皮细胞和成纤维细胞之间相互作用,诱导EMT和胶原沉积[16-17]。
本研究结果表明E-cadherin在宫腔粘连患者子宫内膜组织中阳性表达率低于对照组,MMP-9、PDGF-AA阳性表达率高于对照组,且E-cadherin、MMP-9、PDGF-AA表达与Nasr分级、输卵管开口是否可见、是否闭经均有关,说明E-cadherin、MMP-9、PDGF-AA参与宫腔粘连的发生和进展。动物宫腔粘连大兔模型子宫内膜组织中E-cadherin mRNA表达降低,给予骨髓间充质干细胞外泌体修复子宫内膜24 h 后E-cadherin mRNA表达显著升高[18]。体外研究显示重度宫腔粘连患者子宫内膜组织中MMP-9蛋白表达高于非宫腔粘连患者[19]。纪意如等[20]指出PDGF-AA参与宫腔粘连进程。E-cadherin、MMP-9、PDGF-AA与宫腔粘连临床疗效和预后的关系尚不清楚,目前报道十分少见。本研究通过追踪临床治疗效果和术后2年内妊娠结局发现E-cadherin、MMP-9、PDGF-AA表达与疗效和预后均存在关联,表现为E-cadherin阴性表达、MMP-9和PDGF-AA阳性表达宫腔粘连患者疗效差,妊娠率低,说明E-cadherin、MMP-9、PDGF-AA表达与宫腔粘连患者预后存在密切关系,可作为预后评估的参考指标。分析其原因为E-cadherin表达缺失,MMP-9、PDGF-AA过表达可加剧细胞外基质降解、上皮细胞表型转化和EMT过程,为宫腔内膜组织广泛粘连、纤维化提供良好条件,即便在宫腔粘连分解术后仍能复发和导致较低的妊娠率。
综上所述,MMP-9、PDGF-AA在宫腔粘连患者子宫内膜组织中阳性表达增高,E-cadherin阳性表达降低。MMP-9、PDGF-AA阳性表达及E-cadherin阴性表达与宫腔粘连加重、疗效差有关,可作为宫腔粘连患者预后评估的潜在生物学指标。

