酸雨胁迫下琯溪蜜柚叶片转录组差异表达分析
张琼 陆銮眉 朱丽霞

摘要:【目的】研究琯溪蜜柚受酸雨脅迫的内在分子机制,为琯溪蜜柚科学种植提供基础资料,也为酸雨逆境生理提供理论基础。【方法】以模拟酸雨胁迫24h的珀溪蜜柚叶片进行Illumina HiSeq TM 4000高通量转录组测序分析,将组装得到的基因在参考基因组、Nr和KEGG数据库进行比对;利用FDR与log2( FC)来筛选差异基因,筛选条件为FDR< 0.05且log2( FC)>1,将筛选的差异基因做GO和KEGG富集分析。【结果】模拟酸雨喷淋24 h后,珀溪蜜柚嫩叶出现明显块状伤斑;共得到21497个基因,全部得到注释,与对照相比,酸雨处理组中有879个基因显著上调,588个基因显著下调;筛选出样本中前50个DEGs(差异基因),均为上调表达基因,大部分涉及代谢途径、次生代谢、苯丙基类丙烷生物合成和萜类物质合成等相关基因。GO富集分析表明差异表达基因主要位于细胞外区域;执行分子功能中催化剂活性是最为显著富集的GO term,其次是氧化还原酶活性;生物过程中差异表达基因最显著的GO term是DNA代谢过程。KEGG富集分析表明DNA复制是差异表达基因中最显著富集的Pathway,其次是次生代谢的生物合成,再次是苯丙素类合成途径。对次生代谢合成途径中4个差异表达基因[POD同T酶cg39018770和cg29001440、肉桂酰辅酶A还原酶(CCR)同T酶cglg021310.4-香豆酸-辅酶a连接酶( 4CL)同T酶cg39029290]进行PCR荧光定量分析,验证了转录组数据的可靠性。【结论】珀溪蜜柚对酸雨耐性较强,对酸雨胁迫的响应是多基因参与、多生物过程协同调控的过程.次生代谢的调节可能是应对酸雨胁迫的主要方式。
关键词:琯溪蜜柚;酸雨胁迫;转录组测序;差异表达基因
中图分类号:S 666.3;0 948.1
文献标志码:A
文章编号:1008-0384( 2021) 07-075009
Transcriptome Changes of Citrus grandis Seedlings in Response to Acid Rain Stress
ZHANG Qiongl.2,LU Luammeil.2,ZHU Lixia1.2
(1.School of Biological Sciences and Biotechnology, Zhangzhou, Fujian 363000, China;
2.Minnan Normal University, Zhangzhou, Fujian 363000. China)
Abstract:【Objective】Molecular mechanisms of Citrus grandis (L.) Osbeck. cv. Guanximiyou in response to simulated acidrain stress were investigated. 【Method The llumina HiSeq 4000 system,a high-throughput transcriptome sequencingtechnology, was applied to reveal the differential expressions of the grapefruit transcriptome after a 24 h simulated acid raintreatment. The unigenes obtained were compared to the Nr and KEGG database. Abundance of gene expression of the sampleswere screened according to transcriptome data by using PRKM method. Differentially expressed genes (DEGs) among thetreated samples were estimated by referring to the standard of FDR≤0.05 and llog2FC≥1 Functions and pathways of thoseDEGs were analyzed using the Gene Ontology (GO) and KEGG pathway database.【Result】Significant lumpy lesions beganto appear on the young grapefruit leaves 24 h after the artificial acid rain spray with 21 497 fully described unigenes obtainedIn comparison to control, 879 0f the genes were significantly upregulated and 588 downregulated. The top 50 DEGs were all inthe upregulated category and mainly associated with metabolic pathways, secondary metabolism, phenylpropyl propanebiosvnthesis, or terpenoid biosynthesis. The GO enrichment analysis showed the DEGs being largely located in extracellularregion and, among various molecular functions, the catalytic activity being the most significantly enriched, followed byoxidoreductase activity, while the DNA metabolism being the most significant of DEGs in the GO term on biological process.The KEGG enrichment analysis indicated that DNA replication was the most significant enrichment pathway, followed bysecondary metabolic biosynthesis. and lignin synthesis. The PCR fluorescence quantitative analysis on the 4 DEGs in thesecondary metabolic biosynthesis pathway [i.e, POD isozyme cg39018770 and cg29001440, cinnamyl coenzyme A reductase(CCR) isozyme cglg0213 10. and 4-coumaric acid-coenzyme A ligase (4CL) isozyme cg39029290] confirmed that the acid rainstress indeed significantly affected the expressions of these genes.【Conclusion】 C.grandis (L.) Osbeck. cv. Guanximiyouwas strongly tolerant to acid rain. The stress response of the plants involved numerous genes regulated by various collaborativebiological processes. Among them. the regulation of secondary metabolism appeared to play a major role in coping with acidrain stress by the plant.
Key words: Citrus grandis (L.) Osbeck. cv. Guanximiyou; acid rain stress; transcriptome sequencing; differentially expressedgenes
0 引言
【研究意义】琅溪蜜柚Citrus grandis(L)Osbeck. cv.Guanximiyou是我国优质栽培名柚,为芸香科柑橘属果树,其果大皮薄、汁多柔软、香甜微酸,原产于福建省漳州市平和县,已有500多年栽培历史[1-2]。近些年来平和蜜柚种植面积和产量逐年增加,平和被冠以“世界柚乡,中国柚都”之称,是我国最大柚类生产和出口基地。平和县位于福建省漳州市,属南亚热带气候,琯溪蜜柚果园土壤为南亚热带较为典型的酸性红壤,由于多年来酸沉降和农业生产活动造成土壤严重酸化,是蜜柚产业面临的主要危机[3-5]。【前人研究进展】酸雨可影响植物叶片结构,破坏植物角质层,使得酸性成分通过气孔或表皮扩散进入细胞,改变植物茎叶细胞质酸碱平衡,增加细胞膜透性使得叶片中钾、钙、镁等营养元素大量淋失,影响参与基础代谢、细胞建成、光合和转录等过程的蛋白表达水平[6-8]。如酸雨处理显著上调了拟南芥水杨酸信号转导途径和茉莉酸信号通路的基因,也引起拟南芥体内基础代谢、其他信号转导途径相关基因发生变化[9],使得植株对病原菌具有更强的耐受性[10]。牛力[11]研究发现拟南芥有37个与植物次生代谢相关基因表达量发生变化,木质素、生物碱等次生代谢产物的合成在酸雨处理下加强。张琼等[12]研究发现虽然琯溪蜜柚叶片具有较强的酸雨抗性,但重度酸雨胁迫( pH 2.5)显著抑制叶肉栅栏组织发育和叶片光合速率。【本研究切入点】植物的耐酸机理是个复杂过程,琯溪蜜柚种植区位于酸雨分布区内,虽然前期已经报道了酸雨对琯溪蜜柚理化性质的影响[12],但酸雨胁迫对琯溪蜜柚影响的分子机制还鲜见报道。因此对酸雨胁迫下琯溪蜜柚叶片转录组分析可以从分子生物学层面上阐明琯溪蜜柚耐酸机制,为酸雨区琯溪蜜柚种植提供基础资料。【拟解决的关键问题】本研究以2年生琯溪蜜柚植株为试验材料,通过Illumina测序平台,比较转录组水平上模拟酸雨处理( pH 2.5)对幼嫩叶片的影响,分析可能参与抗酸或耐酸调控的相关基因,进一步揭示琯溪蜜柚受酸雨胁迫的响应机理,为琯溪蜜柚科学种植和可持续发展提供理论支持,也为酸雨逆境生理提供基础资料。
1材料与方法
1.1试验材料的培育与处理
春天天气回暖,琯溪蜜柚萌发较快,2018年在2月初修剪2年生琯溪蜜柚,3月初长出部分嫩叶时,选出6棵长势一致的植株,随机分为2组,于上午10:00左右对植株进行模拟pH为2.5的酸雨3个重复喷淋(标记为T-1、T-2、T-3),同时清水3个重复喷淋为对照(标记为CK-1、CK-2、CK-3),处理使得嫩叶上下布满水滴,喷淋24h后采集至液氮,后送至80℃冰箱冷冻保存备用。
1.2 总RNA提取、cDNA合成和转录组测序
将冷冻保存的琯溪蜜柚叶片置于干冰盒中,送至广州基迪奥生物科技有限公司提取总RNA,经过磁珠[带有Oligo( dT)]富集纯化mRNA。将得到的mRNA随机打断为短片段,以这些短片段mRNA为模板,合成cDNA,通过纯化、洗脱、修复、回收,最后进行PCR扩增,完成文库制备。用IlluminaHiSeqTM对文库进行高通量测序,整个流程由广州基迪奥生物科技有限公司完成。
1.3比对参考基因组和转录本组装合并
将过滤完核糖体的reads利用比对软件TopHat2[13]比对到参考基因组|citrus.hzau.edu.cn Genome ofPummelo(Citrus grandis)|上,再用Cufflinks[14]进行组装。将多个样品的组装结果用Cuffmerge进行合并,过滤错误的转录本后生成唯一注释文件。
1.4差异表达基因筛选和功能注释分析
以log2|Fold Change|>1&FDR<0.05为标准筛选出样本间差异表达基因,以未进行酸雨喷淋处理的CK为对照处理,统计酸雨处理样本表达基因的上下调关系。利用GO和KEGG数據库对筛选的差异基因进行分析。将差异表达基因在GO数据库(http://www.geneontology.org/)各条目进行映射,计算相应条目的基因数,可得条目基因列表和基因数目统计。再通过超几何检验,筛选出差异表达基因中显著富集的GO条目,假设检验的p-value计算公式是:
公式中,Ⅳ是所有Unigene中具有GO注释的基因数目,n是Ⅳ中差异表达基因数目,M是所有Unigene中注释为某特定GO条目的基因数目,M是注释为某GO条目的差异表达基因数目。由公式计算的值通过FDR校正后,当Q值≤0.05时,认为是差异表达基因中显著富集的GO条目。
同样通过超几何检验,以KEGG Pathway为单位进行Pathway显著性富集分析。
1.5次生代谢相关酶PCR分析
选择4个与次生代谢相关的差异显著基因[POD同工酶cg39018770和cg29001440、肉桂酰辅酶A还原酶( CCR)同T酶cglg021310、4一香豆酸一辅酶a连接酶( 4CL)同T酶cg39029290]进行验证,内参基因选用Cg39024100(tubulin beta-6 chain)参考王莉嬛等的研究[2],反应体系按照表l配制,引物序列见表2。PCR反应条件:95℃90 s,95℃5s,60℃15 s,72℃20 s,40次循环。
1.6数据统计与分析
转录组数据在信息分析前对原始数据进行质控,并对数据过滤;按照edgeR的一般过滤标准(log2IFold Changel>1且FDR< 0.05)筛选差异基因;PCR定量分析数值为3次重复平均值,数据作图采用Origin 8.0软件。
2结果与分析
2.1叶片伤害表型
由图1可知模拟酸雨喷淋24 h后,琯溪蜜柚嫩叶出现明显块状伤斑,而对照清水喷淋后嫩叶没有出现伤斑,表明pH 2.5的模拟酸雨破坏叶表面角质层,损害叶片表皮结构。
2.2转录组质量检测和RAW数据整理分析
由表3可知通过对照组和处理组琯溪蜜柚叶片样品的转录測序,获得7 361 352 600~9 249 897 000有效数据。对数据进行质控、过滤得到7111 541211~8 926 570 988数据,其030碱基百分比均不小于95.l9%.GC含量均高于44%,表明测序结果可靠,可用于后续分析。
使用短reads比对工具bowtie将过滤后的数据比对到核糖体数据库中,将比对上核糖体的数据去除,剩下的数据用于转录组的组装和分析。未比对上rRNA的reads数量是47756 642~59 953 992,比例在98 .95%~99.36%(表4)。
将过滤完核糖体的数据用转录组数据比对软件TopHat2比对到参考基因组上,能比对上的比例为86.63%~88.59%(表5)。
2.3样本基因的注释和差异表达基因的筛选分析
利用Cufflinks进行转录本组装,利用Cuffmerge对多个样品的组装结果进行合并,共得到21497个基因,其中20573基因在参考基因组中得到注释,有924个新基因没有得到注释。将这些新基因的转录本在Nr、KEGG数据库进行注释。
用全体基因的表达量对所有样本的关系进行层级聚类,层级聚类图可以真实地反映出每个样本与其他样本的关系,图2显示对照组3个重复聚为一类,处理组3个重复聚为一类,由此可以得知本试验处理重复性好。
利用FDR与log2(FC)来筛选差异基因,筛选条件为FDR< 0.05且log2(FC)I>1,结果显示与对照相比,酸雨处理24 h后组中有879个基因显著上调,588个基因显著下调。筛选出样本中前50个DEGs(差异基因),均为上调表达基因,大部分涉及代谢途径、次生代谢、苯丙基类丙烷生物合成和萜类物质合成等相关基因。
2.4差异表达基因的Gene Ontology富集分析
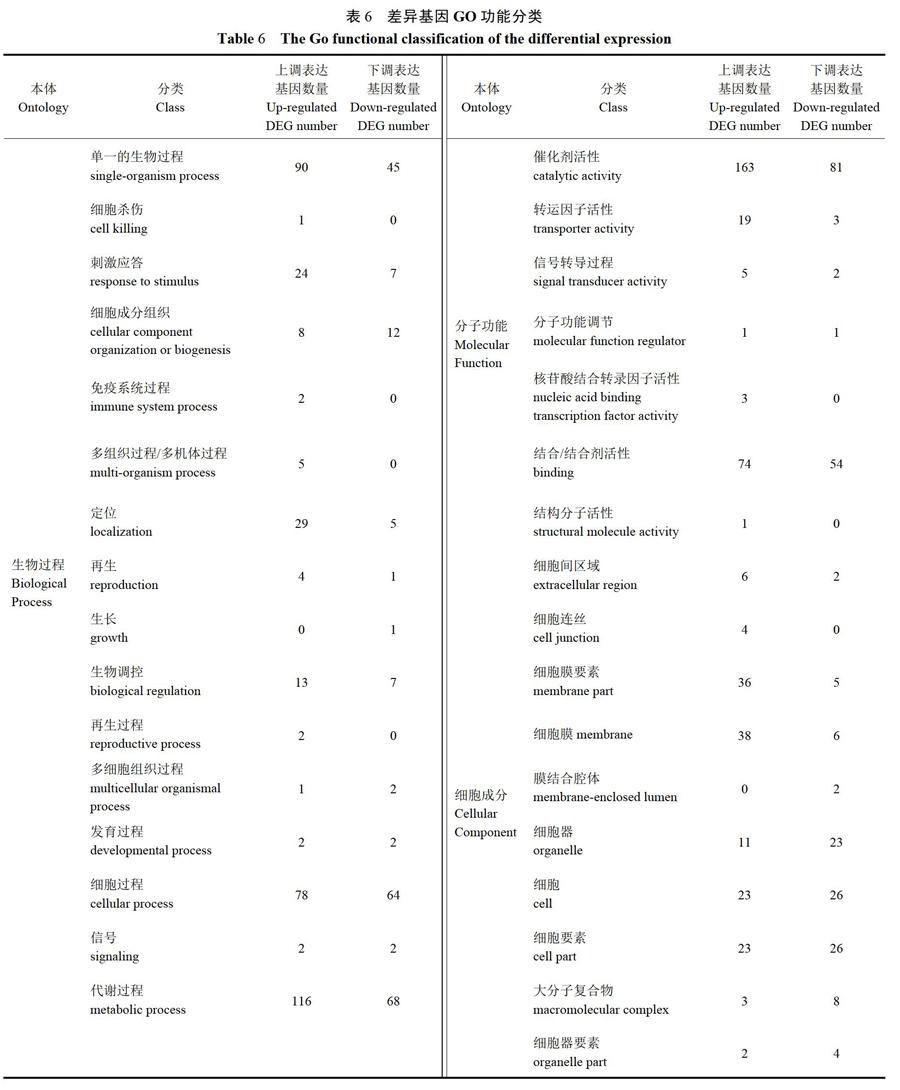
Gene Ontology(简称GO)是一个国际标准化的基因功能分类体系,分别从分子功能( Molecular function)、细胞组分( Cellular component)和生物过程(Biologicalprocess)来描述基因,能够全面描述生物体中基因和基因产物的属性,该体系随着研究的发展而动态更新。对筛选出的差异表达基因做GO功能分析,阐明处理差异在基因功能上的体现。在GO数据库中,细胞组成方面有2 101条基因,有97条显著差异基因,被注释到56条GO term中,其中GO:0005576extracelluar region(细胞外区域)为差异表达基因中最显著富集的一个GO term,其次是GO: 0030312external encapsulating structure。在GO数据库中,分子功能方面有4 686条基因,有279条显著差异基因,被注释到206条GO term中,其中GO:0003824catalytic activity(催化剂活性)为在差异表达基因中最显著富集的一个GO term,其次是GO:0016491oxidoreductase activity(氧化还原酶活性)。在GO数据库中,生物过程方面有4 355条基因,有245条显著差异基因,被注释到409条GO term中,其中GO:0006259 DNA metabolic process(DNA代谢过程)为在差异表达基因中最显著富集的一个GO term,其次是GO: 0009620 response to fungus(对真菌的响应)。表6是对差异基因按上下调进行GO term的分类统计。
2.5差异表达基因的KEGG富集分析
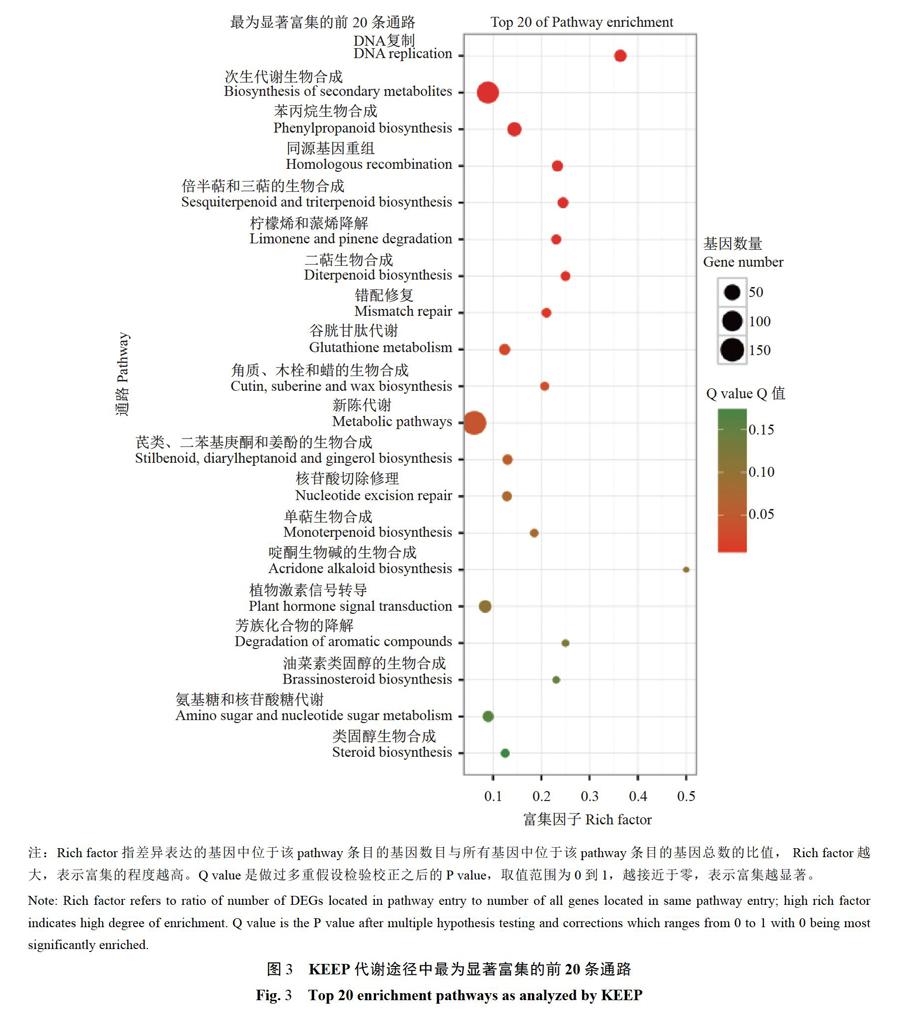
KEGG是代谢通路(Pathway)的主要公共数据库,差异表达基因Pathway显著性富集分析能确定这些差异表达基因参与的最主要的代谢和信号转导途径。本研究中有5 845条基因被注释到KEGG数据库的99条Pathway中,对照和处理组间有303条基因表达差异显著。图3显示差异表达基因中最为显著富集的前20条Pathway(按照Qvalue),其中k003030DNA replication Pathway是差异表达基因中最显著富集的Pathway,在这条通路中有20个基因显著差异表达,与对照相比多为上调表达;其次是次生代谢的生物合成,在这条通路中有121个基因显著差异表达,与对照相比多为上调表达;再次是苯丙素类合成途径,有33个基因显著差异表达,与对照相比多为上调表达;接着是同源重组通路,有14个基因显著差异表达,与对照相比均为下调表达。
2.6次生代谢合成相关酶PCR分析
选择4个与次生代谢相关的差异显著基因[ POD同工酶cg3g018770和cg2g001440、肉桂酰辅酶A还原酶( CCR)同工酶cglg021310、4一香豆酸一辅酶a连接酶( 4CL)同工酶cg39029290]进行验证,经过验证发现这4个基因的实际情况与转录组数据一致,cg3g018770、cg2g001440和cglg021310与对照相比均为上调表达,cg39029290与对照相比明显下调,证明了转录组数据的可靠性(图4)。
3讨论与结论
酸雨对植物直接伤害表现为使叶子褪绿、黄化、出现块状伤斑、失水萎蔫和早落叶等症状,随着酸度增高和淋溶时间的延长受害越严重,一般嫩叶较老叶更易受到伤害[15]。叶片角质层是植物遭遇酸雨胁迫的第一道防线[15],琯溪蜜柚叶片具有较厚角质层,抗酸雨性较强,张琼等[12]研究表明中长期酸雨淋洗没有造成琯溪蜜柚叶片表面的可视性损害,本研究模拟酸雨淋洗的是较嫩叶片,叶片角质层较薄,24 h后就表现出较为明显的伤块,说明酸雨侵蚀嫩叶,产生了直接伤害。
酸雨通過气孔或被损害的叶片表皮进入细胞内部,会破坏代谢平衡,降低植物的光合作用[16-17],近些年来一些学者从分子生物学水平研究了酸雨对植物的影响。Hu等[6]研究认为酸雨胁迫可使得酸雨抗性物种大多参与基础代谢、细胞建成、光合和转录等过程的蛋白表达水平上调,使得酸雨敏感物种代谢、光合、信号转导和转录相关蛋白表达水平下调,本研究中酸雨处理24 h后琯溪蜜柚叶片有879个基因显著上调,588个基因显著下调,而筛选出样本中前50个DEGs(差异基因),均为上调表达基因,大部分涉及代谢途径、次生代谢、苯丙基类丙烷生物合成和萜类物质合成等相关基因,由此可以推测琯溪蜜柚对酸雨耐性较强。GO富集分析表明差异表达基因主要位于细胞外区域,催化剂活性是分子功能最为显著富集的GO term中,其次是氧化还原酶活性,生物过程中差异表达基因最显著的GO term是DNA代谢过程。对差异基因对照KEGG数据库进行注释显示酸雨胁迫显著抑制DNA复制通路,促进次生代谢的生物合成,尤其是苯丙素类合成途径。次生代谢是植物在长期进化中与环境相互作用的结果,是提高植物抗逆性的主要调节机制[18-19]。由此可推测琯溪蜜柚主要是通过抑制DNA复制,影响细胞分裂增殖,进而抑制叶片生长,以此为代价使得植物将更多能量和资源分配给次生代谢来应对酸雨胁迫。选择次生代谢合成途径中3个主要基因[ POD同工酶cg39018770和cg29001440、肉桂酰辅酶A还原酶( CCR)、同工酶cglg021310]进行PCR荧光定量验证分析,结果也显示酸雨处理均明显促进了这3个基因的相对表达,进一步验证了转录组分析的结果。琯溪蜜柚通过调节次生代谢提高耐酸性与拟南芥耐酸机理相似,酸雨胁迫下拟南芥有多个与植物次生代谢相关基因表达量发生变化,木质素、生物碱等次生代谢产物的合成在酸雨处理下加强[11]。
本研究从表型和分子生物学角度研究酸雨胁迫对琯溪蜜柚的影响,结果表明pH 2.5的模拟酸雨侵蚀琯溪蜜柚嫩叶产生直接伤害;酸雨喷淋使得叶片部分基因表达差异显著,差异表达基因主要位于细胞外区域,对催化剂活性和氧化还原酶活性影响较大,酸雨胁迫显著抑制DNA复制通路,促进次生代谢的生物合成,尤其是苯丙素类合成途径。由此可得出琯溪蜜柚对酸雨胁迫的响应是一个多基因参与、多个生物过程协同调控的过程,次生代谢的调节可能是应对酸雨胁迫的主要方式。
参考文献:
[1] 林燕金,林旗华,姜翠翠,等福建省柚类产业发展现状及对策[J]东南园艺、2014.2 (5):39-42
LIN Y J,LIN Q H,JIANG C C,et al Industry status andcountenneasures of pomelo industry in Fujian Province [J].SoutheastHorticulture. 2014.2(5):3942. (in Chinese)
[2] 王梨嬛,潘永娟,杨莉,等‘琯溪蜜柚荧光定量PCR内参基因的筛选[J]果树学报,2013. 30(1):4854
WANG L H. PAN Y J,YANG L,et al Validation of internalreference genes for qRT-PCR normalization in Guanxi Sweet Pununelo(Citrus grandis) [J] Journal of Fruit Science. 2013. 30(1):4854. (in Chinese)
[3] 赵卫红福建省主要城市降水离子特征及沉降量现状分析[J].业热带资源与环境学报,2008.3 (3):1924
ZHAO W H On characteristics of precipitation ion and cunentsediinentation situanon in main cities of Fujian Province [J].Journalof Subtropical Resources and Environment. 2008.3(3):1924(inChinese)
[4] 钱笑杰,林晓兰,肖靖,等福建果园上壤pH值、养分关系与上壤肥力质量评价研究以福建省漳州市平和县珀溪蜜柚园地为例[J]福建热作科技,2017. 42 (1):9-15
QIAN X J,LIN X L,XIAO J,et al_Evaluation research between soilpH. nutrition and soil fertility in Fujian orchard EJl Fujian Science&Technology of Tropical Crops. 2017. 42(1):9-15( in Chinese)
[5] 任晓巧,章家恩,向慧敏,等酸雨对植物地上部生理生态的影响研究进展与展望[J].应用与环境生物学报,2021. 27 (5):1-10
REN X Q,ZHANG J E,XIANG H M. et al Research advances andprospects for effects of acld raill on the abov.ground physlol.gy ofplants alld the related allevlatlon countermeasures[J].ChineseJournal of Applied & Environmental Biology,202l,27(5):1-10(m Chmese)
[6]Hu w J,cHEN J,LrU T w,et al Proteome aIld calcium-related geneexpresslon in Pinus massoniana needles m re8ponse to acld rain underdlfferem calciun levels[J].Plant and Soil 2014,380:285-303
[7] 宋晓梅,曹向阳模拟酸雨对小同园林植物叶片生理生态特性的影响[J]水上保持研究,2017,24(2):365 370
SONG X M CAO X Y Effect of smmlated acld ram on thephyslol091cal and ecologlcal characte11stlcs of dlfferent gardenplaIlts[J].Research of Soil and Water Conservation,2017,24(2):365 370(m C11iIlese)
[8] YAN P,wu L Q,wANG D H,et al s011 acidificatlon ln chlnese teaplaIltations[J].Science of the Total Environment,2020,715:1-7
[9] LrU T w,NIu L,Fu B,et al_A transcriptomic smdy revealsdiffrentially expressed genes and pathw8ys re8pond to simulated acldraln in Araidopsis thaliana [J].Genome,2013,56(1):49-60
[10]俞翰炳模拟酸雨对拟南芥抗病性的影响及机理探宄[D].杭州杭州师范大学,2015
YU H B Snldles on efkcts and mechanlsms of simulated acld raln onArabidopsis6 thaliana tolerance to dlsease[D]Hangzhou:HangzhouNomlal Universlty,2015(m Ch111ese)
[11]牛力模拟酸雨对拟南芥某些生理特性利基因表达谱的影响[D]厦门:厦门大学,2009
NIU L Effects of simulated acld rain on som.physl01091calcharacte11stlcs and gene expression profiles of Arabidopsisthaliana[D].X1alnen,China:Xiamen University,2009(in Chinese)
[12]张琼,陆銮眉,戴清霞,等模拟酸雨对‘珀溪蜜柚叶片抗氧化酶活性和光合作用的影响[J].果树学报,2018. 35 (7):828835
ZHANG Q. LU L M. DAI Q X,et al Effects of acid raui on the leavesantioxidase activity and photosynthesis of Citrus Graudis(L.) Osbeck.' Guanximiyou' seedlings [J]. Journal of Fruit Science. 2018. 35(7): 828835 (in Chinese)
[13] KIM D. PERTEA G,TRAPNELL c,et al TopHat2: accuratealignment of transcriptornes in the presence of insertions. deletions andgene fusions EJl Genome Biology, 2013. 14( 4) R36
[14] TRAPNELL c,WILLIAMS B A,PERTEA G,et al Transcriptassembly and quantification bv RNA-Seq reveals unannotatedtranscripts and isoform switching duruig cell differentiation [J]Nature Biotechnology, 2010. 28(5):511-515
[15]任晓巧,章家恩,向慧敏,等酸雨对植物地上部生理生态的影响研究进展与展望[J/OL].应用与环境生物学报:1-12 [2021-04-25]https:∥doi org/10.19675/j.cnk1.1006—687x 2020 07054REN X Q. ZHANG J, XIANG H M. et al Research advances andprospects for effects of acid rain on the aboveground physiology ofplants and the related alleviation countermeasures [J/OL]. ChineseJoumal of Applied and Environinental Biology: 1-12 [2021-04-25]https://idoiorg/10. 19675/j cnki. 1006-687x2020.07054. (in Chinese)
[16]张利霞.郝国宝,常青山,等模拟酸雨胁迫对夏枯草抗氧化酶活性和光合参数的影响[J].中国草地学报、2020. 42 (4):5661
ZHANG L X,HAO G B,CHANG Q S,et al_ Antioxidant capacity andphotosynthetic characteristics of Prunella vulgaris seedlings mresponse to siinulated acid rain stress [J]. Chinese Journal ofGrassland. 2020. 42 (4): 5661( in Chinese)
[17]马永件,粱婵娟外源钙对模拟酸雨胁迫下水稻质膜组分和钙形态的调节[J]农业环境科学学报,2021. 40(6): 1159-1166
MA Y J,LIANG C J Regulation of exogenous calcium on plasmainembrane coinpositions and calcimn fonns of rice roots undersimulated acid rain stress [J]. Jounial of Agro-Environment Science.2021. 40(6):1 159-1166 https://kns.cnki.net/kcms/detail/12.1347
[18]刘洪博,刘新龙,苏火生,等干旱胁迫下割于密根系转录组差异表达分析[J]中国农业科学,2017. 50 (6):1167-1178
LIU H B.LIU X L,SU H S,et al Transcriptome difference analysis ofSaccharum spontaneum roots m response to drought stress [Jl ScientioAgricultura Sinico. 2017. 50(6):1167-1 178.( in Chinese)
[19]阎秀峰植物次生代謝生态学[J]植物生态学报,2001. 25 (5):639640. 622
YAN X F Ecology of plant secondary inetabolism [J]. ActoPhvtoecologica Sinica. 2001. 25(5)639640. 622(in Chinese)
(责任编辑:黄爱萍)
收稿日期:2021-0307初稿;2021-04-15修改稿
作者简介:张琼( 1980-).女,博士研究生,副教授,研究方向:植物生态学(E-mail: 349369029@qq.com)
基金项目:福建省自然科学基金项目(2020J01810)

