蛙类脑膜脓毒性伊丽莎白菌多克隆抗体的制备及应用
张新艳 曾占壮 叶小军 卓玉琛 钟全福 余培建


摘要:【目的】制備蛙类脑膜脓毒性伊丽莎白菌多克隆抗体,建立间接ELISA检测方法,进行病原菌在宿主体内的示踪研究,为病原菌的致病机理研究奠定基础。【方法】将分离白患歪头病的棘胸蛙的脑膜脓毒性伊丽莎白菌(Elizabethkingia meningosepticum)RsB1151018NA甲醛火活后,免疫新西兰大白兔制备兔抗血清。通过优化反应条件,建立脑膜脓毒性伊丽莎白菌间接ELISA的检测方法;兔抗血清多克隆抗体采用ProteinA亲和层析柱分离纯化,以异硫氰酸荧光素( FITC)标记,标记后的抗体与感染RsB1151018NA的棘胸蛙小同脏器组织的冷冻切片反应,荧光显微镜观察,跟踪RsB1151018NA在棘胸蛙体内的迁移。【结果】试验结果表明,制备的兔抗棘胸蛙脑膜脓毒性伊丽莎白菌多克隆抗体血清效价为1:5.12×10 5,纯化后的抗体效价为1:1.6×10 4,且建立的问接ELISA方法检测脑膜脓毒性伊丽莎白菌具有高度特异性,与其他水产常见病原菌没有交叉反应,检测灵敏度为1.0×10 4 CFU·mL-1。脑膜脓毒性伊丽莎白菌在棘胸蛙体内随血液循环而分布至全身,可侵袭肌肉、肝脏、肾脏、脾脏、肠道、心脏、眼和脑等组织器官,肾脏、眼和脑感染程度最严重,推测这三个组织器官是其靶器官;创伤感染是可能的感染途径之一。【结论】建立的检测方法能够快速、灵敏、特异地检测脑膜脓毒性伊丽莎白菌,对蛙类歪头病的防控和早期诊断可提供理论参考依据;另外利用免疫荧光检测病原菌在宿主体内的迁移,研究病原的致病机理及发病过程等,能为防治药物的研发和防治方法的确定提供理论依据。
关键词:脑膜脓毒性伊丽莎白菌;多克隆抗体;酶联免疫反应;检测;蛙“歪头病”
中图分类号:S 947
文献标志码:A
文章编号:1008-0384( 2021) 07-078508
Preparation and Application of Rabbit Polyclonal Antibodies against
Elizabethkingia meningosepticum on Frogs
ZHANG Xinyan. ZENG Zhanzhuang,YE Xiaojun,ZHUO Yuchen,ZHONG Quanfu,YU Peijian
(The FreShwdter FlSherieS Resenrch Institute of Fujian Province,Fuzhou,Fujian 350002,Chinn)Abstract:【Objective】 Rabbit p01yclonal antibodies against Elizabethkingia meningosepticum (Em) were prepared toestablish an indirect ELISA detection to trace the pathogenic attack in organs of frogs(Rana spp) 【Method】 The strainRsB 1151018NA of Em from a diseased R.spinasa was iso1ated,formalin-inactivated,and injected into a rabbit for the semmpreparation An optimized indirect ELISA using the rabbit p01yclonal antibodies was developed for tracing RsB1151018NAThe rabbit immun0910bulin G was purified on a protein A column The purined antibodies were marked with FITC and furtherpurified on a desalting column Sephadex G-25 for subsequently tracing the pathogen in organs of the inoculated frogs【Results】The obtained rabbitpolyclonal antibodies showed atiterupt01:5 12×10 5,andl:1.6×104 afterpurification.Theindirect ELISA assay on the p01yclonal antibody was specific and sensitive in detecting Em without cross-reaction on otherbacteia.It had a detection limit of 1 0×104 cfu mL_1 According to the in vivo tracing test,RsB1151叭8NA distibutedthoughout me entire frog body by blood circulation with the most serious infections in the kidney,eyes,and brain【Conclusion】 The optimized indirect ELISA detection of Em was rapid,sensitive,and specific in tracing the bacterialinfection on R.spp.It was considered applicable for early diagnosis of the“crooked-head disease”and breeding ofhealthyfrogs for food and medicine
Key words: Elizabethkingia meningosepticum;
polyclonal antibodies; ELISA; detection; "crooked-head disease" of frogs
0 引言
【研究意义】脑膜脓毒性伊丽莎白菌( Elizabethkingia meningosepticum),又脑髓膜炎败血伊丽莎白菌,早期曾被称为脑膜脓毒性金黄杆菌( Chryseobacterium meningosepticum)、脑膜炎败血黄杆菌( Flavobacterim meningosepticum),为革兰氏阴性杆菌,广泛分布于河水、海水、土壤和医院等环境中,可引起人的败血症与脑膜炎,还能引起各器官感染性炎症,甚至是获得性骨髓炎等[1-6]。同时,脑膜脓毒性伊丽莎白菌还可对各种蛙类造成重大危害,引发蛙类“歪头病”,造成养殖蛙类的大量死亡,直接造成重大经济损失[7-12]。2008年《中华人民共和国农业部公告》第1125号将蛙脑膜炎败血金黄杆菌病列为三类动物疫病。同时该菌对其他水生动物也有一定的致病性[13-18]。鉴于此,有必要对其检测技术及在棘胸蛙体内的迁移规律进行研究,建立该病的早期诊断方法,初步掌握该病原菌的致病机理,为该病的防治提供技术支撑。【前人研究进展】酶联免疫吸附试验( EIISA)敏感性高,操作简便,已广泛用于多种病原体的抗原或抗体的检测。多抗血清因其检测制备周期短且使用比较简单方便,检测的灵敏度较高,在水产类的细菌性疾病的诊断和流行病学调查中发挥了重要作用[19-28]。荧光素标记抗体(FA)是目前广泛应用于免疫病理、细胞化学、流式细胞学、病理学及自身抗体的临床免疫中的特异、灵敏、定性和定位相结合的免疫化学试剂[29-34]。【本研究切入点】国内外学者已开展关于脑膜脓毒性伊丽莎白菌引起的蛙类“歪头病”的研究,主要集中在PCR检测及传统的防治药物筛选,有关病原的免疫学检测及病原在宿主(蛙类)体内迁移规律及该菌对蛙类的致病机理的研究有待深入探讨。本研究通过制备蛙类脑膜脓毒性伊丽莎白菌多克隆抗体并建立检测方法,同时将制备的多克隆抗体进行荧光标记用于脑膜脓毒性伊丽莎白菌在蛙体内的示踪研究。【拟解决的关键问题】本研究拟建立能够快速、灵敏、特异地检测脑膜脓毒性伊丽莎白菌的间接ELISA检测方法,对棘胸蛙歪头病的防控和早期诊断可提供理论参考依据;另外利用免疫荧光检测对病原菌在寄主体内的示踪,研究病原的致病机理及发病过程等,从而进一步掌握该病的发病规律,有助于对病害的诊断与防治提出更为有效的方法。
1材料与方法
1.1试验菌株及材料
脑膜脓毒性伊丽莎白菌菌株RsB1151018NA为本实验室分离白患“歪头病”的养殖棘胸蛙脑部,其他菌株为本实验室保存。
新西兰大耳白兔2只,体重1.5 kg左右,经检疫无病原菌的一级动物,购于青岛康大生物科技有限公司。
弗氏完全佐剂、弗氏不完全佐剂、四甲基联苯胺( TMB)、异硫氰酸荧光素(FITC)为美国SIGMA公司产品,ProteinA亲和层析柱、Sephadex G-25柱、蛋白质量标准( Marker)为GE公司产品,辣根过氧化物酶标记的羊抗兔IgG( Goat anti rabbit IgG-HRP)为Thermo Scientific Pierce产品,其他试剂为国产分析纯。
1.2方法
1.2.1抗原制备 RsB1151018NA接种营养肉汤培养基,28℃、180 r·mm-1振荡培养24 h,5 000 r·min-l离心10 min,弁上清,无菌PBS重悬菌体,再次离心收集菌体,4%甲醛灭活,经涂布营养琼脂平板验证无活菌后离心弃上清,无菌PBS重悬菌体,超声波破碎菌体,12 000 r·mm-1离心5 min,取上清得到抗原蛋白,蛋白定量,进行动物免疫。
1.2.2动物免疫 调整抗原蛋白含量,取免疫抗原与弗氏完全佐剂(基础免疫)或弗氏不完全佐剂(加强免疫)充分乳化,之后分别在兔的背部皮内多点注射。免疫两只兔子,共免疫5次,免疫量每次I mg·只-1,每次免疫间隔20 d,第五次免疫后14 d取全血。静置30 min后3 000 r·mm-1离心20 min,取上清即为多克隆抗体血清。
1.2.3抗体效价测定 调整抗原蛋白含量包被于96孔酶标板,0.1 ug·孔-1。以5%脱脂奶粉或1%BSA溶液封闭后备用。
将兔抗血清稀释成:1:500,1:2 000,1:8 000,1:32 000.1:16 000,1:128 000,1:512 000.
1:2 048 000.100 uL·孔-1用于ELISA检测。每个梯度设置2个平行组,以正常兔血清(免疫前的)1:10 000稀释作为阴性对照。37℃孵育th,PBST清洗酶联反应孑L。Goat anti rabbit IgG-HRP反应45 min,PBST清洗酶联反应孔。TMB显色10 min后加入50 uL H2S04溶液(2 mol·L-1)終止反应。OD450 nm处测得光密度值并进行数据分析。
1.2.4间接ELISA检测方法的建立 脑膜脓毒性伊丽莎白菌间接ELISA检测方法的最适含量和反应条件采用方阵滴定法确定。特异性检测:取抗原蛋白及其他对照菌株(表1)蛋白包被于酶联反应孔中,封闭后用于抗体特异性测定。
灵敏度检测:无菌生理盐水调整脑膜脓毒性伊丽莎白菌RsB1151018NA含量进行包被,稀释倍数从1×lOs CFU·mL-l起,1%BSA封闭液封闭后,加入最适工作浓度兔抗脑膜脓毒性伊丽莎白菌多克隆抗体,进行间接ELISA法检测。以检测结果阳性的最小数值对应的菌体浓度为检测灵敏度。
1.2.5抗体纯化 取10 mL兔血清用ProteinA亲和层析柱进行抗体纯化,并进行SDS-PAGE分析其纯度。
1.2.6抗体标记 取6 mg抗体,用0.01 mol·L-1 PBS( pH7.4)透析,再用0.1 mol·L-l NaHC03( pH9.5)调pH值至9.0,然后加入FITC混匀,避光反应2h,12 000 r·min-1高速離心5 min去除变性蛋白,用Sephadex G-25分离除去游离FITC并脱盐,监测回收第一峰即为IgG-FITC复合物。离心浓缩并冻干,使用0.01 mol·L-l PBS( pH7.4)缓冲液(含1%BSA,50%甘油,0.03 %Proclin300)调整含量至2 mg-mL-l,500uL·管-1分装。-20℃避光保存,避免反复冻融。
1.2.7病原菌体内示踪研究 菌株RsB1151018NA划线接种BHI平板,30℃培养24h,以无菌生理盐水洗下菌苔制备菌悬液母液,平板活菌计数法计数。以无菌生理盐水稀释菌悬液母液至10' CFU.mL-l,背部皮下注射10只健康棘胸蛙,注射剂量为0.5 mL.只-1。试验持续3d,其间水温保持18.5±1.0℃。于人工感染后的6、12、24、36、48、60、72 h,随机抽取试验蛙3只制备检测样本:无菌解剖试验蛙,分别取背部肌肉、肝脏、肾脏、脾脏、肠道、心脏、血液、眼、脑等器官组织,常规冷冻切片,用异硫氰酸荧光素( FITC)标记的兔抗脑膜脓毒伊丽莎白菌多克隆抗体与样本反应th,荧光显微镜观察。每个标本观察5个视野,以5个视野菌体数量平均值的对数绘制各器官组织中菌体数量动态变化曲线。
2结果与分析
2.1抗体效价测定
抗体效价测定结果见表2,结果显示,兔抗多克隆抗体血清的效价达1:5.12×105以上。
2.2 ELISA条件优化
经方阵滴定法确定,抗原最适包被含量为1×10 7 CFU·mL-l,在加盖恒温箱中37℃包被过夜,用1%BSA封闭液封闭1.5 h;多克隆抗体最适含量为1:8×103( 0.5 ug·mL-l),37℃作用1 h;羊抗兔IgG-HRP最佳含量为1:10 4,37℃加盖恒温箱中反应,时间45 min。
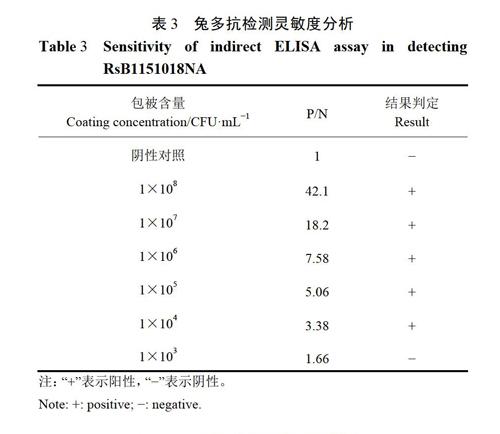
2.3检测灵敏度分析
兔多克隆抗体检测抗原RsB1151018NA灵敏度分析结果见表3,结果表明,所制备的兔多克隆抗体对抗原RsB1151018NA的检测灵敏度是1×104 CFU·mL-l。
2.4抗体纯化
抗体纯化效果见图1~2,纯化后的抗体仅出现50 kD和25 kD的条带,与IgG蛋白电泳图谱相符,表明抗体得到了有效纯化。 抗体纯化后抗体的效价分析结果见表4,结果表明,经纯化的多克隆抗体效价为1:1.6×10 4。
2.5抗体特异性分析
间接ELISA法分析兔多克隆抗体的检测特异性结果见表5,结果表明,兔多克隆抗体与脑膜脓毒性伊丽莎白菌RsB1151018NA及LCCiL90625NA-C的检测结果为阳性,与其他细菌的检测结果为阴性,因此,制备的兔多克隆抗体可特异性检测脑膜脓毒性伊丽莎白菌。
2.6抗体标记
标记后抗体纯化图谱见图3,纯化后抗体效价测定见表6,结果表明:抗体经过标记且纯化后的效价可达到1:1.6×10 3。
2.7病原菌体内示踪研究
试验菌株RsB1151018NA不同时间段在蛙体不同组织器官的分布详见表7、图4~5。试验结果显示:(1)前12 h内,RsB1151018NA在肌肉中含量最高,24 h后,在肾脏中含量最高,48 h后则是脑部含量最高,一直维持至72 h试验结束;(2)肌肉、心脏中的菌体含量随试验时间推移逐渐减少,肌肉至60 h后、心脏至72 h后即无法观测到菌体存在;血液在试验期间菌数含量无明显变化;肝脏、肾脏、脾脏则表现出先增加后逐步减少的趋势;肠道白24h开始观察到菌体后,一直到试验结束,菌数均维持在相对稳定的水平;眼、脑则白12 h观测到菌体后,一直到试验结束,菌数呈现出随时间推移逐渐增多的趋势;(3)试验期间,部分脏器菌数的达峰时间分别为:肌肉、心脏6h,肝脏48 h,肾脏、脾脏和肠道36h。
试验结果说明:RsB1151018NA在棘胸蛙体内随血液循环而分布至全身,可侵袭肌肉、肝脏、肾脏、脾脏、肠道、心脏、眼和脑等组织器官,肾脏、眼和脑感染程度最严重,推测这三个组织器官是其靶器官。
3讨论
制备病原体的抗体,进行免疫学检测已成为水产动物病原检测的一个重要手段,间接ELISA技术应用于其他水产病害方面的报道很多,国内外学者已对嗜水气单胞菌、鳗弧菌、溶藻弧菌和副溶血弧菌等水产养殖重要致病菌建立了行之有效的快速检测手段[19_28],但是用于检测棘胸蛙脑膜脓毒性伊丽莎白菌的有效方法尚待深入探讨。
水产养殖动物细菌性病害的发生往往具有暴发性,快速检测病原、诊断病害将实现病害及时防治、降低损失,但传统的生理生化鉴定往往费时费力,影响病害的诊断及防治。酶联免疫吸附实验是酶免疫测定技术中应用最广的技术。其操作方法很多,对于检测抗原而言,主要有双抗体夹心法和间接法两种。由于EILSA敏感性高,操作简便,现已广泛用于多种病原体的抗原或抗体的检测。多抗血清因其检测制备周期短使用比较简单方便,检测的灵敏度较高,在水产类的细菌性疾病的诊断和流行病学调查中都发挥了重要作用。本研究制备兔抗棘胸蛙脑膜脓毒性伊丽莎白菌多克隆抗体,效价为1:5.12×105.适用于后续研究;建立了间接ELISA检测方法. 检测灵敏度为1.0×104CFU·mL-l.由于该菌为条件致病菌,需达到一定浓度方可引起蛙发病,因此,本研究制备的抗体及检测方法能够满足条件致病菌在生产实际的检测、防治和预警的需要。该方法能检测到的病原菌,与弧菌科常见水产动物病原菌无交叉反应,在实际生产中对脑膜脓毒性伊丽莎白菌的检测具有较强的实际意义,并为脑膜脓毒性伊丽莎白菌商品化检测试剂盒的研制提供了理论依据和物质基础。
细菌对生物体的致病机理研究历来是病原菌研究的重点,对防治药物的研发和防治方法的确定具有重要的意义。对于脑膜脓毒性伊丽莎白菌的致病机理,目前主要集中于人类[35-36],至于该菌对蛙类的致病机理,国内外则鲜见研究与报道。本文尝试通过对脑膜脓毒性伊丽莎白菌在棘胸蛙体内的示踪研究,掌握其在蛙体内各脏器间的迁移规律,试验结果提示,脑膜脓毒性伊丽莎白菌在棘胸蛙体内随血液循环而分布至全身各脏器组织,其靶器官为棘胸蛙的肾脏、眼和脑部,这与感染脑膜脓毒性伊丽莎白菌后病蛙主要症状表现为歪头、白内障、活动失衡等相符合。
参考文献:
[1] KING E o Studies on 8 group of previously Imclassified bacteriaassociated with ineningitis in infants[J].American Journal of ClinicalPothology,1959,31 (3):241-247
[2] LrN P Y,CHU c,SU L H,et al Microbiological analysis ofbloodstream infections caused bv Chrvsobacterium meningosepticumin non-neonatal patients[J],Chin Microbiol. 2004.42:353-355
[3] WASHINGTON c w,STEPHEN D A WILLIAM J M.et alKoneman's Color Atlas and Textbook of Diagnostic Microbiology[M] 6th Edition. Philadephia: Lipincott Williams and Wilkins. 2006
[4] CEYHAN M, CELIK M Eli:abethkingia menrngoseptlcum(Cbryseobocterium menmgosepticum) Infections in Children[J]Internotionol Journal of Pediatrics. 2011:215-237
[5] RATNAMANI M s,RAO R Eliobethingia menmgoseptica:Emerging nosocomial pathogen m bedside hemodialysis patients EJlIndian Journal of Critrcal Care Medicine,2013,17 (5):304307
[6] UPASANA BHUMBLA. ADITI MEHTA. ANAMIKA VYAS. et alEliabetbethkingia menigoseptica, an elnergmg pathogen: a casereport EJl Int J Med Re. 2017.4(3):3537
[7] 張奇亚,李正秋,吴玉琛美国青蛙“旋游症”病原菌的分离鉴定及其组织病理学观察[J]中围兽医学报、1999、19(2):152-155ZHANG Q Y,LI Z Q,WU Y C Isolation and characterization on thebacterial pathogen Flavobaterium meningospticum。prom thediseased flog(Rama grylio)wlth“spmmg swim symptom”[J]Chinese Journal of Veterinary Science,l999,l9(2):152-155(lnChinese)
[8]周永灿,朱传华,陈围华,等虎纹蛙白内障病痛原的分离鉴定及其免疫防治[J]上海水产大学学报,200l,10(1):16-2l
ZHOU Y C,ZHU C H,CHEN G H,et al Isolation aIld identificatlonof pathogen of the cataract disease and its immunologlcal control inRana tigrina rugulosa [J].Journal of Shanghai Fisheries University,2001.10(1):16 2l(in Chinese)
[9]陈爱平,江育林,钱冬,等蛙脑膜炎败血金黄杆菌病[J]中国水产,2012(5):51 52
CHEN A P.JIANG Y L,QIAN D,et al CheyseobacteriumMeningosepticum of Frog (Rana spp)[J].China Fisheries,2012(5):51-52(mChmese)
[10]汪建国两栖爬行类疾病及其防治技术(1)[J]渔业致富指南,2016(21):61 66
WANG J G Dlsease and comrol teclmiques of alllphiblanreptlles(1)[J].Fishery Guide to be Rich,2016(21):61-66(inChinese)
[11]李明,宋婷婷,郑荣泉,等棘胸蛙歪头病病原分离、鉴定与药敏实验[J]安徽农业科学,2016,44(3):64 66,98
LI M,SONG T T,ZHENG R Q,et al Isolatlon,identificatlon anddrug sensitivlty test of the。patllogen of Quasipaa spinosa[J].Journal,of Anhui Agri Sci.2016,44(3):64 66,98(in Chinese)
[12]秦振阳黑斑蛙“歪头病”病原菌的分离鉴定及全基因组测序分析[D]雅安:四川农业大学.2018
QIN Z Y Isolatlon,ldentmcatlon and whole—genome sequencinganalysis of Pelophylsa nigromaculatus roricollis dlsease[D].Ya'an:S1cuan ancuhure unlversity-2018
[13]刘晓琳,梅寒,卜令飞,等乌鳢伊丽莎白菌的分离鉴定及致病性研究[J]宁波大学学报(理工版)、2018、3l(2):1-7
LIU X L,MEI H,BU L F,et al Isolation and pathogenlcrvsnldy ofElizabthkingia sp.from Channa argus [J].Journal of NingboUniversity(Natural Science and Engineering Edition 2018.31(2):1-7(in Chinese)
[14]蔡完其,孙佩芳,朱泽闻,等中华鳖脑膜炎败血性黄杆菌病的研究[J]水产科技情报,1997,24(4):156-161
CAI W Q,SUN P F,ZHU Z W,et al Study on Flavobacteriummemingoseptium disease in the softshelled turtle(Trionyssinensis)[J].Fisheries Science&Technology)Information,199724(4) 156-16l(in Chinese)
[15]周煜华,何成伟黄鳝鱼脑膜炎脓毒性黄杆菌的分离与鉴定[J].广西畜牧兽医,1998,l4(3):5-7
ZHOU Y H.HE C W Isolation and identificatlon of Flavobacterinm,meninggoseptium [J],Guangxi journal of Animal Husbandry&Veterinary Medicine.1998.14(3): 5-7(in Chinese)
[16]黄志坚,何建国,翁少萍,等鳜鱼细菌性病原的分离、鉴定及致病性初步研究[J]微生物学通报,l999,26(4):24-246
HUANG Z J,HE J G,WENG S P,et al The isolatlon and plellmm8ryidentmcatlon of pathogenlc bacteria flom the dlseased mande11nfish [J] Microbiology, 1999. 26 (4): 241-246.( in Chinese)
[17]邸军,张书环,黄君,等中华鲟脑膜败血伊丽莎白菌的分离鉴定及药敏特性[J].水产学报,2018.42 (1):120-130
DI J ZHANG S H HUANG J. et al Isolation. identification andantibiotic sensitivity of Eli:abethkingia meningoseptica from Chinesesturgeon(Acipenser sinensis) [J] Journal of Fisheries of China. 2018,42(1):120-130 (in Chinese)
[18] BERNARDET J F,VANCANNEYT M. MATTE-TAILLIEZ o, et alPolyphasic study of Chryseobacterium strains isolated from diseasedaquatic animals [J].Sys App Mic. 2005. 28(7):640-660
[19]錢冬,陈月英,沈锦玉,等应用酶联免疫吸附法检测爆发病病原嗜水气单胞菌的研究[J]水产养殖,1993 (4):14-17
QIAN D. CHEN Y Y. SHEN J Y. et al Study on detection ofAeromonas hydrophila by ELISA [J] Journal of Aquaculture.1993 (4): 14-17. (in Chinese)
[20] HOLT JG,KRJEGNR,SNEATH PHA. et al Bergeys manual ofdetenninative bacteriology[M] 9th edition Williauns and WilkinsPublishers. Baltiinore. MD. 1994
[21]王军,鄢庆枇,苏永全,等养殖大黄鱼副溶向弧菌的酶联免疫吸附法研究[J]台湾海峡,2001. 20 (3):346350
WANG J, YAN Q P,SU Y Q,et al Study on indirect ELISA niethodfor detecting Vibrio parahaemolvtious in cultured Pseudosciaenacroceo [J]Journal of Oceonograpby In Taiwan Strait. 2001.20 (3): 346350 (in Chinese)
[22]鄢庆枇,苏永全,王军,等用LPS抗血清进行溶藻弧菌间接ELISA检测[J]青岛海洋大学学报,2002. 32: 267-271
YAN Q P,SU Y Q,WANG J, et al_ Indirect ELISA for detection ofVibrio alginolyticus with LPS antiserum [J]. Journal of OceanUniversity of Qingdao. 2002. 32: 26727l(in Chinese)
[23]吴斌豚鼠气单胞菌快速检测间接ELISA法的建立[J].福建水产,
2006. 4 (4):48-51
WU B Indirect enzyiue-linked immunosorbent assay(ELISA) forrapid detection of Aeromonas coviae [Jl Journal of Fujian Fisheries.2006. 4 (4): 4851 (in Chuiese)
[24]樊景风,粱玉波,朱立超,等凡纳滨对虾红体病病原菌间接ELISA快速检测方法的研究[J]水产学报、2006.30 (1):113-117
FAN J F,LIANG L B,SONG L C,et al Indirect ELISA method fordetecting the pathogenic bacteria of Litopenaeus vannamei red bodydisease [J] Journal of Fisheries of China. 2006. 30(1):113-117. (in Chinese)
[25]邹玉霞,莫照兰,高光,等间接ELISA技术在病原性鳗弧菌SMPI快速检测中的应用[J].海洋科学,2007. 31 (6):75-78
ZOUY X. MO Z L,GAO G, et al Use of indirect ELISA to detectpathogenic bacteriiun Vibrio anguillarum SMP [J] Marine Sciences.2007. 31 (6): 7578. (in Chinese)
[26]白方方,兰建新,王燕,等迟缓爱德华氏菌间接ELISA快速检测法[J]中国水产科学,2009. 16(4):619625
BAI F F,LAN J X,WANG Y,et al_Indirect enzvme-linkedimmunosorbent assay (ELISA) for rapid detection of Edwardsiellatarda [J]. Journal of Fishery Sciences of China. 2009. 16 (4):619625. (in Chinese)
[27]夏君,吴志新,张鹏,等柱状黄杆菌间接ELISA快速检测方法的研究[J]淡水渔业,2009. 39 (2):06570
XIA J. WU Z X ZHANG P.et al_Indirect ELISA method fordetecting Flavobocterium columnoris [J] Freshivater Fisheries. 2009.39(2)06570. (in Chinese)
[28]朱岩松,王秀华,韩雯,等5株鲆鲽鱼类病原菌多兜隆抗体的制各与应用[J]渔业科学进展,2013. 34 (3):68-74
ZHU Y S,WANG X H. HAN W. et al Preparation and application ofpathogenic bacteria polyclonal antibodies against five isolated fromflounder EJl Progress in Fisherv Sciences. 2013. 34(3):6874( in Chinese)
[29]劉小平,樊尚荣,陈晓明,等荧光标记MOMP抗体检洲沙眼衣原体方法及性能评价[J].标记免疫分析与临床,2019. 26 (5):858862
LIUX P,FAN S R,CHENX M. et al_ The detection of ChlamvdiaTrachomatis by fluorescein isothiocyanate labeled MOMP antibodyand its perfomance evaluation [J]. Labeled Immunoassavs andClinical Medicine. 2019. 26(5)858862.( in Chinese)
[30]张雪梅,胡志宇异硫氰酸荧光素在荧光标记领域的应用[J]昆明学院学报,2015. 37 (6):5659
ZHANG X M. HU Z Y. Application of flourescein isothiocvanate inthe field of fluorescent labeling [J] Journal of Kunming University,.2015. 37 (6): 5659. (in Chinese)
[31]方珍,鞠文,秦亚楠,等大肠杆菌0157:H7异硫氰酸荧光素标记抗体的制备及评价[J]吉林大学学报(医学版),2019. 39 (1):165169
FANG Z, JU W. QIN Y N. et al Preparation and evaluation of FITClabeled Escherichia coli01 57:H7 polyclonal antibody [J] Journal ofJilin University: Medicine Edition. 2019. 39(1):165-169(inChinese)
[32]朱明,仁,朱瑞良,王慧,等鸡奇异变形杆菌外膜蛋白的抗血清制备及其荧光标记抗体检测方法的建立[J]中国预防兽医学报,2010.32 (8):603606
ZHU M H. ZHU R L,WANG H. et al Establishment of directimmunofluorescent assav for detection of Proteus mirabilis inchicken [J] Chinese Journal of Preventive Veterinory Medicine.2010. 32(8):603-606 (in Chinese)
[33]于新和,陶海静,杜桂欣,等用链球菌自制荧光抗体检测猪链球菌的研究[J]中国预防兽医学报,2004. 26 (6):462-464
YUXH,TAOH J,DUG X. et al Studvon diagnosis S.Suis infectionwith self-preparation immuno- fluorescence antibody[J]. ChineseJournal of Preventive Veterinary Medicine. 2004. 26(6):462-464( in Chinese)
[34]权中会,王小平,惠临风,等猪瘟荧光抗体的制备及应用[J].中围兽医科技,2004. 34 (3):39-41
QUAN Z H. WANG X P,HUI L F,et al Preparation and applicationof fluorescent antibodv against classical swine fever [J] Chineseournal of Veterinary Science and Technology. 2004. 34 (3):39-41. (in Chinese)
[35]尹秀云,陈建魁,张鹏,等脑膜脓毒性金黄杆菌所致舌黏膜感染1例报道[J]中华医院感染学杂志,2004 (11):118-119
YIN X Y. CHEN J K. ZHANG P, et al A case report of tonguemucosa infection caused by chrysobacterium menzngosepticum [J]Chinese Journal of Nosoconmiolog. 2004(11):118-119.( inChinese)
[36]申桂娟,祝进,王李华,等脑膜脓毒性金黄杆菌医院感染危险因素及耐药性分析[J]中华医院感染学杂志、2003 (2):85-87
SHEN G J,ZHU J, WANG L H. et al_Nosocomial infection bvChrvseobacterium meningosepticum: risk factors and drug-resistance [J]. Chinese Journal of Nosoconmiology. 2003 (2):85-87. (in Chinese)
(责任编辑:林海清)
收稿日期:2021-04-15初稿;2021-0531修改稿
作者简介:张新艳( 1980-),女,硕士,高级工程师,研究方向:水产养殖动物病害(E-mail: swallowz47@163.com)
通信作者:曾占壮( 1972-),男,硕士,副研究员,研究方向:水产养殖动物病害(E-mail: zengzhanzhuang@126.com)
基金项目:福建省科技计划公益类专项(2019Rl014-5):福建省海洋与渔业结构调整專项(闽财指[2017]1177号、闽财指[2018]829号)

