中低温成矿流体中氯配合物和硫氢配合物在铜金属迁移中的行为
周冠轩, 王英滨*, 黄 靖, 张德会
中低温成矿流体中氯配合物和硫氢配合物在铜金属迁移中的行为
周冠轩1, 王英滨1*, 黄 靖1, 张德会2
(1. 中国地质大学(北京) 数理学院, 北京 100083; 2. 中国地质大学(北京) 地球科学与资源学院, 北京 100083)
热液成矿系统是世界上最主要的金属矿物来源, 其中的S和Cl是流体中最为重要的两种配体, 对地壳内金属在流体中的迁移起到重要作用。在中低温(25~300 ℃)的温度范围下, 根据最新的可用热力学性质, 利用地球化学模拟软件GWB (Geochemist’s Workbench), 对Cu-Fe-NaCl-H2O-S体系进行了地球化学模拟, 比较了氯配合物和硫氢配合物在Cu金属迁移当中的作用。模拟流体的各组分浓度均以天然热液的流体范围相当, 该模型解释了热液中Cu对于S和Cl的配合模式。在较低的温度下, 硫氢配合物是体系中主要的Cu迁移物种, 但这种优势也与所处的pH值和氧化还原环境关系密切。而较高温度下则主要为氯配合物形态进行迁移。作为硫氢配合物或氯配合物的输送则决定了金属富集的模式, 该模型可用于参考评估自然界中的热液流体成矿过程。
成矿流体; 铜; 热力学; 地球化学模拟
0 引 言
热液成矿系统是世界最主要的金属来源, 成矿元素通过对源区的萃取、迁移和沉淀在热液系统中富集[1–4]。1977年首次发现了海底排出的热液[5]。从那时起, 大量的关于热液流体的研究开始进行, 而现在水热溶液在各类金属矿床的形成中起到的重要作用已经得到了广泛的认可。可以通过流体包裹体所显示的数据, 来描述在相对简单的H2O-NaCl-(CO2-H2S-CH4)体系中具有不同成矿温度和地质特征的沉积物的流体[6], 而在流体中的Cl和S元素则是被认为金属在其中进行迁移最重要的配体。
对成矿流体研究清楚的表明了它是含有简单Na离子和复杂分子种类的多组分电解质溶液, 元素在成矿流体中形成配合物的类型可以通过软硬酸碱理论进行解释, 这是影响配合物形式的内在原因[7]。作为配合物配体的碱的硬度, F−> OH−> Cl−> S2−> HS−, 具有体积较大的并且电荷较低特点的碱, 可以被相对较软的酸如亲硫元素(Cu、Ag和Au等)和过渡金属元素(Fe、Co、Ni、Pt和Pd等)极化; 而如亲石元素(K、Na、Ca和Mg等)及含氧酸元素(CO2和SO3等)的相对较硬的酸, 可以极化体积较小并具较高电荷特点的碱。成矿流体是多组分电解质溶液, 其中NaCl通常是主要的盐组分。成矿流体中大量电解质盐与成矿流体系统中的许多过渡金属元素的配合在迁移/沉积中起到重要作用[8], 而近年来的实验研究也对Cl元素[9–11]和S元素[12–13]在金属(Cu、Pb和Zn等)中的迁移、矿化的重要性有了共识。流体中的卤素元素对金属元素的溶解、活化和迁移具有重要的作用, 而其中的盐度、温度、酸碱度和氧化还原的特性都会对其中金属离子的活化、迁移和富集等产生重要的影响。
使用数值模拟技术模拟自然环境中发生的地球化学过程已成为一种标准技术, 化学热力学一直应用于地球化学的分析和建模, 程序中提供的数据库包含许多水性物种, 其热力学参数通过拟合经验数据或通过预测的方法得出。
本文拟主要根据现有的化学热力学性质, 应用地球化学模拟软件GWB (Geochemist’s Workbench), 对Cu在不同水热流体体系的中低温热液条件下具有不同物理化学条件的流体进行模拟。设定在中低温的温度范围(25~300 ℃)内, 探讨Cu在不同水热条件下主要存在形态以及水热溶液当中Cu配合物的浓度变化, 以期为预测热液成矿过程提供依据。
1 方法与模拟过程
应用GWB软件模拟成矿流体在热力学平衡下的化学反应。GWB是最为重要的地球化学模拟软件, 由美国Aqueous Solutions LLC公司开发, 广泛应用在环境地球化学、油气地球化学以及矿床地球化学等领域。运用计算机模拟众多的复杂地球化学反应过程, 通过量化模型来了解沉积成岩和热液变化、开发探明矿床、确定污染物迁移规律、预测矿床和油藏物质演化。GWB模拟软件有三个版本, 即GWB Essentials、GWB Standard和GWB Professional, 本研究使用的是GWB Professional 11.0 版本。使用软件模拟更加适用于难以通过实验分析得到结果的领域, 但模拟需要建立在完善的热力学数据的基础上, 需要较为准确的热力学数据才能得到更加准确的结果; 同时, GWB的通用热力学参数在0~300 ℃和有限的压力条件, 有一定的局限性。
Cl离子(Cl−)和硫氢根离子(HS−)是Cu在水热流体当中最重要的配体, 本研究的主要目的是依据已有的热力学数据, 模拟Cu在中低温范围的成矿流体中, 主要物种形态以及Cu配合物浓度受不同条件的影响变化。
Cu在天然流体中以两种氧化态存在, 预测Cu(Ⅰ)配合物在流体中的迁移过程中占据主导地位[14–15]。为了探讨中低温成矿流体中氯配合物和硫氢配合物在铜金属迁移中的行为, 所使用的的热力学数据, 在劳伦斯利弗莫尔国家实验室(LLNL)默认数据库的基础上, 选择最新的热力学数据: Cu(Ⅰ)的氯配合物[16]、Cu(Ⅱ)的氯配合物[17]、以及Cu(Ⅰ)的硫氢配合物[18–19]将其添加至GWB模拟软件当中。选择成矿流体的特征数据[20–21], 使用GWB软件进行模拟, 结果见表1。
2 结果与讨论
2.1 中低温盐水热液的主要形态
热液成矿流体是多组分的电解质溶液, 氯化钠是热液成矿流体中普遍存在且最主要的盐组分, 许多元素的稳定氯配合物通过流体迁移到整个地壳, 并随着迁移过程中的理化性质变化而沉淀, 对这些元素的迁移并形成矿床起到重要作用, 因此本文首先对最简单的NaCl-H2O水热条件下的流体进行模拟, 构建Eh-pH图以证明在低盐度的水热条件下主要的Cu形态和矿物质随温度的变化(图1)。其中含水物质的活度为:Cu=1×10−5mol/L;Na=Cl=0.6 mol/L。
从图1中可以看出, 在氧化条件下, Cu均以Cu(Ⅱ)与Cl−和OH−形成配合物; 低温条件下, pH > 6, 开始产生黑铜矿(CuO)沉淀, 随着温度的升高, 生成沉淀的pH值由6升至11; [CuCl2]−则是主要在还原环境中存在, 在100 ℃以上占据优势, 随着温度的升高, 优势区域所占pH值范围变大; pH > 8时有赤铜矿(Cu2O)的沉淀生成, 随着温度的升高, 生成沉淀的pH值由8升至接近12。可以得出, 温度的升高更加促进Cu在成矿流体中的迁移, 而pH值的升高则更加利于Cu在流体中的沉淀, 氧逸度则是影响Cu在成矿流体中的价态, 从而影响Cu在成矿流体中的存在形式。因为Cu配合物的稳定常数的温度依赖性导致在冷却的热液中, 氯配合物物的稳定性急剧下降, 会发生氯配合铜的极其有效的沉积, 特别是如果水岩相互作用, 导致pH同时增加。
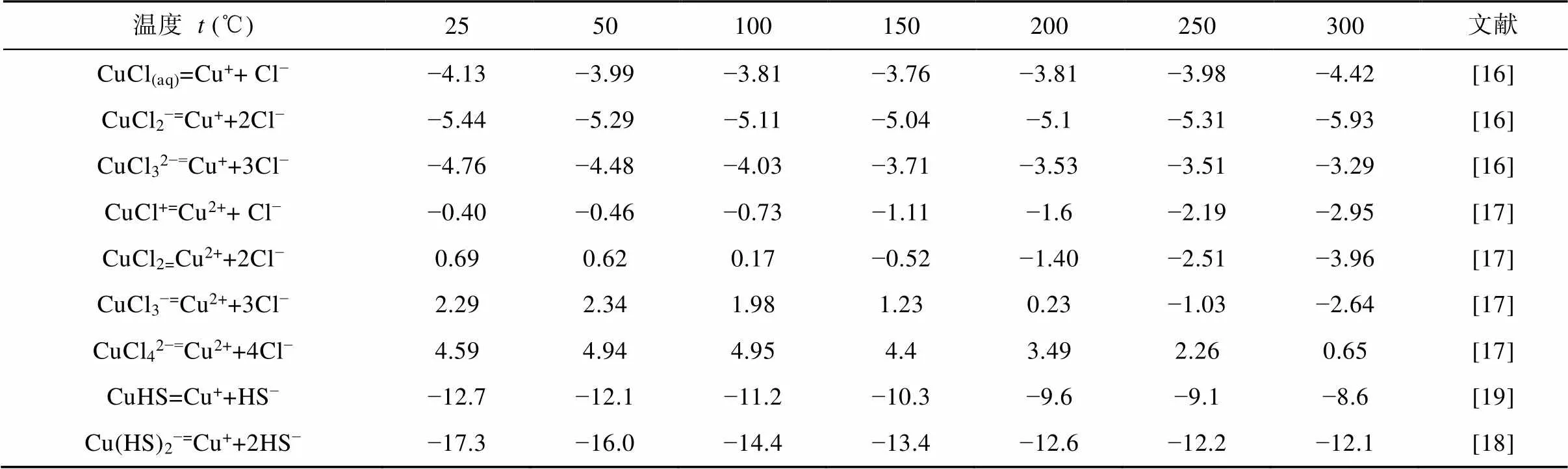
表1 相关铜配合物的logk
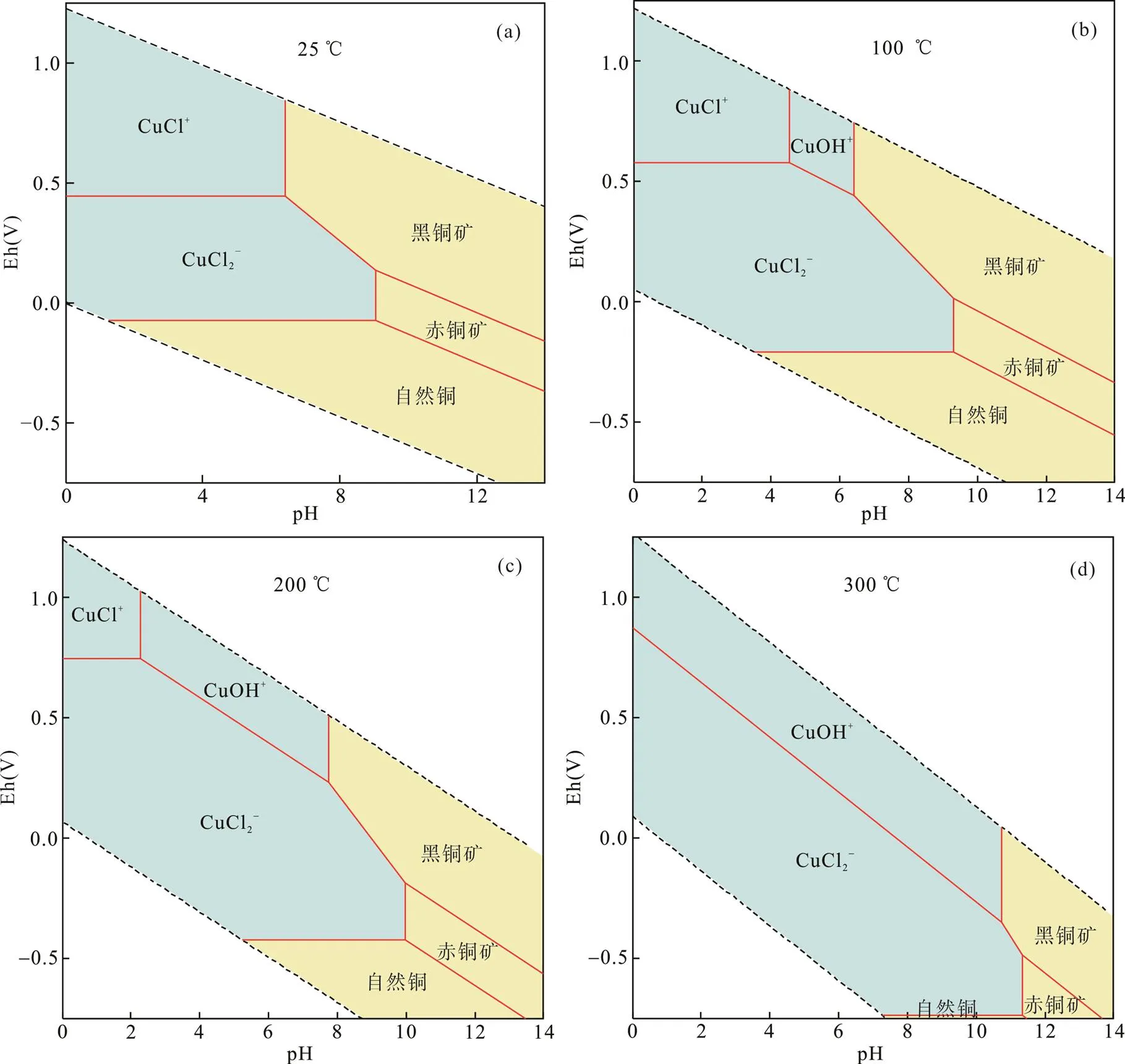
图1 低盐度下主要Cu形态的Eh-pH图
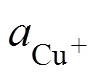
从图2可以看出, 在室温状态的还原条件下, 低盐度环境中以[CuCl2]−为主要的存在形式, 而[CuCl3]2−则在高盐度环境中占据优势。也有计算表明, 主要存在的配合物的pH值范围由0~9扩大到0~11, 随着pH的再升高, 会有赤铜矿沉淀生成; 在氧化环境中, [CuCl]+主要在pH=0~7范围内存在, pH > 7开始沉淀黑铜矿; 在300 ℃和低盐度的还原态下, 仍是[CuCl2]−在体系中占优势, 而在氧化态中以[CuOH]+为体系的主要存在物种; 在高盐度环境中, 在pH=0~2的高氧逸度环境中, CuCl2为体系内的主要存在形态; pH=2~10, [CuOH]+在体系内占据优势。pH > 10开始沉淀出黑铜矿。而其他条件下, 均以[CuCl2]−为该环境的主要Cu形态。
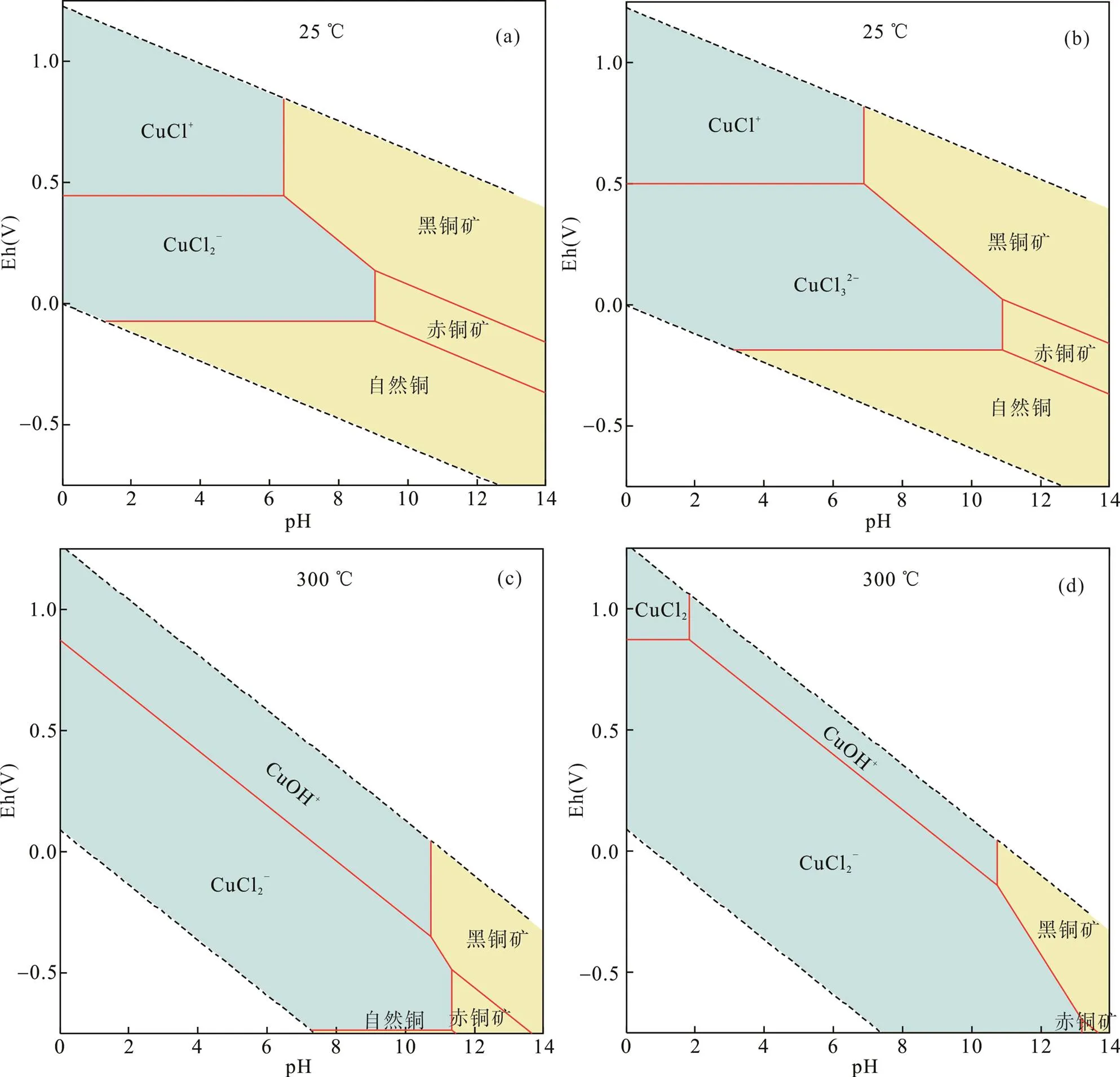
图2 不同盐度环境下主要Cu形态的Eh-pH图
2.2 中低温含硫热液的主要物种
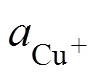

2.3 Cu在流体中存在形式随氯离子和硫化氢浓度的变化
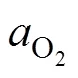

图3 含硫热液中主要Cu形态的Eh-pH图
Fig.3 Eh-pH diagram of the main Cu form in sulfur-containing hydrothermal fluid
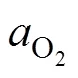
2.4 影响Cu配合物浓度变化的因素
2.4.1 温度对Cu配合物浓度的影响
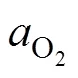

图4 Cu在一定范围的Cl−和H2S(aq)活度下的主要存在形态
从图5中可以看出, [Cu(HS)2]−在低温下占据明显的优势, 为体系当中的主要成分。随着温度的升高, [CuCl2]−和[CuCl3]2−的浓度有着明显的上升, 在250 ℃后浓度高于[Cu(HS)2]−。温度从25 ℃变化到300 ℃, [CuCl2]−的浓度变化达到8个数量级, [CuCl3]2−的浓度变化约为6个数量级, 说明Cu的氯配合物受温度影响较大。Cu在低温的成矿流体中主要以硫氢配合物的形式进行迁移, 随着温度的升高, 更多以氯配合物的形式进行迁移。
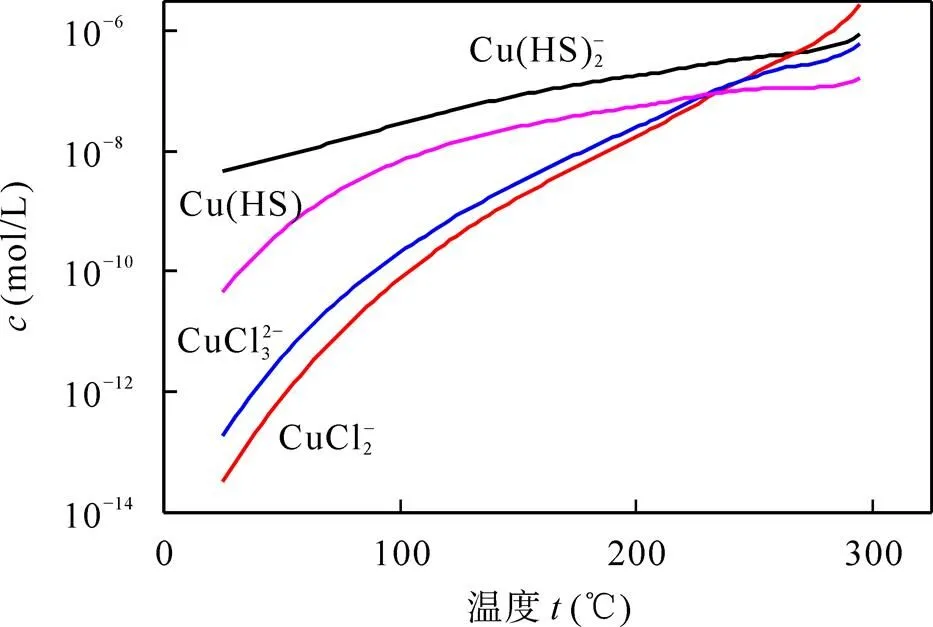
图5 Cu配合物浓度随温度的变化
2.4.2 氧逸度对Cu配合物浓度的影响
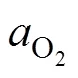
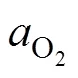
2.4.3 pH值对Cu配合物浓度的影响
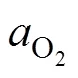
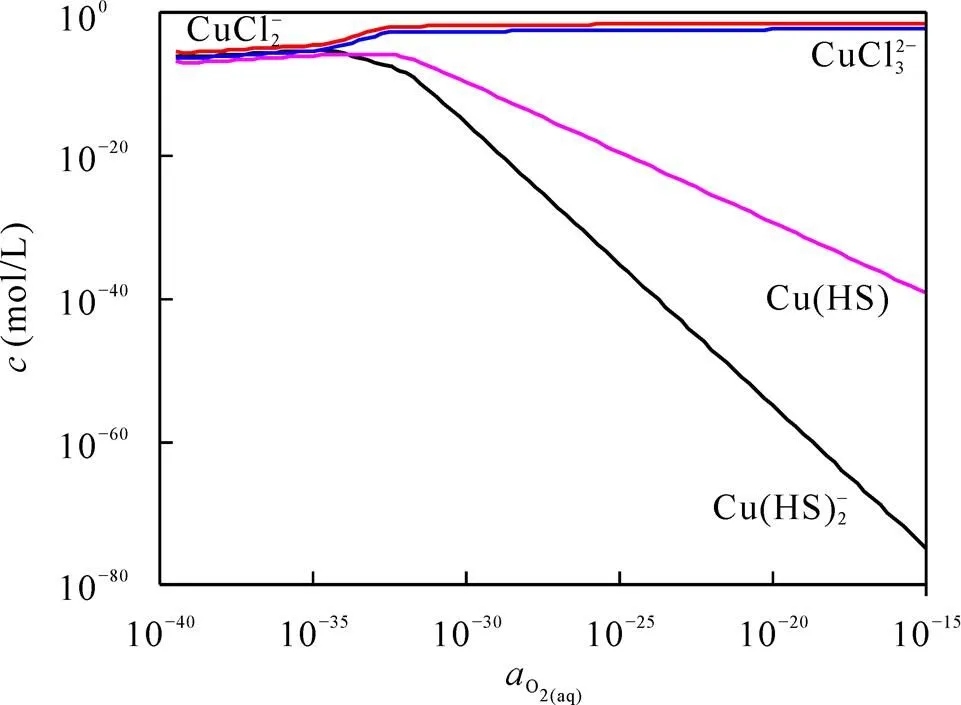
图6 Cu配合物浓度随氧逸度的变化
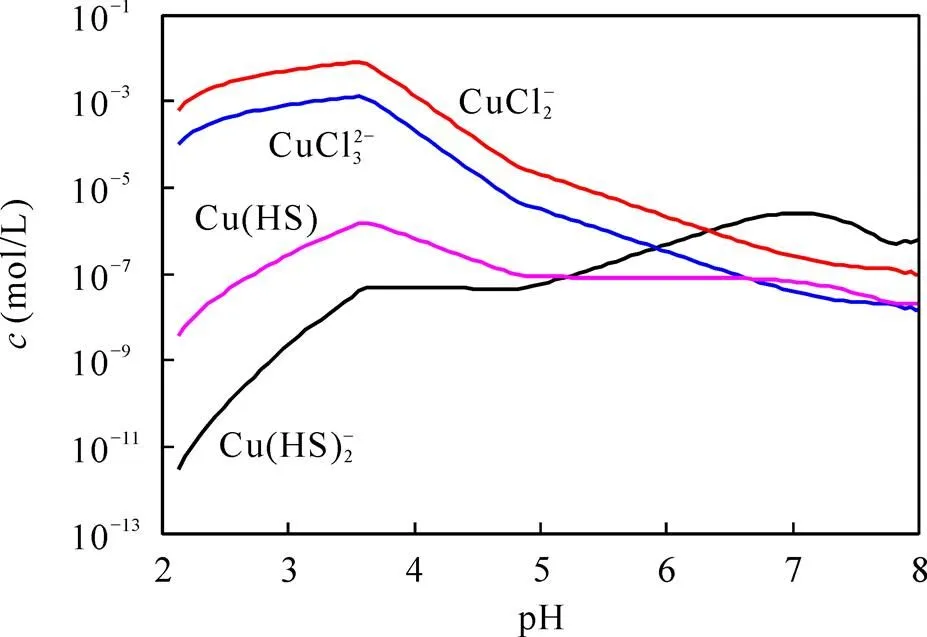
图7 Cu配合物浓度随pH值的变化
从图7中可以看出, 随着pH值的升高, 体系内整体Cu配合物浓度均有所升高, 推测一定的酸浓度利于Cu的矿物在体系内的溶解, 与配离子形成配合物; 在pH > 4时, [CuCl2]−和[CuCl3]2−浓度开始出现下降, [Cu(HS)2]−浓度基本保持不变, 随着pH值的增大, 当pH > 5时, [Cu(HS)2]−的浓度开始逐渐升高并占据优势, 与pH=2的环境下[Cu(HS)2]−的浓度相差8个数量级。可以看出酸性pH的环境可以促进Cu矿物在成矿流体当中的溶解, 而pH的升高则有利于Cu形成[Cu(HS)2]−配合物。
2.4.4 氯离子浓度对Cu配合物浓度的影响
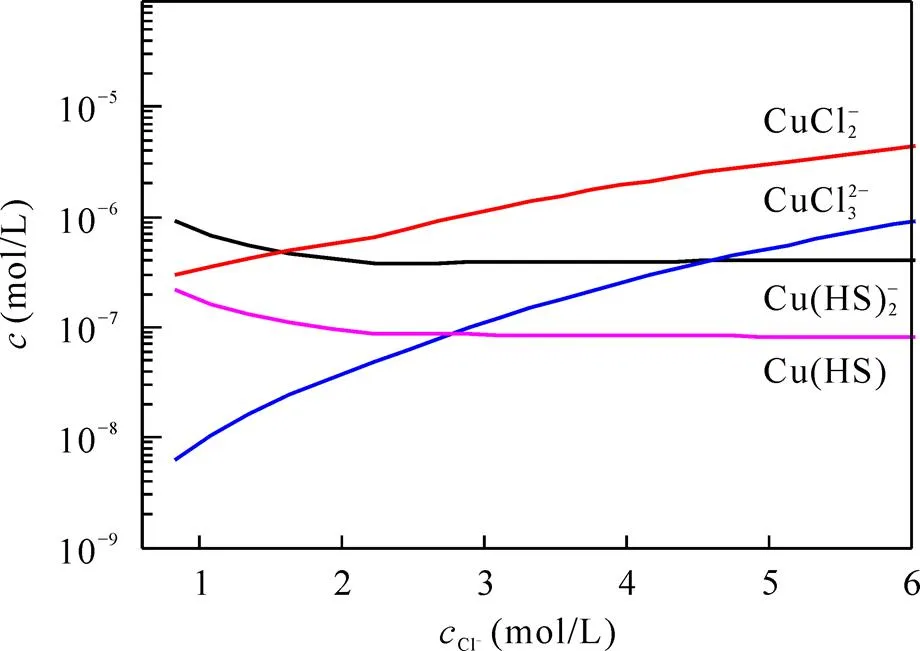
图8 Cu配合物浓度随氯离子浓度的变化
从图8中可以看到, 氯离子浓度较低时, [Cu(HS)2]−为体系内的主要配合物, 随着氯离子浓度从0.6 mol/L升至约1.5 mol/L, Cu的硫氢配合物的浓度缓慢下降, 氯配合物的浓度逐步上升; 在氯离子浓度超过2 mol/L时, [CuCl2]−成为水热溶液中的优势物种; 氯离子浓度的变化对氯配合物的影响则更大, [CuCl2]−增长了1个数量级, 而[CuCl3]2−浓度升高了2个数量级, 硫氢配合物的浓度变化较小。
2.4.5 H2S活度对Cu配合物浓度的影响
从图9中可以看出H2S活度变化对体系氯配合物几乎无影响, 而硫氢配合物的浓度则随着H2S活度的增加得到增长, 在H2S(aq)活度约为0.02 mol/L时[Cu(HS)2]−的浓度高于[CuCl2]−。[Cu(HS)2]−的浓度变化约为1个数量级。而将图8和图9综合解读, 可以得到氯离子是在成矿流体当中主要控制Cu迁移的配体, 而HS−配体虽然不能达到氯离子的影响, 但它足以在异常铜矿化的形成当中发挥重要的作用。
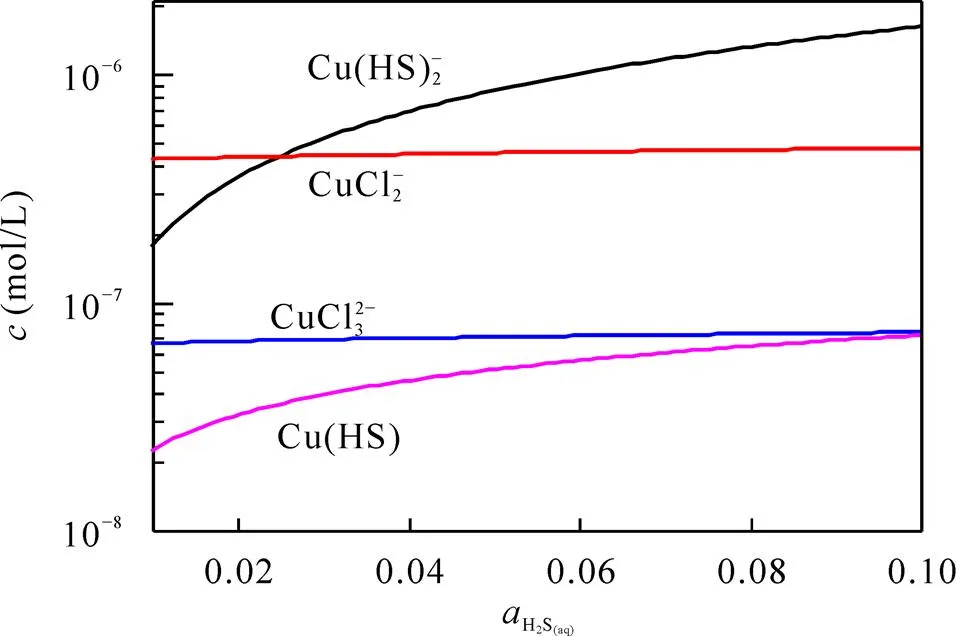
图9 Cu配合物浓度随H2S活度的变化
3 与天然流体中金属浓度变化的比较
为了检查模拟的准确性, 将模型流体和天然流体的Cu浓度与温度和盐度的变化趋势进行了比较; 天然流体数据使用文献中LA-ICP-MS获得的单个流体包裹体中的金属浓度[26–30]; 这些天然流体的Cu浓度与温度、盐度关系的散点图分别绘制在图10和图11中。
从图10看出, 从同一地区获得的流体包裹体中Cu的浓度与温度的变化呈现正相关关系的趋势, 这种现象也与本文中模拟的结果一致, 但也会出现一些不太符合趋势的点, 这与流体当中存在的盐度影响有关; 但不同地区获得的流体包裹体数据随温度变化关系并不明显, 这可能与流体当中存在的其他元素对Cu浓度的影响有关。
同样, 从图11中可以得到, 同一地区中获得的流体包裹体数据显示, 随着盐度的升高, 整体Cu的浓度变化也出现了升高的趋势, 这与模拟结果一致; 但不同地区中Cu浓度之间比较, 并不会出现非常明显浓度趋势, 这同样也与矿区类型、一起流体当中存在的其他元素对Cu浓度造成的影响有关。
4 Cu与两种配体的配合形式
氯离子和硫氢根离子被认为是控制成矿流体中铜迁移最重要的配体。铜在自然界以两种氧化态的形式存在, 即Cu(Ⅰ)和Cu(Ⅱ)。Cu(Ⅰ)是地壳流体当中最为常见的Cu氧化态, Cu(Ⅰ)的100型电子构型使其具有独特的性质, Cu(Ⅰ)可以形成线性、三角形或四面体结构配合物, 由于它们之间能级相差很低,使得它们可以在配合物的混合物中共存。在室温下, Cu(Ⅰ)离子不稳定, 但可以形成含水配合物稳定Cu(Ⅰ)的氧化态, 含水Cu(Ⅰ)具有线性的结构[H2O-Cu-OH2]+ [31]。Cu(Ⅰ)可以与配体形成稳定的配合物, 这些配合物根据配体类型和浓度的不同显示出不同的几何形状。在低盐度溶液中, Cu(Ⅰ)保留原有的线性结构(如, [H2O-Cu-Cl](aq), [Cl-Cu-Cl]−)[32]; 而在高盐度溶液中, 具有三角平面结构的[CuCl3]2−变得稳定[33]。随着温度的升高, 线性[CuCl2]−即使在高盐度下也占据主导地位[34]。这是由于温度和盐度是影响金属络合物配位变化的两个关键因素, 温度的升高则改变了水和氢键的网络结构, 从而改变了金属离子的溶剂化性质和络合物的几何形状。此外Cu对Cl具有很高的亲和力, 这可以通过软硬酸解理论解释。Cu(Ⅱ)需要在近地表的高度氧化条件环境中才能产生, 而Cu(Ⅱ)的水合离子是可溶的, 与氯离子的络合会发生在很高盐度的条件下。Cu(Ⅱ)的配位化学以强的杨-特勒效应为主, 导致配合物以多几何形式排列。

图10 天然流体中Cu浓度与温度关系的散点图
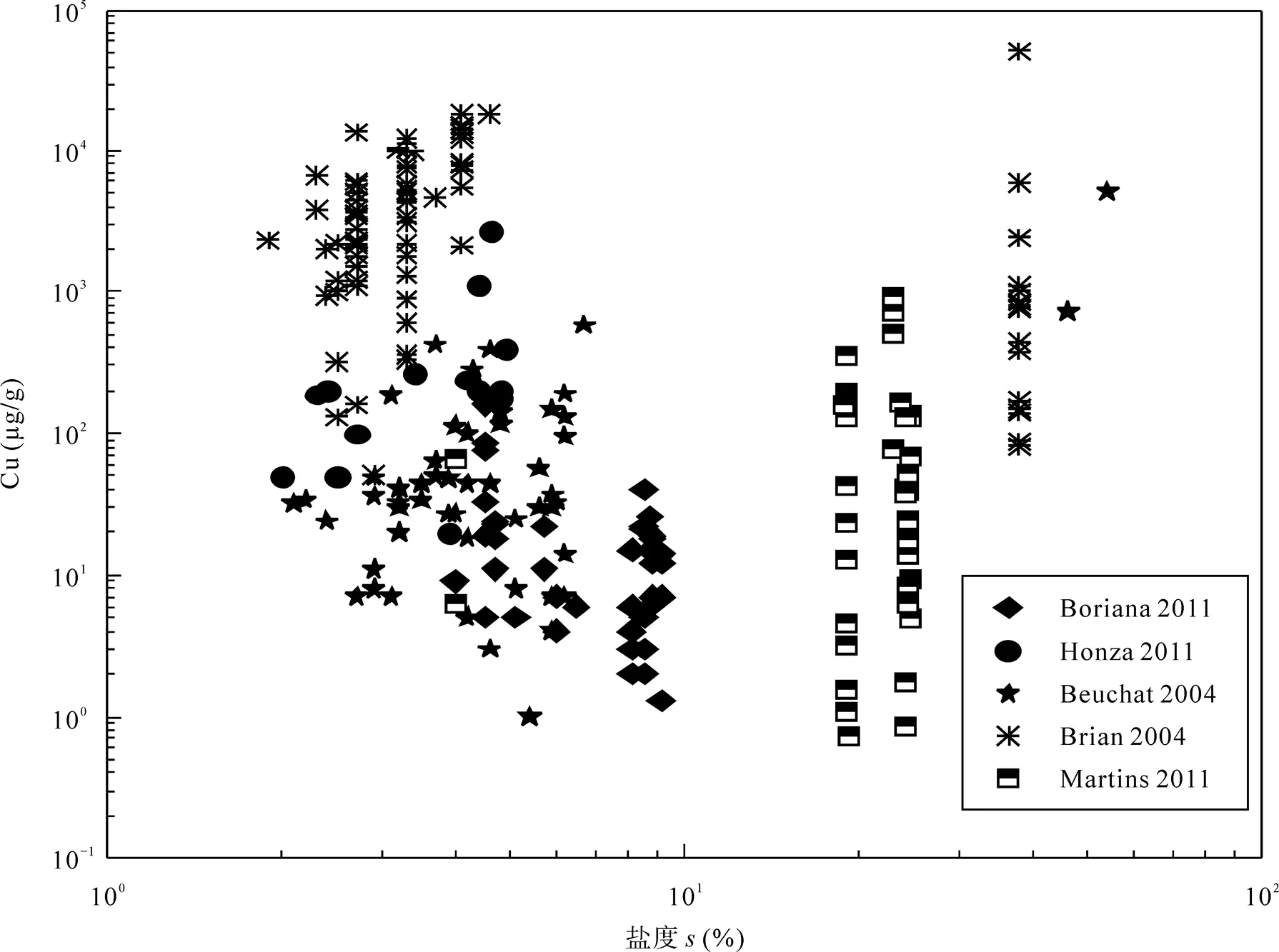
图11 天然流体中Cu浓度与盐度关系的散点图
Cu(Ⅰ)被归类为路易斯酸, 可以与HS−形成强键。与氯配合物类似, Cu(Ⅰ)硫氢配合物在整个的模拟条件下具有线性的几何形状[35]。但可以发现硫氢化铜配合物的稳定性要比氯化铜配合物的稳定性高出几个数量级, 但两者的温度依赖性有显著的不同。在冷却的热液成矿流体中, 氯配合物的稳定性急剧下降, 会发生Cu的有效沉积。相反, 硫氢配合物的稳定性随着温度的降低而增加, 并且随着pH的升高, 可以增加Cu的硫氢配合物的在体系内的浓度。
5 结 论
本研究基于检索到的文献实验数据和可用的热力学数据, 使用地球化学模拟软件GWB模拟在地壳上金属Cu在热液成矿流体中迁移行为。模拟结果表明了成矿流体模型在所处环境下携带金属迁移的能力。对于氯配合物来说则是在酸性的高温条件下主要以[CuCl2]−进行迁移, 盐度对氯配合物的浓度产生影响, 在高的盐度、较低的温度环境下则主要以[CuCl3]2−进行迁移。硫氢配合物在较低温度的还原及碱性环境下发挥关键作用, 使Cu主要以[Cu(HS)2]−形式在成矿流体当中迁移, 其中盐度显著影响了硫氢配合物的优势浓度范围; 而氧逸度的升高, 即是流体越接近地表, 则主要以CuSO4和[CuCl2]−的方式进行迁移。模拟的Cu流体模型可与天然地质流体模型比较, 对同一矿区呈现比较一致的变化趋势, 但对于不矿区获得的数据, 与模拟结果产生一定差异, 这也与不同矿区中的元素组成有关。该模型流体可以用于预测热液成矿的过程中Cu在流体当中的迁移方式。
[1] 胡瑞忠, 温汉捷, 苏文超, 彭建堂, 毕献武, 陈佑纬. 矿床地球化学近十年若干研究进展[J]. 矿物岩石地球化学通报, 2014, 33(2): 127–144.
Hu Rui-zhong, Wen Han-jie, Su Wen-chao, Peng Jian-tang, Bi Xian-wu, Chen You-wei. Some advances in ore deposit geochemistry in last decade[J]. Bull Mineral Petrol Geochem, 2014, 33(2): 127–144 (in Chinese with English abstract).
[2] 陈毓川, 裴荣富, 王登红, 王平安. 论矿床的自然分类——四论矿床的成矿系列问题[J]. 矿床地质, 2015, 34(6): 1092– 1106.
Chen Yu-chuan, Pei Rong-fu, Wang Deng-hong, Wang Ping-An. Natural classification of mineral deposits: Discussion on minerogenetic series of mineral deposits (Ⅳ)[J]. Mineral Deposits, 2015, 34(6): 1092–1106 (in Chinese with English abstract).
[3] 翟裕生. 试论矿床成因的基本模型[J]. 地学前缘, 2014, 21(1): 1–8.
Zhai Yu-sheng. A preliminary discussion on fundamental model of metallogenic mechanism[J]. Earth Sci Front, 2014, 21(1): 1–8 (in Chinese with English abstract).
[4] 邓军, 高帮飞, 王庆飞, 杨立强. 成矿流体系统的形成与演化[J]. 地质科技情报, 2005, 24(1): 49–54.
Deng Jun, Gao Bang-fei, Wang Qing-fei, Yang Li-qiang. Formation and evolution of ore-forming fluid system[J]. Geol Sci Tech Inf, 2005, 24(1): 49–54 (in Chinese with English abstract).
[5] Weiss R F, Lonsdale P, Lupton J E, Bainbridge A E, Craig H. Hydrothermal plumes in the Galapagos Rift[J]. Nature, 1977, 267(5612): 600–603.
[6] 张文淮, 张志坚, 伍刚. 成矿流体及成矿机制[J]. 地学前缘, 1996, 13(4): 86–93.
Zhang Wen-huai, Zhang Zhi-jian, Wu Gang. Ore-forming fluid and mineralization mechanism[J]. Earth Sci Front, 1996, 13(4): 86–93.
[7] 张德会. 关于成矿流体地球化学研究的几个问题[J]. 地质地球化学, 1997, 25(3): 49–57.
Zhang De-hui. Some new advances in ore-forming fluid geochemistry[J]. Geol Geochem, 1997, 25(3): 49–57.
[8] 刘家军, 柳振江, 杨艳, 石龙, 赵百胜, 毛光剑, 王建平. 盐类在金属、非金属成矿过程中的作用[J]. 地质找矿论丛, 2007, 22(3): 161–171.
Liu Jia-jun, Liu Zhen-jiang, Yang Yan, Shi Long, Zhao Bai-sheng, Mao Guang-jian, Wang Jian-ping. The salt roles in the mineralizlng processes of metal and non-metal depostis[J]. Contrib Geol Mineral Resour Res, 2007, 22(3): 161–171.
[9] Lukanin O A, Ryzhenko B N, Kurovskaya N A. Zn and Pb solubility and speciation in aqueous chloride fluids at T-P parameters corresponding to granitoid magma degassing and crystallization[J]. Geochem Int, 2013, 51(10): 802–830.
[10] Borg S J, Liu W. An XAS study of zinc speciation in aqueous acetate solutions at 25–200℃[J]. Nucl Instrum Method Phys Res A, 2010, 619(1): 276–279.
[11] Mei Y, Liu W, Sherman D M, Brugger J. Metal complexation and ion hydration in low density hydrothermal fluids: Ab initio molecular dynamics simulation of Cu(I) and Au(I) in chloride solutions (25–1000℃, 1–5000bar)[J]. Geochimica et Cosmochimica Acta, 2014, 131: 196–212.
[12] Mei Y, Sherman D M, Liu W, Brugger J. Ab initio molecular dynamics simulation and free energy exploration of copper(I) complexation by chloride and bisulfide in hydrothermal fluids[J]. Geochimica et Cosmochimica Acta, 2013, 102: 45–64.
[13] Tagirov B R, Seward T M. Hydrosulfide/sulfide complexes of zinc to 250℃ and the thermodynamic properties of sphalerite[J]. Chemical Geology, 2010, 269(3): 301–311.
[14] Liu W, Mcphail D C. Thermodynamic properties of copper chloride complexes and copper transport in magmatic-hydrothermal solutions[J]. Chemical Geology, 2005, 221(1): 21–39.
[15] Nagaseki H, Hayashi K. Experimental study of the behavior of copper and zinc in a boiling hydrothermal system[J]. Geology, 2008, 36(1): 27–30.
[16] Brugger J, Etschmann B, Liu W, Testemale D, Hazemann J L, Emerich H, van Beek W, Proux O. An XAS study of the structure and thermodynamics of Cu(I) chloride complexes in brines up to high temperature (400℃, 600bar)[J]. Geochimica et Cosmochimica Acta, 2007, 71(20): 4920–4941.
[17] Sverjensky D A, Shock E L, Helgeson H C. Prediction of the thermodynamic properties of aqueous metal complexes to 1000℃ and 5 kb[J]. Geochimica Et Cosmochimica Acta. 1997, 61(7): 1359–1412.
[18] Mountain B W, Seward T M. Hydrosulfide/sulfide complexes of copper(I) : Experimental confirmation of the stoichiometry and stability of Cu(HS)2− to elevated temperatures[J]. Geochimica Et Cosmochimica Acta, 2003, 67(16): 3005–3014.
[19] Mountain B W, Seward T M. The hydrosulphide/sulphide complexes of copper(I): experimental determination of stoichiometry and stability at 22℃ and reassessment of high temperature data[J]. Geochimica et Cosmochimica Acta. 1999, 63(1): 11–29.
[20] Zhong R C, Brugger J, Chen Y J, Li W B. Contrasting regimes of Cu, Zn and Pb transport in ore-forming hydrothermal fluids[J]. Chemical Geology, 2015, 395: 154–164.
[21] Barnes S, Liu W. Pt and Pd mobility in hydrothermal fluids: evidence from komatiites and from thermodynamic modelling[J]. Ore Geology Reviews, 2012, 44(1): 49–58.
[22] 宋国学, 秦克章, 李光明, 王乐. 中硫型浅成低温热液金多金属矿床基本特征、研究进展与展望[J]. 岩石学报, 2018, 34(3): 748–762.
SONG Guo-xue, QIN Ke-zhang, LI Guang-ming, WANG Le, Basic characteristics and research progresses of intermediate sulfidation type epithermal gold poly-metallic deposits, and prospects[J]. Acta Petrologica Sinica.2018, 34(3): 748–762.
[23] 王小林. 压力和流体组分对硫酸盐——水体系高温液—液相分离的影响: 作用机制和地质意义[C]. 南昌: 2017.
WANG Xiao-lin. Effect of Pressure and Fluid Composition on Sulfate-Water System High Temperature Liquid-Liquid Phase Separation: Mechanism of Action and Geological Significance[C]. Nanchang, Jiangxi, China: 2017.
[24] 万良钦, 喻军敏, 杨永胜, 钟源. 浅成低温热液贵金属矿床成矿条件浅析[J]. 西部探矿工程, 2016, 28(9): 133–135.
WAN Liang-qin, Yu Jun-min, YANG Yong-sheng, ZHONG Yuan. Analysis on metallogenic conditions of epithermal depositsin epithermal deposits[J]. West-China Exploration Engineering, 2016, 28(09): 133–135.
[25] Seo J H, Guillong M, Heinrich C A. The role of sulfur in the formation of magmatic–hydrothermal copper–gold deposits[J]. Earth and Planetary Science Letters, 2009, 282(1): 323–328.
[26] Beuchat S, Moritz R, Pettke T. Fluid evolution in the W–Cu–Zn–Pb San Cristobal vein, Peru: fluid inclusion and stableisotope evidence[J]. Chemical Geology, 2004, 210(1): 201–224.
[27] Rusk B G, Reed M H, Dilles J H, Klemm L M, Heinrich C A. Compositions of magmatic hydrothermal fluids determined by LA-ICP-MS of fluid inclusions from the porphyry copper– molybdenum deposit at Butte, MT[J]. Chemical Geology, 2004, 210(1): 173–199.
[28] Kotzeva B G, Guillong M, Stefanova E, Piperov N B. LA-ICP-MS analysis of single fluid inclusions in a quartz crystal (Madan ore district, Bulgaria)[J]. Journal of Geochemical Exploration, 2011, 108(3): 163-175.
[29] Appold M S, Wenz Z J. Composition of Ore Fluid Inclusions from the Viburnum Trend, Southeast Missouri District, United States: Implications for Transport and Precipitation Mechanisms[J]. Economic Geology, 2011, 106(1): 55–78.
[30] Catchpole H, Kouzmanov K, Fontboté L, Guillong M, Heinrich C A. Fluid evolution in zoned Cordilleran polymetallic veins — Insights from microthermometry and LA-ICP-MS of fluid inclusions[J]. Chemical Geology, 2011, 281(3): 293–304.
[31] Blumberger J, Bernasconi L, Tavernelli I, Vuilleumier R, Sprik M. Electronic Structure and Solvation of Copper and Silver Ions: A Theoretical Picture of a Model Aqueous Redox Reaction[J]. Journal of the American Chemical Society, 2004, 126(12): 3928–3938.
[32] Liu W, Brugger J, Etschmann B, Testemale D, Hazemann J. The solubility of nantokite (CuCl(s)) and Cu speciation in low-density fluids near the critical isochore: An in-situ XAS study[J]. Geochimica et Cosmochimica Acta, 2008, 72(16): 4094–4106.
[33] Sherman D M. Complexation of Cu+ in Hydrothermal NaCl Brines: Ab initio molecular dynamics and energetics[J]. Geochimica et Cosmochimica Acta, 2007, 71(3): 714–722.
[34] Fulton J L, Hoffmann M M, Darab J G. An X-ray absorption fine structure study of copper(I) chloride coordination structure in water up to 325℃[J]. Chemical Physics Letters, 2000, 330(3): 300–308.
[35] Etschmann B E, Liu W, Testemale D, Müller H, Rae N A, Proux O, Hazemann J L, Brugger J. An in situ XAS study of copper(I) transport as hydrosulfide complexes in hydrothermal solutions (25–592 ℃, 180–600 bar): Speciation and solubility in vapor and liquid phases[J]. Geochim Cosmochim Acta, 2010, 74(16): 4723–4739.
Behavior of chlorine complexes and sulfur hydrogen complexes transport of copper in medium and low temperature in ore-forming fluids
ZHOU Guan-xuan1, WANG Ying-bin1*, HUANG Jing1and ZHANG De-hui2
1. School of Science, China University of Geosciences (Beijing), Beijing 100083, China; 2. School of Earth Sciences and Resources, China University of Geosciences (Beijing), Beijing 100083, China
Hydrothermal mineralization system is the world’s most important source of metal minerals. Sulfur and chlorine are the two most decisive ligands in the fluid, which play an important role in the migration of metals in the earth’s crust. Geochemical simulation of Cu-Fe-NaCl-H2O-S system bases on the latest available thermodynamic data using geochemical software The Geochemist’s Workbench at medium and low temperature (25 to 300 ℃) comparing the chlorine complexes and sulfur-hydrogen complexes in Cu metal migration. The concentration of each component of the simulated fluid is equivalent to the range of the fluid of the natural hydrothermal fluid. This model explains the mode of coordination of Cu for sulfur and chlorine in the hydrothermal fluid. At lower temperatures, the sulfur-hydrogen complex is the main Cu migration species in the system, but this advantage is also closely related to the pH and redox environment. At higher temperatures, migration occurs primarily in the form of chlorine complexes. The transport of sulfur-hydrogen complexes or chlorine complexes determines the mode of metal enrichment, which can be used as reference for the assessment of hydrothermal fluid mineralization processes in nature.
ore-forming fluid; copper; thermodynamics; geochemical model
P595
A
0379-1726(2021)04-0354-11
10.19700/j.0379-1726.2021.04.003
2019-09-02;
2019-10-28;
2019-11-11
国土资源部公益性行业科研专项(201411024-4)
周冠轩(1995–), 男, 硕士研究生, 化学工程专业。E-mail: 562425446@qq.com
WANG Ying-bin, E-mail: wyb@cugb.edu.cn; Tel: +86-13641309381

