海洋细菌Catenovulum sp.DP03两个右旋糖酐酶差异分析
田小鹏 ,邓 甜 ,董冬雪 ,祖航天 ,吕明生 *,3,王淑军 ,3
(1.江苏海洋大学 江苏省海洋生物资源与环境重点实验室,江苏 连云港222005;2.江苏海洋大学 江苏省海洋生物技术重点实验室,江苏 连云港222005;3.江苏海洋大学 江苏省海洋生物产业技术协同创新中心,江苏 连云港 222005)
右旋糖酐是一种以α-D-吡喃葡萄糖为单体,通过葡糖苷键链接而形成的多聚糖[1]。它是由某些细菌如肠膜明串珠菌(Leuconostoc mesenteroides)、荚膜醋酸菌(Acetobacter capsulatum)等发酵将蔗糖转化合成而得到的,主要以α-1,6-糖苷键链接,除此之外,一些支链还包含了α-1,3-糖苷键与α-1,4-糖苷键[2-3]。
右旋糖酐酶(EC3.2.1.11)是一类能够专一性降解右旋糖酐中α-1,6-糖苷键的糖苷水解酶,存在于糖苷水解酶(GH)家族49家族和66家族中,并且这两个家族序列间没有同源性[4-5]。一般根据催化位点不同将右旋糖酐酶分为内切型右旋糖酐酶(Endodextranase)以及外切型右旋糖酐酶(Exodextranase)[1]。外切型右旋糖酐酶主要切割右旋糖酐链的非还原端的α-1,6-糖苷键,产生葡萄糖。内切型右旋糖酐酶主要从右旋糖酐的内部切割α-1,6-糖苷键,产生葡萄糖、异麦芽糖以及一系列低聚异麦芽糖[1,6]。目前所报道的右旋糖酐酶主要为内切型右旋糖酐酶。绝大多数内切型右旋糖酐酶只有在具有多个连贯的α-1,6-糖苷键存在时才能发挥水解作用[7]。
右旋糖酐酶在食品、化工以及医药等领域都有着非常广泛的应用[8],且主要来源于微生物,其产生菌种类繁多,主要分为真菌类与细菌类[6]。真菌所产生的右旋糖酐酶活性较高,稳定性较好,被广泛应用于工业生产中[9]。但是,许多真菌如霉菌,除了少数已经通过食药安全认证外,绝大多数的霉菌在发酵过程中还会伴随着复杂的次级代谢产物的产生,因而存在安全隐患,从而限制了它们的应用,尤其是在医药、食品等领域[6,10]。相较于真菌,细菌的生长繁殖速度快,发酵时间短,产酶效率高。但是,来源于细菌的右旋糖酐酶普遍酶活较低,稳定性较差[6]。已有一些研究者将目光转向了海洋细菌,海洋环境孕育着丰富的微生物资源,由于海洋环境的特殊性,来源于海洋微生物的右旋糖酐酶通常具有耐盐、耐碱、耐低温等特性,在工业生产中有很大的应用前景[11-12]。
为了扩大海洋微生物右旋糖酐酶的应用价值,提高其利用率,作者以产右旋糖酐酶的海洋细菌Catenovulum sp.DP03为材料,完成了其全基因组测序,比较分析了来源于该菌株的两种右旋糖酐酶的性质及其水解右旋糖酐的产物,为海洋微生物的右旋糖酐酶的克隆表达与应用提供一定理论依据。
1 材料与方法
1.1 材料
1.1.1 培养基
1)2216 E培养基 酵母粉1 g/L,鱼粉蛋白胨5 g/L,陈海水配制;pH 7.8;
2)LB培养基 酵母粉5 g/L,胰蛋白胨10 g/L,NaCl 5 g/L,蒸馏水配制;pH 7.4。
1.1.2 菌株与试剂
1)菌株 Catenovulum sp.DP03菌株:作者所在实验室从海洋环境中筛选得到并保存[13];大肠杆菌DH5α与大肠杆菌BL21(DE3)感受态细胞:购买自全式金生物科技有限公司;大肠杆菌pET29a:作者所在实验室保存。
2)试剂 DNA marker10000:购自 Takara-宝日医生物技术(北京)有限公司;BCA蛋白质质量浓度测定试剂盒、细菌基因组提取试剂盒、高纯度质粒小提试剂盒、琼脂糖凝胶回收试剂盒:购自生工生物工程(上海)有限公司;Taq Plus DNA polymerase、限制性核酸内切酶Not I与Bgl II:购自NEB(北京)有限公司;其他试剂:分析纯,购自国药化学试剂有限公司。
1.2 方法
1.2.1 Catenovulum sp.DP03基因组提取与全基因组测序 将保存于甘油管中的菌Catenovulum sp.DP03在2216E培养基中活化后,使用细菌基因组提取试剂盒提取菌株的基因组,经琼脂糖凝胶电泳检测后送至生工生物工程(上海)有限公司进行全基因组测序,分析测序结果,根据基因注释结果挖掘出其右旋糖酐酶基因序列及蛋白质序列,并对该右旋糖酐酶的蛋白质进行生物信息学分析。
1.2.2 右旋糖酐酶基因克隆 根据右旋糖酐酶基因序列设计如下引物(表1),并使用Taq Plus DNA polymerase聚合酶连锁式反应 (PCR)扩增目的基因;使用琼脂糖凝胶检测并回收目的基因;使用限制性核酸内切酶Not I与Bgl II同时酶切目的基因与pET29a质粒,琼脂糖凝胶回收目的基因与pET29a;使用Solution I将目的基因与载体pET29a连接后转入大肠杆菌DH5α感受态细胞,37℃过夜培养后挑选出阳性克隆,送生工生物工程(上海)有限公司测序以验证克隆子的正确性。

表1 引物Table 1 Primers
1.2.3 重组右旋糖酐酶的表达 使用高纯度质粒提取试剂盒提取重组质粒,取1 μL重组质粒转入大肠杆菌 BL21(DE3)感受态细胞中,37℃过夜培养后挑单菌落于含50 μg/mL卡那霉素的LB液体培养基中,37℃、180 r/min培养6~8 h,使菌体OD600=0.6~0.8,然后按2%接种体积分数接种于100 mL含50 μg/mL卡那霉素的新 LB液体培养基中,在37 ℃、180 r/min 培养 4~6 h,使菌体 OD600=0.6~0.8,然后加入终浓度为0.5 mmol/L异丙基-β-D-硫代半乳 糖 苷 (Isopropyl-beta-D-thiogalactopyranoside,IPTG),置于18℃、180 r/min诱导表达24 h后,离心收集细胞,使用磷酸缓冲盐溶液(phosphate buffer saline,PBS)清洗细胞3次后加入10 mL PBS缓冲液悬浮细胞,使用超声波细胞破碎仪破碎细胞壁,得到重组右旋糖酐酶粗酶液。
1.2.4 重组右旋糖酐酶的纯化 根据重组右旋糖酐酶所带的His标签,使用镍柱亲和层析的方法对粗酶液进行纯化,分别使用含 20、50、70、100、150、200、250 mmol/L咪唑的磷酸盐缓冲液 (50 mmol/L NaH2PO4,300 mmol/L NaCl,咪唑,使用 NaOH 溶液调节pH至8,并使用0.22 μm滤膜过滤除菌)梯度洗脱,并收集洗脱液,然后使用8 g/dL SDS-PAGE电泳检测纯化效果,并使用BCA蛋白质质量浓度测定试剂盒测定粗酶液及各洗脱液的蛋白质质量浓度,同时使用DNS法测定其右旋糖酐酶活力。
1.2.5 右旋糖酐酶活力测定 使用DNS法测定右旋糖酐酶酶活力,方法如下:在一定的温度与pH条件下,将20 μL酶液与180 μL质量分数3%右旋糖酐T70反应一定时间后,在反应体系中加入200 μL DNS终止反应,沸水浴5 min,加入3 mL蒸馏水进行稀释,取200 μL于96孔板中,使用酶标仪读取540 nm处的吸光值,测定其还原糖生成量(以不同质量浓度葡萄糖做标准曲线)。以先加入DNS终止反应后再加入酶液作为对照组,其他与实验组相同。酶活力单位定义(U)为上述反应条件下,每分钟释放 1 μmoL葡萄糖所需的酶量[14]。
1.2.6 重组右旋糖酐酶最适催化温度及pH 以3%右旋糖酐 T70(pH 7)为底物,分别在 20、25、30、35、40、45、50℃下测定重组右旋糖酐酶活力,并计算其酶活力。然后分别配制50 mmol/L不同pH(乙酸-乙酸钠,pH 4.0~5.0; 磷酸盐,pH 6.0~7.5;Tris-HCl,pH 8.0~9.0; 碳酸钠-碳酸氢钠缓冲液:pH 10)的缓冲液,然后用不同缓冲液配制3%右旋糖酐T70为底物,分别在最适温度下测定右旋糖酐酶活力,并计算其酶活力。所有试验均设3个平行。
1.2.7 重组右旋糖酐酶水解右旋糖酐产物分析将重组右旋糖酐酶Cadex2870和Cadex2872与3%右旋糖酐T70(pH 7)分别在45℃和30℃下反应0.5、2、6、24 h,沸水浴 1 min 灭活,然后 1 000 r/min离心1 min,取上清液用0.22 μm滤膜过滤。首先,各取0.5 μL反应液进行薄层层析(TLC)分析该右旋糖酐酶水解右旋糖酐T70产物,展开剂为:5 mL正丙醇、2 mL乙酸乙酯、8 mL乙腈、1 mL乙酸、4.5 mL去离子水;显色剂为:0.2 g地衣酚、10 mL浓硫酸、80 mL无水乙醇、10 mL去离子水;85℃下显色5 min。其次,使用高效液相色谱(HPLC)分析2 h与6 h的产物,以葡萄糖、麦芽糖、麦芽三糖、麦芽四糖、麦芽五糖、麦芽六糖以及麦芽七糖标准品为对照。色谱条件:色谱柱为Waters sugar-Pak1(300 mm×6.5 mm),流动相为去离子水,流速为0.4 mL/min,柱温为75℃,进样量为20 μL。使用Empower GPC软件进行数据采集和处理,计算各产物的峰面积。
2 实验结果
2.1 Catenovulum sp.DP03全基因组测序分析
通过Illumina Hiseq4000平台测序,Catenovulum sp.DP03基因组基本信息见表2。基于测序数据组装得到样品DP03基因组大小为4 417 646 bp,GC含量40.95%,共231个拼接,451个重叠群。基因组组分分析后发现,样品DP03的基因组含有3 801个基因,总长度为3 881 685 bp,平均长度1 021 bp,占基因组全长的88.50%。基因组串联重复序列共144个,总长度为16 943 bp,占基因组全长的0.3863%。小卫星序列76个,微卫星序列27个,tRNA 60个,rRNA 2个。

表2 Catenovulum sp.DP03基因组信息统计Table 2 Information of Catenovulum sp.DP03 DNA
经碳水化合物酶专门数据库 (Carbohydrate-Active enZYmes Database,CAZy) 数据库分析,Catenovulum sp.DP03基因组中含有糖苷水解酶131个,占比42.1%,包括α-木聚糖酶、α-葡糖苷酶、阿拉伯糖苷酶、聚半乳糖醛酸酶、β-半乳糖苷酶、蔗糖磷酸化酶、1,4-α-葡聚糖分支酶 GlgB、淀粉蔗糖酶、α-淀粉酶、果聚糖酶以及右旋糖酐酶等。糖苷转移酶57个,糖水化合物脂酶51个,碳水化合物结合模块45个,多糖裂解酶14个,以及辅助模块的酶13个,见图1。

图1 Catenovulum sp.DP03基因功能注释CAZy图Fig.1 Gene function annotation by CAZy of Catenovulum sp.DP03
2.2 右旋糖酐酶蛋白质序列生物信息学分析
根据基因组注释结果,Catenovulum sp.DP03中含有两个右旋糖酐酶基因,基因编号分别为GL002870与GL002872(对应编码的蛋白质分别称为 Cadex2870与 Cadex2872)。如表3所示,GL002870基因大小为2 511 bp,GL002872基因大小为2 805 bp,分别编码836个氨基酸与935个氨基酸,蛋白质相对分子质量大小分别为92 100与103 200,等电点分别为pI 4.43与pI 4.33,酸性氨基酸残基总数分别为104与106,碱性氨基酸残基总数分别为52与46,疏水性总平均值(GRAVYA)分别为-0.416与-0.377,所以这两种蛋白质均为酸性、亲水性蛋白质。根据SOPMA对其二级结构进行预测,在Cadex2870的二级结构中,9.45%为α螺旋结构 (Alpha helix,h),32.30%为扩展长链(Extended strand,e),6.82% 为β转角结构(Beta turn,t),51.44%为无规则卷曲结构;在Cadex2872的二级结构中,8.02%为α螺旋结构,32.73%为扩展长链,6.20%为β转角结构,53.05%为无规则卷曲结构。Cadex2870与Cadex2872都属于糖苷水解酶GH49家族。Cadex2870与Cadex2872的蛋白质序列与已报道的右旋糖酐酶蛋白质序列相似度比较低。在构建的系统发育树中,Cadex2870与Cadex2872聚为一支,然后与Cellvibrio sp.KY-YJ-3(WP 151055493.1)聚为一支,Cadex2870和Cadex2872序列与其序列相似性分别为49.6%和47.9%,见图2。
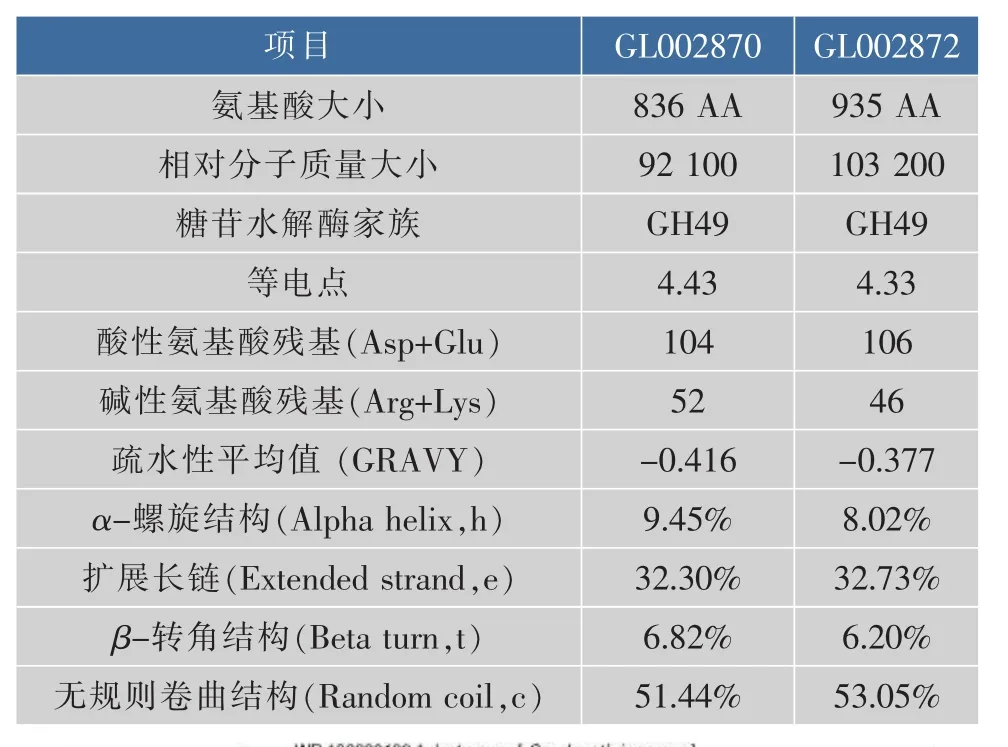
表3 Cadex2870与Cadex2872生物信息学分析Table 3 BioinformaticsanalysisofCadex2870 and Cadex2872
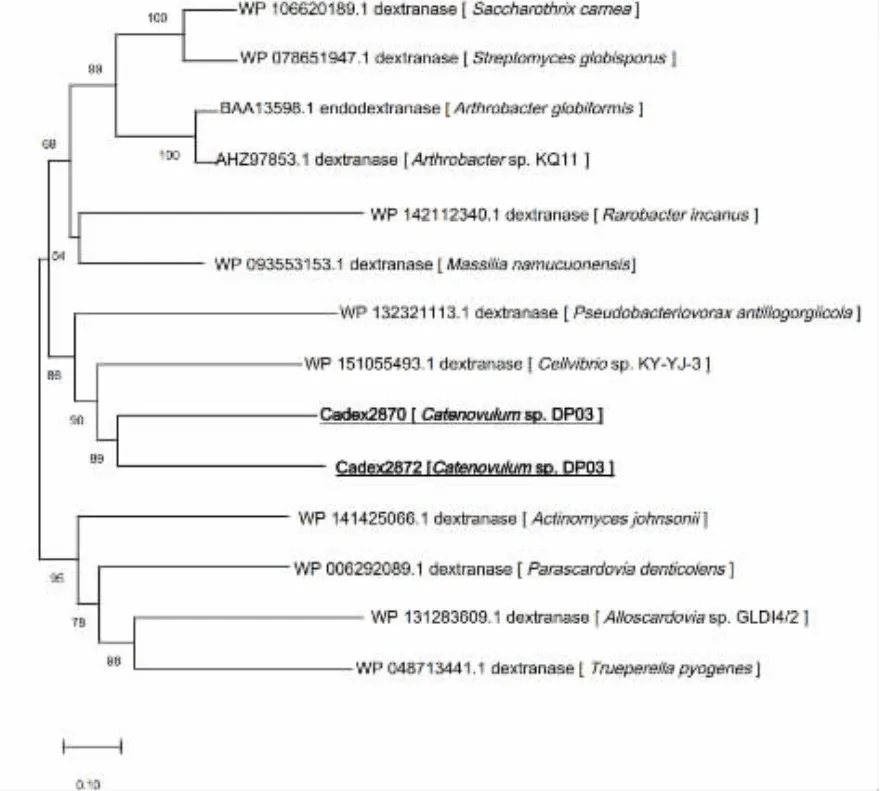
图2 Cadex2870与Cadex2872系统发育树Fig.2 Phylogenetic tree of Cadex2870 and Cadex2872
使用 SWISS-MODLE以 AoDex(Arthrobacter oxidans KQ11)为模板进行三维同源建模,Cadex2870与Cadex2872的整体结构与AoDex的结构整体相似,其相似性分别为54.53%与53.66%,但是在一些片层与环区中仍存在一些差异,见图3,其氨基酸序列比对结果见图4。
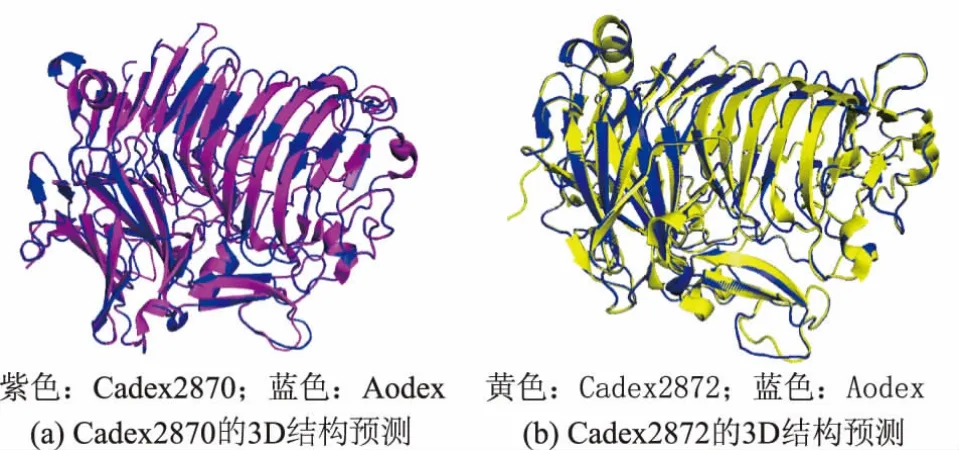
图3 右旋糖苷酶Cadex2870和Cadex2872同源建模与Aodex的结构比较Fig.3 Comparison between Aodex and Cadex2870/Cadex2872
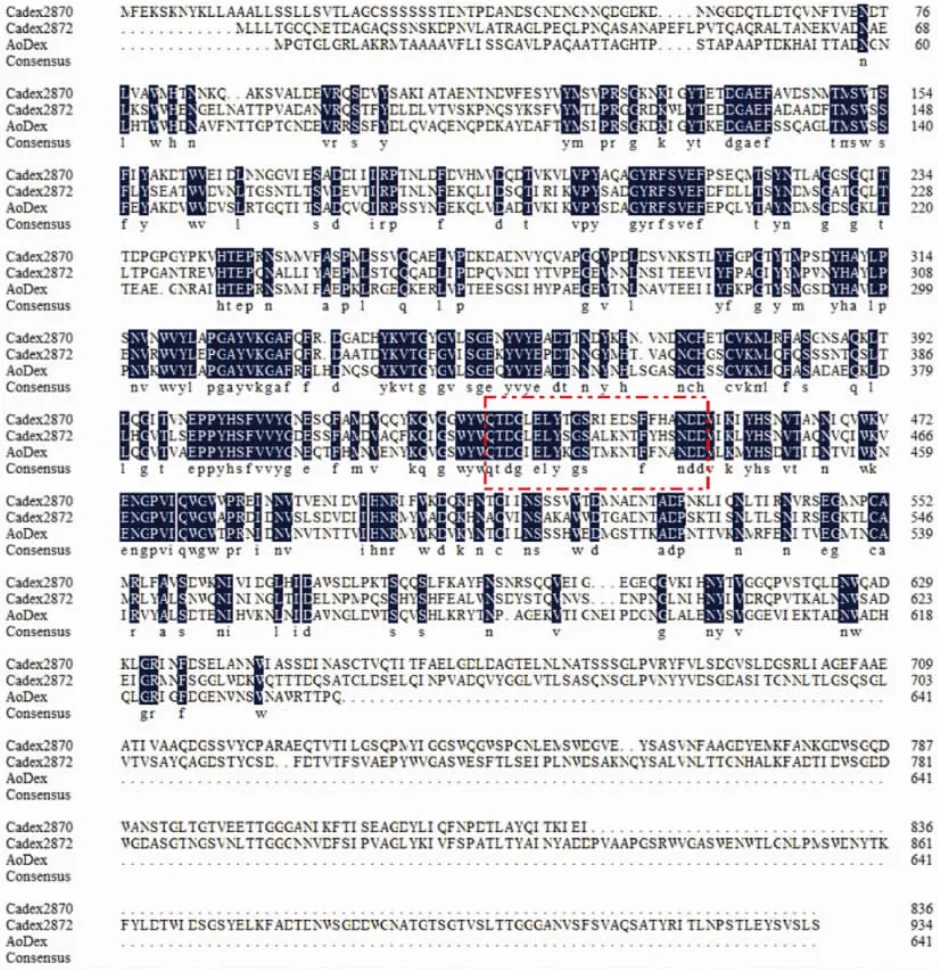
图4 Cadex2870、Cadex2872与Aodex氨基酸序列比对Fig.4 Sequences blast of Cadex2870,Cadex2872 and Aodex amino
2.3 重组右旋糖酐酶的纯化
根据重组右旋糖酐酶所带的His标签,经镍柱亲和层析纯化后,测其不同梯度洗脱液中的蛋白质浓度与右旋糖酐酶活力,并进行8 g/dL的SDSPAGE电泳检测,结果见图5。其相对分子质量大小与经氨基酸序列推测出的相对分子质量大小一致。在镍柱纯化过程中,低浓度咪唑(20~70 mmol/L)能洗脱出非特异性结合蛋白质;而目的蛋白质需要高浓度的咪唑(150~250 mmol/L)才能被洗脱下来。重组右旋糖酐酶Cadex2870与Cadex2872经镍柱纯化之后分别被纯化了20.5倍与9.7倍,得率分别为76.7%与62.8%,纯化之后右旋糖酐酶活力分别为16.2 U/mg 与 4.0 U/mg,见表4。
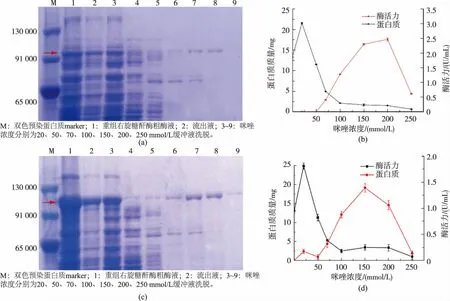
图5 重组右旋糖酐酶Cadex2870(a)和Cadex2872(c)经镍柱纯化的电泳图以及不同浓度咪唑洗脱与蛋白质浓度和酶活力Cadex2870(b)和 Cadex2872(d)的关系Fig.5 Purification of the recombinant dextranase Cadex2870 (a)and Cadex2872 (c)by Ni-column and the relationship between concentration of imidazole with protein and activity of dextranase Cadex2870(b)and Cadex2872(d)

表4 重组右旋糖酐酶的纯化Table 4 Purification of recombinant dextranase
2.4 温度及pH对重组右旋糖酐酶活性的影响
如图6(a)所示,Cadex2870的最适催化温度为45℃,Cadex2872的最适催化温度为30℃,在35~50℃范围内,Cadex2870的活性要高于Cadex2872的活性;在20~30℃范围内,Cadex2872的活性高于Cadex2870 的活性。 如图 6(b)所示,Cadex2870 与Cadex2872的最适催化pH分别为8和7,并且在pH 6~9范围内都具有良好的催化效率,而Cadex2872催化范围相比于Cadex2870的催化范围较广,并且在较酸/碱性条件下催化效率要高于Cadex2870。

图6 温度(a)以及pH(b)对酶活性的影响Fig.6 Effect of temperature(a) and pH(b) on dextranase
2.5 重组右旋糖酐酶水解右旋糖酐产物分析
如图7和表5所示,重组右旋糖酐酶Cadex2870与Cadex2872水解右旋糖酐T70的产物主要为异麦芽七糖、异麦芽五糖以及异麦芽四糖,其中,当水解时间延长时,Cadex2870水解右旋糖酐的产物还伴随有少量的异麦芽糖产生,并且异麦芽四糖的量要高于其他寡糖的量。

图7 重组右旋糖酐酶水解右旋糖酐T70产物分析Fig.7 Products analysis of recombinant dextranases hydrolyzed dextran T70
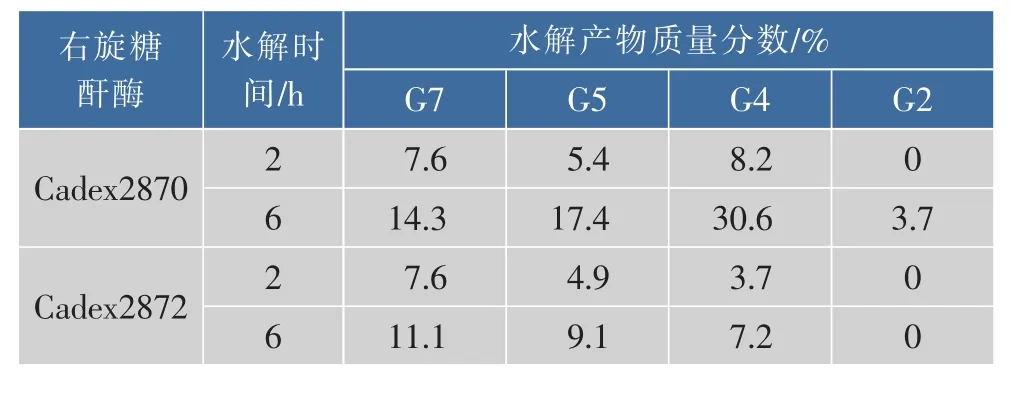
表5 重组右旋糖酐酶水解右旋糖酐T70产物质量分数Table 5 Content of sugar in hydrolysates after enzymatic hydrolysis of dextran by recombinant dextranase
3 讨论
对海洋细菌Catenovulum sp.DP03的全基因组进行了测序,从其基因组中挖掘到两个右旋糖酐酶基因。目前,已有少数的右旋糖酐酶的蛋白质晶体结构已被成功解析,并上传至Protein Date Bank(PDB)数据库中,包括来源于Streptococcus mutans的右旋糖酐酶SmDex[15]、Thermoanaerobacter pseudethanolicus的右旋糖酐酶 TpDex[16]、Penicillium minioluteum的右旋糖酐酶Dex49A[4]以及海洋细菌Arthrobacter oxydans KQ11的右旋糖酐酶AoDex[17]。以海洋细菌A.oxydans KQ11的右旋糖酐酶AoDex为模板进行三维同源建模,Cadex2870与Cadex2872的整体结构与AoDex的结构整体相似,在其N端与C端各有一个结构域,AoDex的催化区域为Q418-D440,分别对应 Cadex2870的 Q431-D453以及Cadex2872的Q425-D447,且在催化位点处具有高度保守性;AoDex中的Asp439与Asp420分别为催化酸和碱,分别对应Cadex2870的Asp433和Asp452,以及Cadex2872的Asp427和Asp446(图4,红色虚线方框内)。
Cadex2870的最适催化温度为45℃,Cadex2872的最适催化温度为30℃,在低温下,Cadex2872催化效率更高,这与一些冷适应性酶性质相似,例如冷适应的β-卡拉胶酶、冷适应的β-葡萄糖苷酶以及冷适应的β-淀粉酶等等,他们在低温下具有更高的活性[18-20]。Cadex2870与Cadex2872的最适催化pH分别为8和7,并且在pH 6~9范围内都具有良好的催化效率,而Cadex2872催化范围相比于Cadex2870的催化范围较广,并且在较酸/碱性条件下催化效率要高于Cadex2870。陆源微生物所产的右旋糖酐酶绝大多数最适催化温度都在45~65℃,最适催化pH在5.0~6.5,并且在低温条件下催化效率较低[21-24]。该两种重组右旋糖酐酶在较低温度下有更高的活性,并且pH作用范围广,因此,该酶在工业应用中具有更高的价值。例如,在低温或者室温条件下的生产过程中,无须加热或者冷却,从而降低生产的成本;还可通过温和的热处理使酶失活,从而快速终止反应[25]。另外,该酶的最适作用温度与pH条件接近人的口腔环境,将该酶作为口腔牙菌斑的防治药物具有潜在价值。并且越来越多的证据表明,碱的产生在pH稳态中起着重要作用,pH稳态可能调节龋病的发生和发展[26-27]。因此,该右旋糖酐酶在用于开发新的海洋药物来治疗这种情况具有重要意义。
Cadex2870与Cadex2872水解右旋糖酐T70的产物主要为异麦芽七糖、异麦芽五糖以及异麦芽四糖,当水解时间延长时,Cadex2870水解右旋糖酐的产物还伴随有少量的异麦芽糖产生,该两种重组右旋糖酐酶与目前所报道的绝大多数右旋糖酐酶的性质相似,他们催化水解右旋糖酐主要产生异麦芽寡糖,而葡萄糖的含量很低或者没有,这类右旋糖酐酶被鉴定为内切型右旋糖酐酶,他们从右旋糖酐的内部水解α-1,6-糖苷键[28-32]。目前所报道的右旋糖酐酶绝大多数都属于内切型右旋糖酐酶,其能够水解右旋糖酐产生异麦芽寡糖,具有很好的应用价值。异麦芽寡糖不会被人体和动物消化吸收,但是能够被肠道的有益微生物双歧杆菌所利用,促使双歧杆菌增殖,但肠道内其他有害微生物如大肠杆菌、金色葡萄球菌则不能利用此糖,从而抑制了肠道有害微生物的生长,使肠道内微生态向良性循环调整。如维持肠道正常细菌群平衡,抑制病原菌与腐败菌生长,维持肠道正常功能;降低胆固醇水平,防治高血压;增强人体免疫功能;双歧杆菌还具有抗肿瘤活性[33-35]。异麦芽寡糖还具有甜度低、难以被胃酶消化,不会改变血液中胰岛素水平,也不会增加血糖等特点,所以糖尿病患者可放心食用[33,36]。除此之外,异麦芽寡糖不会被口腔链球菌利用,因而能够防止龋齿[32-33]。因此,利用该两种重组右旋糖酐酶水解右旋糖酐产生一系列异麦芽寡糖,在生产益生元等功能性食品方面具有很好的前景。
4 结 语
从海洋细菌Catenovulum sp.DP03的全基因组中挖掘出两个右旋糖酐酶基因,其中GL002870基因大小为2 511 bp,编码836个氨基酸,蛋白质相对分子质量大小为 92 100,等电点为 pI 4.43;GL002872基因大小为2 805 bp,编码935个氨基酸,蛋白质相对分子质量大小为103 200,等电点为pI 4.33,都属于酸性、亲水性蛋白质。在Cadex2870的二级结构中,9.45%为α螺旋结构,32.30%为扩展长链,6.82%为β转角结构,51.44%为无规则卷曲结构;在Cadex2872的二级结构中,8.02%为α螺旋结构,32.73%为扩展长链,6.20%为 β转角结构,53.05%为无规则卷曲结构。Cadex2870与Cadex2872都属于糖苷水解酶GH49家族,在系统发育树中,Cadex2870与Cadex2872聚为一支,然后与Cellvibrio sp.KY-YJ-3聚为一支。Cadex2870与Cadex2872的3D结构与AoDex的结构整体相似,其相似性分别为54.53%与53.66%,AoDex的催化区域为Q418-D440,分别对应Cadex2870的Q431-D453以及Cadex2870的Q425-D447,且在催化位点处具有高度保守性。将Cadex2870与Cadex2872基因克隆表达后,得到纯化的Cadex2870的酶活力为16.2 U/mg,Cadex2872的酶活力为4 U/mg,分别被纯化了20.5与9.7倍,得率分别为76.7%与62.8%。Cadex2870与Cadex2872的最适催化温度分别为45℃与30℃,最适催化pH分别为7和8;Cadex2870水解右旋糖酐的产物为异麦芽七糖、异麦芽五糖、异麦芽四糖以及少量异麦芽糖;Cadex2872水解右旋糖酐的产物为异麦芽七糖、异麦芽五糖以及异麦芽四糖,所以,这两种右旋糖酐酶均属于内切型右旋糖酐酶。

